
Задача по химии — 1308

2022-09-14
Сколько граммов нитрата серебра выпадает в осадок из 10 г раствора, насыщенного при $80^ < circ >C$, при охлаждении его до $20^ < circ >C$? Растворимость $AgNO_$ составляет 635 г при $80^ < circ >C$ и 228 г при $20^ < circ >C$.
Найдем состав исходного раствора. Массовая доля вещества в насыщенном растворе ($omega$) связана с растворимостью ($s$) соотношением:
При $80^ < circ >C$ $omega (AgNO_) = frac = 0,864, m(AgNO_) = 10 cdot 0,864=8,64 г$.
Пусть при охлаждении выпало $x$ г $AgNO_$. Тогда масса конечного раствора равна $100-x$, а массовая доля соли в охлажденном растворе равна:
$omega (AgNO_) = frac = frac$, откуда $x = 5,54 г$.
Источник: earthz.ru
Нитрата серебра AgNO3 для металлизации.
Задачи с решениями
Задача 35. Найдите молярную концентрацию 30%-й серной кислоты (плотность раствора 1,22 г/мл).
Решение. Поскольку молярная концентрация и массовая доля растворенного вещества не зависят от общей массы раствора, мы можем выбрать любое удобное количество раствора, например 1 л. Масса раствора т = 1000 • 1,22 = 1220 г. Количество серной кислоты в растворе: v(H2S04) = 1220-0,3/98 = 3,73 моль. Молярная концентрация серной кислоты:

Задача 36. Массовая доля сульфата калия в насыщенном при 10 °С водном растворе 8,44%. Вычислите массу сульфата калия, которая растворится в 100 г воды при этой температуре.
Решение. Обозначим m(K2S04) = х г, /п(р-ра) = 100 + х. Массовая доля K2S04:

Откуда х = 9,22 г.
Задача 37. В 100 мл воды растворили 20 г пентагидрата сульфата меди(П). Рассчитайте массовую долю соли в полученном растворе.
Решение. Для определения массовой доли вещества надо найти две величины: массу вещества и массу раствора. Масса раствора:

Для того чтобы найти массу вещества в этом растворе, надо знать, сколько безводной соли CuS04 (М = 160) содержится в 20 г кристаллогидрата CuS04- 5Н20 (М = 250). Легче всего это сделать через количество вещества:

Масса безводной соли:


Массовая доля сульфата меди(П):
Задача 38. Сколько граммов нитрата серебра выпадает в осадок из 10 г раствора, насыщенного при 80 °С, при охлаждении его до 20 °С? Растворимость AgN03 составляет 635 г при 80 °С и 228 г при 20 °С.
Решение. Найдем состав исходного раствора. Массовая доля вещества в насыщенном растворе (со) связана с растворимостью (s) соотношением:
Сколько граммов нитрата серебра (I) необходимо растворить в скольких граммах воды и подвергнуть

При 80 °С co(AgN03) = 635/735 = 0,864; m(AgN03) = 10-0,864 = = 8,64 г.
Пусть при охлаждении выпало х г AgN03, тогда масса конечного раствора (10 — х). В охлажденном растворе равна массовая доля соли:

Откуда х = 5,54 г.
Ответ. 5,54 г AgN03.
Задача 39. Гексагидрат сульфата цинка и моногидрат сульфата цинка смешали в соотношении (по массе) 1:3. Какую массу такой смеси нужно растворить в 5 моль воды для получения 15%-го раствора сульфата цинка?
Решение. Пусть искомая масса смеси равна х г, тогда /n(ZnSOt • 6Н20) = 0,25л; г, /n(ZnSO4 • Н20) = 0,75л; г. Найдем массу безводного сульфата цинка в составе этой смеси:

Масса полученного раствора: 90 г (масса воды) + х г (масса смеси). Массовая доля сульфата цинка:

Откуда х = 20,0 г.
Ответ. 20,0 г.
Задача 40. Какое количество бария нужно взять, чтобы при его взаимодействии с 1 л воды образовался 2% -й раствор гидроксида бария?

Решение. Запишем уравнение реакции при растворении бария в воде:
Пусть в реакцию вступило х моль Ва, тогда образовалось по х моль Ва(ОН)2 (М = 171) и Н2. Масса вещества Ва(ОН)2 в растворе составляет 171х, масса раствора:

Массовая доля гидроксида бария:

Откуда х = 0,119.
Ответ. 0,119 моль Ва.
Задача 41. Рассчитайте массовые доли веществ в растворе, образовавшемся при действии 25 мл 20% -й соляной кислоты (плотность 1,1 г/мл) на 4,0 г сульфида железа(Н).
Решение. Запишем уравнение реакции растворения сульфида железа(П) в соляной кислоте:

FeS находится в недостатке, и расчет по уравнению реакции надо вести по FeS.
В результате реакции образуется по 0,0455 моль FeCl2 (массой 0,0455 • 127 = 5,78 г) и H2S (массой 0,0455 • 34 = 1,55 г) и расходуется 0,091 моль НС1. В растворе останется 0,151 — 0,091 = 0,06 моль НС1 массой 0,06 • 36,5 = 2,19 г.
Масса полученного раствора

Массовые доли веществ в растворе:

Ответ. 19,3% FeCl2; 7,3% НС1.
Задача 42. Как с помощью одного реагента различить водные растворы HBr, NaF, КОН, А1С13? Напишите уравнения соответствующих реакций и укажите их признаки.
Решение. Удобный реактив для распознавания различных солей — нитрат серебра, который с разными ионами образует осадки разного цвета. AgBr — желтоватый осадок, Ag20 — черно-бурый, AgCl — белый. С фторидом натрия реакция не идет, поскольку фторид серебра растворим в воде.

Задача 43. Как можно доказать наличие примеси сульфида аммония в растворе сульфата натрия?
Решение. Необходимо доказать присутствие в растворе ионов, образующих сульфид аммония, т. е. инонов NH4 и S 2 ~.

Качественная реакция на ион аммония — выделение газа при реакции со щелочью при нагревании:
Качественная реакция на ион S 2- — выделение черного осадка PbS при реакции с Pb(N03)2 в данном случае не годится, поскольку в присутствии сульфата натрия образуется большое количество другого осадка — PbS04. Для доказательства присутствия ионов S 2- можно использовать другую реакцию, а именно — выделение дурно пахнущего газа при действии сильных кислот на сульфиды:

Задача 44. Какие два вещества вступили в реакцию и при каких условиях, если в результате образовались следующие вещества (указаны все продукты реакции без коэффициентов)?
Решение. 1) Карбонат бария образуется при пропускании углекислого газа через раствор гидроксида бария:

2) Это продукты типичной реакции обмена между двумя солями, в результате которой одна из образующихся солей выпадает в осадок:

3) Данная реакция может протекать при нейтрализации кислой соли одного из металлов (бария или кальция) гидроксидом другого металла:
Источник: ozlib.com
Как правильно рассчитать массу вещества с использованием коэффициента растворимости
Задача 451.
Сколько граммов нитрата калия выкристаллизуется из 105 г насыщенного при б0 °С раствора, если охладить его до 0 °С? Коэффициенты растворимости соли при указанных температурах соответственно равны 110 и 13 г в 100 г Н2О.
Решение:
Коэффициент растворимости – это масса вещества, растворяющегося при данных условиях в 100 г воды с образованием насыщенного раствора.
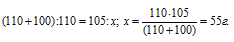
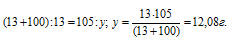
Таким образом, при охлаждении раствора нитрата калия в осадок выпадет 42,92 г соли (55 – 12,08 = 42, 98).
Ответ: 42,98 г.
Задача 452.
1 л воды насыщен СО2 при 0°С под давлением 506,6 кПа (3800 мм рт. ст.). Какой объем займет растворенный газ, если выделить его из воды и привести к нормальным условиям? Растворимость СО2 при 0°С равна 171 мл в 100 мл Н2О.
Решение:
Находим объём газа СО2 при заданных условиях из пропорции:
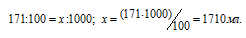
Согласно закону Генри 1 масса газа, растворённого при постоянной температуре в данном объёме жидкости, прямо пропорциональна парциальному давлению газа. Следовательно, объём, который будет занимать 1710 мл СО2 при нормальных условиях найдём по уравнению:
V1- объём газа при определённом давлении, V2 — объём газа приведенного к нормальным условиям, P1 — давление газа при определённых условиях, P2 — нормальное давление.
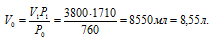
Ответ: 8,55л.
Задача 453.
Растворимость аммиака при 20 °С равна 702 мл в 1 мл воды. Найти массовую долю аммиака в насыщенном растворе. Парциальное давление NH3 считать равным нормальному атмосферному давлению.
Решение:
Согласно закону Авогадро 1 моль любого газа при нормальных условиях занимает 22,4л.
Рассчитаем массу NH3, содержащуюся в 702 мл раствора из пропорции:
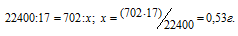
Массовую долю аммиака рассчитаем по формуле:


— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
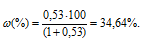
Ответ: 34,64%.
Задача 454.
В 1 л воды при 0 °С растворяется 4,62 л H2S. Под каким давлением надо растворять H2S, чтобы получить 5%-ный (по массе) раствор?
Решение:
Находим массу H2S, растворённого в 1 л воды из пропорции:
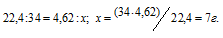
Массовую долю сероводорода рассчитаем по формуле:


— массовая доля растворённого вещества; m(в-ва) — масса растворённого вещества; m(р-ра) — масса раствора.
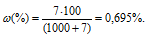
Значит, массовая доля 5%-ного раствора больше исходного в 7,2 раза (5/0,695 = 7,2).
При температуре 0 °С парциальное давление сероводорода равно 101,325 кПа. Известно, что масса газа, растворённого при постоянной температуре в данном объёме жидкости, прямо пропорциональна парциальному давлению газа. Масса газа в 5%-ном растворе будет равна:
Теперь рассчитаем давление, при котором эта масса H2S растворится в 1 л воды из пропорции:
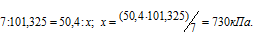
Ответ: 730 кПа.
1 Закон Генри — физический закон, согласно которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Назван по имени английского химика Уильяма Генри.
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Схемы распределения электронов по d-орбиталям центрального атома комплексного иона | Задачи 739 — 744
Источник: buzani.ru