При электролизе водных растворов с растворимым анодом необходимо учитывать металл анода, так как он будет принимать участие в электродной реакции. Если потенциал металла отрицательнее потенциала гидроксо – группы, то на аноде будет идти растворение металла. В случае, когда величины потенциалов металла и гидроксо – группы близки, процесс растворения металла может проходить одновременно с выделением кислорода.
Пример 2.
Напишите уравнения процессов, протекающих на кадмиевых электродах, при электролизе водного раствора сернокислого кадмия и рассчитайте выход вещества по току на катоде, если при прохождении через электролит 1 фарадея электричества выделилось 28 г металла.
Ионный состав электролита:
При распределении ионов по электродам надо учитывать, что кадмиевый анод относится к растворимым электродам. К кадмиевому аноду будут перемещаться отрицательно заряженные сульфат – ионы и ионы гидроксила. То есть на аноде будут присутствовать три частицы: Анион на аноде не окисляются, поэтому остаются две частицы и Находим их потенциалы в приложении и выбираем частицу с более отрицательным потенциалом, которая будет окисляться на аноде в первую очередь.
Сколько граммов хлора выделится на аноде при электролизе 500г 2,34-го раствора хлорида на(2007/1/22)
(в нейтральной среде).
Сравнивая эти два потенциала видим, что более отрицательный потенциал у кадмия, то есть кадмиевый анод будет растворяться:
К катоду из раствора будут перемещаться положительно заряженные ионы водорода и ионы кадмия с соответствующими потенциалами:
(в нейтральной среде).
Так как их потенциал близки, и кадмий относится ко второй группе окислителей таблицы стандартных потенциалов, то на катоде будут происходить два восстановительных процесса:
Выход металла по току рассчитываем по формуле:
Массу теоретически выделившегося кадмия рассчитывают по первому закону Фарадея:
где Q – количество электричества, прошедшие через электролит, равное 1 Фарадею или 96500 кулон; F– число Фарадея, равное 96500 кулонов; – молярная масса эквивалента кадмия, которую рассчитывают по формуле:
= A(Cd)/B (Cd) =112/2 = 56г/моль.
Тогда масса кадмия теоретически будет равна:
Выход кадмия по току:
Пример 3.
Сколько граммов едкого калия образовалось у катода при электролизе раствора если на аноде выделилось 11,2 л кислорода измеренного при н.у.? Напишите уравнения электродных процессов.Электроды инертные.
Ионный состав электролита:
Под действием приложенного напряжения к положительно заряженному аноду будет притягиваться отрицательно заряженному анионы и из воды; к катоду – катионы калия и водорода. На аноде пойдет процесс окисления воды, так как анионы окисляться не будут:
На катоде пойдет процесс восстановления воды, так как потенциал калия –2,92 В более отрицательный, чем водорода (-0,41В), и из раствора восстанавливаться не будет:
По второму закону Фарадея можно записать:
то есть число эквивалентов вещества, выделившегося при электролизе у одного электрода, равно числу эквивалентов вещества, выделившегося у другого электрода.
Сколько граммов кадмия выделится на катоде (инертный электрод) при электролизе 250 мл 0,4
Объем эквивалента кислорода при н.у. равен 5,6 л, эквивалент едкого калия можно рассчитать по формуле:
Тогда масса образовавшегося около катода едкого калия будет равна:
Пример 4.
Какие реакции протекают на электродах при электролизе раствора сульфата цинка с цинковым анодом.
Ионный состав электролита:
К цинковому аноду будут притягиваться отрицательно заряженные частицы из раствора: и ионы гидроксила , образующиеся при диссоциации воды так же необходимо учесть потенциал самого анода, так как цинковый анод растворимый.
Так как ионы не окисляются на аноде и потенциал цинка более отрицательный, чем потенциал окисления из воды, то на цинковом аноде происходит только процесс растворения цинка:
Так как цинк относится ко второй группе окислителей – его потенциал близок потенциалу восстановления водорода (в нейтральной среде), на катоде будут протекать две реакции: восстановление цинка и восстановление ионов водорода из воды:
Контрольные задания
161 *. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора BaCl2с угольными электродами. Что такое поляризация в процессах электролиза? Какие виды поляризации вы знаете и каковы причины их возникновения?
162 *. При электролизе водного раствора SnCl2на аноде выделилось 4,43 литра Cl2(условия нормальные). Какое вещество и в каком количестве выделилось на катоде? Напишите схему электролиза.
163 *. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора FeCl3с инертным анодом. Какова последовательность окисления ионов и молекул на аноде при электролизе солей различных типов?
164 *. Какой объем кислорода (н.у.) выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор KOH? Напишите схему электролиза водного раствора KOH.
165 *. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора Ca(NO3)2с инертными электродами. Какова последовательность восстановления ионов и молекул на катоде при электролизе солей различных типов?
166 *. При какой силе тока можно получить на катоде 0,5 г никеля, подвергая электролизу раствор NiSO4в течение 25 мин? Напишите схему процесса электролиза.
167 *. При электролизе раствора хлорида двухвалентного металла на аноде выделилось 560 мл газа (условия нормальные), а на катоде за это же время выделилось 1,6 г металла. Какой это металл? Напишите схему электролиза раствора соли.
168 *. Какая масса серебра выделится при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 мин? Напишите схему процесса электролиза раствора нитрата серебра.
169. При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Определите атомную массу металла.
170 *. При электролизе водного раствора Cr2(SO4)3 током силой 2 А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз? Напишите схему процесса электролиза.
КОРРОЗИЯ МЕТАЛЛОВ
Примеры решения задач
Коррозия – это разрушение металлов в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты коррозии. Различают химическую коррозию и электрохимическую.
Химическая коррозия –характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания различают:
а) газовую коррозию–в газах, обычно при высокой температуре, при действии на металл, сухого газа, например , и др.
б) коррозию в растворах неэлектролитов – агрессивных органических жидкостях, например, сернистая нефть.
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодные растворения металла и катодные восстановления окислителя внешней среды. Окислителями при этом служат молекулы кислорода , растворенные в воде, хлора , ионы водорода , , и др. Электрохимическая коррозия может протекать:
а) в электролитах водных растворах солей, кислот, щелочей, морскою воды;
б) в атмосфере любого влажного газа;
Механизм электрохимической коррозии заключается в следующем.
На анодных участках коррозирующего металла протекает процесс анодного окисления металла:
На катодных участках протекает процесс катодного восстановления окислителей.
Наиболее часто при коррозии наблюдается восстановление кислорода:
В нейтральной или щелочной среде
и выделение водорода
Кроме анодных и катодных реакций при электрохимической коррозии происходит движение электронов в металле и ионов в электролите, в котором металл находится. Протекают вторичные химические реакции. Например, взаимодействие ионов металла, образующихся на анодных участках, с гидроксид–ионами, образующихся в результате катодных процессов:
где –является продуктом коррозии металла.
Процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а движутся внутри металла.
Коррозия – процесс самопроизвольный, и энергия Гиббса реакций имеет отрицательно значения. Так как , возможность протекания коррозии может быть установлена по знаку ЭДС элемента. Если ЭДС имеет положительное значение > 0) то коррозия, возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя то коррозия возможна при условии, что потенциал окислителя положительнее потенциала металла:
Источник: cyberpedia.su
Защитные покрытия: дешевле, экологичнее, долговечнее
В Пензе предложили промышленности новый способ производства деталей
Ученые подведомственного Минобрнауки России Пензенского государственного университета (ПГУ) запатентовали способ нанесения композиционного электрохимического покрытия кобальт-карбид вольфрама. Защитные и износостойкие покрытия, в том числе для металлорежущих инструментов, металлообработки, а также покрытия для корпусных деталей, элементов отделки домов, станут долговечнее и дешевле. А их производство и использование будут наносить значительно меньший урон окружающей среде. Способом заинтересовалось ведущее предприятие по изготовлению и поставке средств телекоммуникации и связи специального назначения.
Выйти из полноэкранного режима

Развернуть на весь экран
В основу получения покрытия кобальт-карбид вольфрама положен физико-химический процесс электролиза
Фото: Предоставлено пресс-службой ПГУ
Научный коллектив вуза много лет занимается разработкой электрохимических технологий и различных материалов. Недавно ученые завершили работу в рамках госзадания, где перед ними стояла задача получить сфероидальные частицы карбида вольфрама.
Карбид вольфрама активно применяется для изготовления инструментов, требующих высокой твердости. Этот материал применяется для изготовления различных резцов, шлифовальных дисков, сверл, фрез, инструментов для бурения скважин и так далее.
Один из разработчиков способа — Сергей Киреев, доктор технических наук, профессор, декан факультета промышленных технологий, электроэнергетики и транспорта ПГУ, рассказал, что главная проблема использования этого материала — его качество.
В настоящий момент существуют несколько десятков способов его получения. Все они имеют свои преимущества и недостатки. Ученым ПГУ удалось обойти все проблемные места предшественников и предложить промышленности новый, отвечающий всем современным запросам способ.
Выйти из полноэкранного режима
Развернуть на весь экран
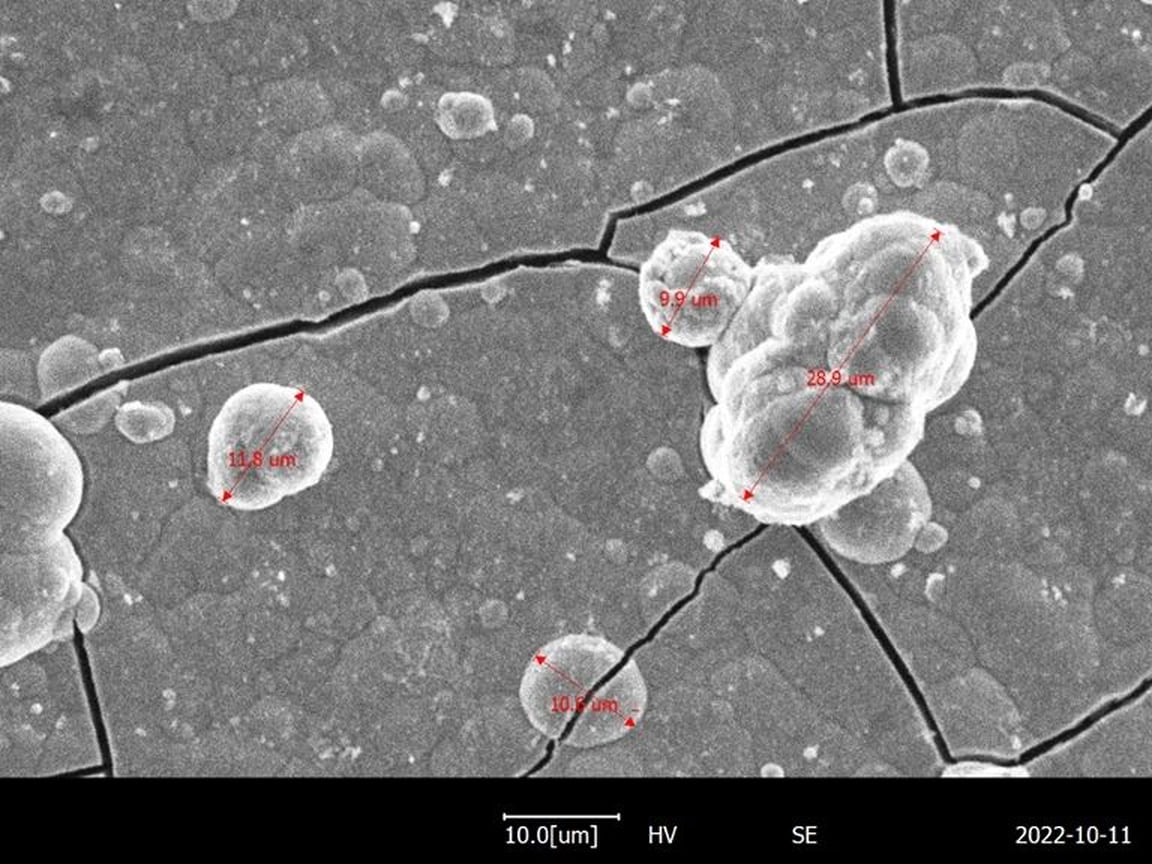
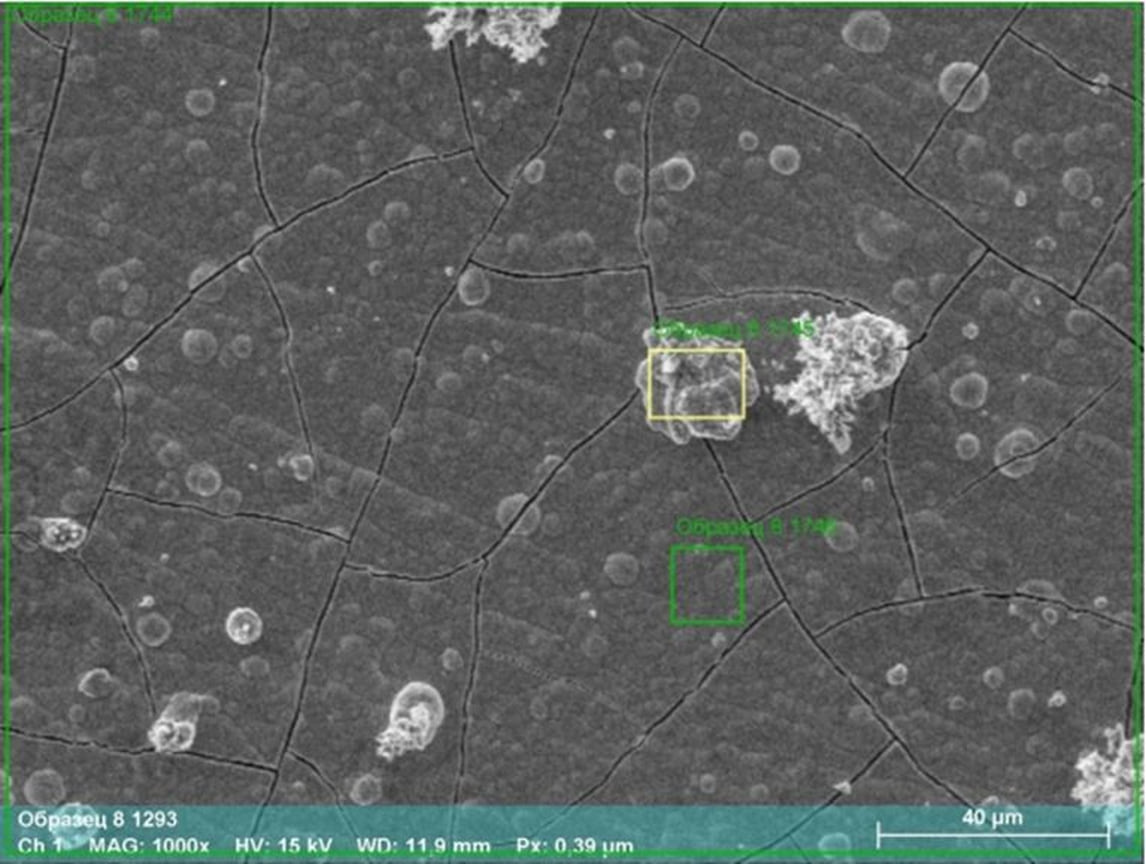
Карбид вольфрама под микроскопом
Фото: Предоставлено пресс-службой ПГУ
Карбид вольфрама под микроскопом
Фото: Предоставлено пресс-службой ПГУ
В основу производства покрытия кобальт-карбид вольфрама положен процесс электролиза.
«В воде растворяются вещества — соли кобальта, борная кислота, уротропин, ряд органических добавок, частицы карбида вольфрама. Отмечу, последние нерастворимы. Говоря простыми словами, это все “перемешивается магнитной мешалкой”. Как раз этот процесс не дает частицам карбида вольфрама оседать. Далее мы погружаем в раствор электроды (катод и анод), подаем электрический ток.
На поверхности катода в ходе физико-химической реакции образуется композиционное покрытие кобальт-карбид вольфрама. Таким способом можно наносить это покрытие на различные металлические детали»,— объясняет Сергей Киреев.
Научный коллектив заменил некоторые вещества, что позволило повысить электропроводность раствора и его производительность. Рабочая температура процесса — от 18 до 25 градусов Цельсия. Отметим, в аналогичных способах требуется температура в 50 градусов. Способ, предложенный в ПГУ, экономичнее в два раза, электроэнергии на нагрев и поддержание температуры смеси требуется в разы меньше. К тому же добавление уротропина улучшает смачиваемость поверхности детали с покрытием и предотвращает коррозию.
Испытание технологии и полученного покрытия проходило на одном из крупнейших предприятий Пензенской области — в федеральном научно-производственном центре «Производственное объединение “Старт” им. М. В. Проценко». Он входит в госкорпорацию «Росатом».
Покрытие кобальт-карбид вольфрама получилось твердым, износостойким, прочно защищающим изделия от коррозии и с высокой адгезионной прочностью. Последняя отвечает за надежность сцепления покрытия с поверхностью детали.
Среди прочих преимуществ — внедрение способа в промышленность позволит улучшить экологию и сохранить здоровье работникам предприятий и людям, пользующимся продукцией с такими покрытиями.
Выйти из полноэкранного режима

Развернуть на весь экран
Профессор Сергей Киреев (справа) со студентами в лаборатории
Фото: Предоставлено пресс-службой ПГУ
Сергей Киреев говорит, что раннее известные способы получения таких покрытий представляют экологическую опасность и токсичны для живых организмов, вызывают аллергические реакции. К ним относятся покрытия на основе хрома, никеля. Утилизировать продукты, использующиеся при их производстве,— дорого и экологически небезопасно.
«Мы ушли от тех недостатков, которые были у аналогов. Испытания подтвердили, что микротвердость, износостойкость и другие параметры в нашем способе остаются такими же. Все преимущества мы сохраняем, при этом снижаем экологический ущерб и значительно удешевляем производство таких покрытий»,— констатирует Сергей Киреев.
Сейчас научный коллектив ПГУ сотрудничает с ведущим предприятием по изготовлению и поставке средств телекоммуникации и связи специального назначения — производственным объединением «Электроприбор». В планах — провести дополнительные испытания и внедрять запатентованный способ в производство.
Способ нанесения композиционного электрохимического покрытия кобальт-карбид вольфрама будет интересен и полезен для разных сфер: и для промышленности, и для строительства, и в быту. Эти покрытия можно использовать в качестве защитных и износостойких для различных изделий машиностроения, корпусных деталей, элементов отделки помещений, в строительстве.
Подготовлено при помощи Минобрнауки.
Источник: www.kommersant.ru