Задача 183.
Среди приведенных ниже электронных конфигураций указать невозможные и объяснить причину невозможности их реализации: а) 1р 3 б) 3p 6 в) 3s 2 ; г) 2s 2 ; д) 2d 5 ; е) 5d 2 ; ж) 3f 12 ; з) 2р 4 и) 3p 7 .
Решение:
а) Электронная конфигурация 1p 3 не реализуется, потому что первый энергетический уровень (n = 1 ) содержит только s-подуровень. Максимальное число электронов на каждом энергетическом уровне равно 2n 2 , где n — главное квантовое число. Так на первом энергетическом уровне (n = 1) может находиться максимальное число электронов 2(2 . 1 2 = 2). Следовательно, не только неправильно указан подуровень, но общее число электронов.
б) 3p 6 – электронная конфигурация возможна, потому что на третьем энергетическом уровне содержатся s-, p- и d-подуровни. На p-подуровне содержится три атомные орбитали, а в каждой орбитали, согласно правилу Хунда, может находиться максимальное число электронов равное двум. Поэтому на 3p-подуровне может максимально находиться шесть электронов (3 . 2 = 6).
ВСЕ типы задания 1 из ЕГЭ по химии 2023 | Как решать?
в) Электронная конфигурация 3s 2 верна, потому что на третьем энергетическом уровне (n = 3) находятся s-, p- и d-подуровни. Согласно правилу Хунда, на s-подуровне, состоящем из одной атомной орбитали, может находиться максимальное число электронов равное двум.
г) Электронная конфигурация 2s 2 реализуется, потому что на втором энергетическом уровне (n = 2) содержатся s- и p-подуровни, и на s-подуровне, в его единственной атомной орбитали, может содержаться максимальное число электронов равное двум.
д) Электронная конфигурация 2d5 не реализуется, потому что во втором энергетическом уровне (n = 2) d-подуровень не содержится, в этом слое расположены только s- и p-подуровни.
е) Электронная конфигурация 5d 2 реализуется, потому что на пятом энергетическом уровне (n = 5) содержатся s-, p- d- и f-подуровни. Подуровень d содержит пять атомных орбиталей, в которых может находиться максимальное число электронов равное десяти (5 . 2 = 10). Запись 5d 2 означает, что на 5d-подуровне содержится два неспаренных электрона.
ж) Электронная конфигурация 3f 12 не реализуется, потому что на третьем энергетическом уровне (n = 3) могут находиться только s-, p- и d-подуровни.
з) Электронная конфигурация 2p4 реализуется, потому что на втором энергетическом уровне (n = 2) могут находиться только s- и p-подуровни. Подуровень p состоит из трёх атомных орбиталей, на которых, согласно правилу Хунда, может находиться до шести электронов.
и) Электронная конфигурация 3p7 не реализуется, потому что на p-подуровне, состоящем из трёх атомных орбиталей, согласно правилу Хунда, максимальное число электронов равно 6.
Задача 184.
Сколько вакантных Зd-орбиталей имеют возбужденные атомы: а) С1; б) V; в) Мn?
Решение:
а) электронная конфигурация атома хлора имеет вид: …3s 2 3p 5 3d 0 . Графическое заполнение валентного энергетического слоя атома хлора можно представить следующей схемой:
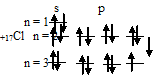
Вопрос 1 ЕГЭ по химии. Как определить число спаренных электронов
Таким образом, внешний энергетический уровень атома хлора имеет свободные орбитали на 3d-подуровне, что позволяет электронам переходить в возбуждённое состояние (перемещаться на более высокие свободные орбитали). У атома хлора возможно три состояния перемещения электронов на более высокие свободные орбитали, электроны с s- и p-подуровней переходят на 3d-подуровень:
1) При затрате некоторой энергии один из 3p-электронов атома хлора может быть переведён на вакантную 3d-орбиталь, при этом энергия атома возрастает, так что возникающая электронная конфигурация (1s 2 2s22p 6 3s 2 3p 4 3d 1 ) соответствует одному из возбуждённых состояний атома хлора. Графически это можно представить схемой:
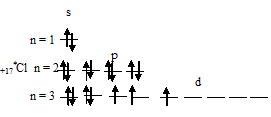
В данном случае 3d-подуровень содержит четыре вакантные орбитали возбуждённого атома хлора.
2) При затрате некоторой энергии два из 3p-электронов атома хлора могут быть переведены на вакантные 3d-орбитали, при этом энергия атома возрастает, так что возникает электронная конфигурация (1s 2 2s 2 2p 6 3s 2 3p 3 3d 2 ), которая соответствует одному из возбуждённых состояний атома хлора. Графически это можно представить схемой:
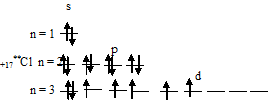
В таком возбуждённом состоянии атом хлора содержит три вакантные 3d-орбитали.
3) При затрате некоторой энергии один из 3s- и два 3p-электронов могут быть переведены на свободные 3d-орбитали, при этом энергия атома возрастает, так что возникающая конфигурация (1s 2 2s 2 2p 6 3s 1 3p 3 3d 3 ) также соответствует одному из возможных состояний хлора:
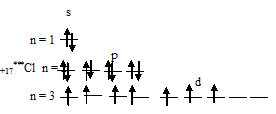
б) Электронная конфигурация валентного энергетического уровня атома ванадия имеет вид: …3d 3 4s 2 . Графическая схема заполнения электронами имеет вид:
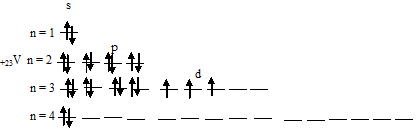
В возбуждённом состоянии атома ванадия один 4s-электрон может быть переведён на свободную 3d-орбиталь, так что возникающая электронная конфигурация валентного уровня (3d 4 4s 1 ) соответствует возбуждённому состоянию атома ванадия, что можно представить в виде схемы:
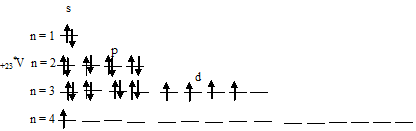
При возбуждении атома ванадия остаётся вакантной одна 3d-орбиталь.
в) Электронная конфигурация валентного энергетического уровня атома марганца имеет вид: …3d 5 4s 2 . Графическая схема заполнения электронами имеет вид:
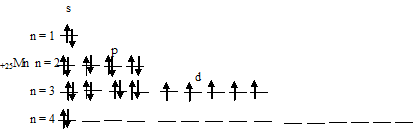
При возбуждении атома марганца один s-электрон переходит на 3d-орбиталь, при этом получается электронная конфигурация валентного уровня (3d 6 4s 1 ) соответствует возбуждённому состоянию атома марганца, что можно представить в виде схемы:
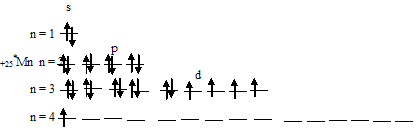
Из схемы вытекает, что при возбуждении атома марганца свободных d-орбиталей нет, так как на 3d-подуровне распределяются два спаренных электрона и четыре неспаренных. Таким образом, атом марганца ни в основном, ни в возбуждённом состоянии не имеет свободных d-орбиталей.
Задача 185.
Сколько неспаренных электронов содержат невозбужденные атомы: а) В; б) S; в) Аs; г) Сг; д) Нg; е) Еu?
Решение:
а) Электронная формула атома бора 1s 2 2s 2 2p 1 . Валентность орбитали в этом атоме являются орбитали внешнего (второго) электронного, т.е. 2s-, 2p-орбитали. Графическая схема заполнения электронами этих орбиталей имеет следующий вид:
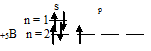
Следовательно, атом бора содержит один неспаренный 2p-электрон.
б) Электронная конфигурация валентного электронного слоя атома серы имеет вид: …2s 2 2p 4 . Графическая схема заполнения электронами этого слоя имеет следующий вид:
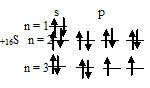
Следовательно, атом серы в стационарном состоянии содержит два неспаренных электрона -, 2p-подуровне.
в) Электронная конфигурация валентного электронного слоя атома мышьяка имеет вид: …4s 2 4p 3 . Графическая схема распределения валентных электронов имеет следующий вид:
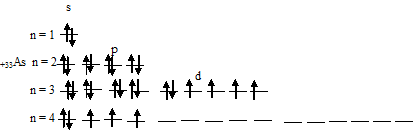
Таким образом, атом мышьяка имеет три неспаренных электрона на 4p-подуровне.
г) Электронная конфигурация валентного электронного слоя атома хрома имеет вид: …3d 5 4s 1 . Графическая схема заполнения электронами этого слоя имеет следующий вид:
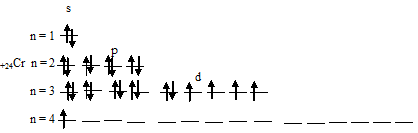
Следовательно, атом хрома в стационарном состоянии содержит шесть неспаренных электронов, из которых пять на 3d-подуровне и один на 4s-подуровне.
д) Электронная конфигурация валентного электронного слоя атома ртути имеет вид: … 6s 2 6p 0 . Графическая схема заполнения электронами этого слоя имеет следующий вид:
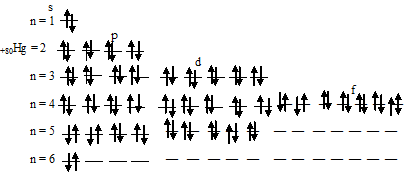
Атом ртути не содержит ни одного неспаренного электрона.
е) Электронная конфигурация валентного электронного слоя атома европия имеет вид: …4f 7 6s 2 . Графическая схема заполнения электронами этого слоя имеет следующий вид:
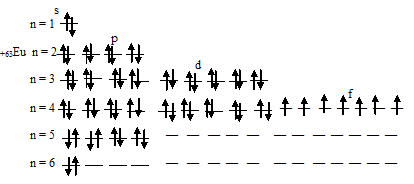
Таким образом, атом европия содержит семь неспаренных 4f-электронов.
Ответ: а) 1; б) 2; в) 3; г) 6; д) 0; е) 7.
Задача 186.
Составить электронно-графические схемы ионов Ее 2+ и Ее 3+ . Чем можно объяснить особую устойчивость электронной конфигурации иона Ее 3+ ?
Решение:
Электронная формула атома железа имеет вид: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 . Графическая схема размещения электронов в квантовых ячейках атома железа будет иметь следующий вид:
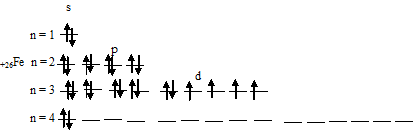
При отдаче двух 4s-электронов атомом железа образуется ион Ее 2+ , графическая схема размещения электронов в котором будет иметь вид:
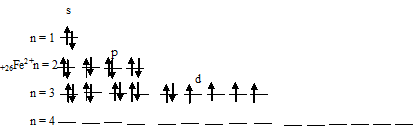
При отдаче трёх электронов (двух 4s- и одного 3d) атомом железа образуется ион Ее 3+ , графическая схема размещения электронов в котором будет иметь вид:
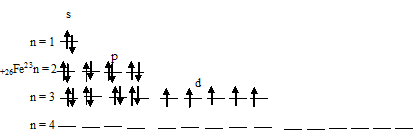
Таким образом, на внешнем энергетическом уровне иона Ее 2+ содержится два 3s-, шесть 3p- и шесть 3d-электронов. Причём на 3d-подуровне содержатся четыре неспаренных и два спаренных электрона. Ион Ее 3+ отличается от Ее 2+ тем, что содержит на 3d-подуровне на один электрон меньше, и все они неспаренные, такая система 3d-подуровня является энергетически более устойчивой. Электростатическое взаимодействие между ядром и электронной плотностью у иона Ее 3+ больше, чем у иона Ее 2+ .
Задача 187.
Указать особенности электронных конфигураций меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов?
Решение:
Так как число электронов в атоме элемента равно его порядковому номеру, то общее число электронов в атоме меди и хрома соответственно равно 29 и 24.
Последовательность заполнения энергетических уровней и подуровней в атоме элемента определяется правилами Клечковского, согласно которым электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией (меньшая сумма n + l). Порядок заполнения подуровней определяется правилом Хунда. Согласно правилу Хунда, минимальной энергии атома соответствует такое распределение электронов по атомным орбиталям данного подуровня, при котором абсолютное значение суммарного спина атома максимально.
Электронные формулы атомов хрома и меди можно выразить следующим образом:
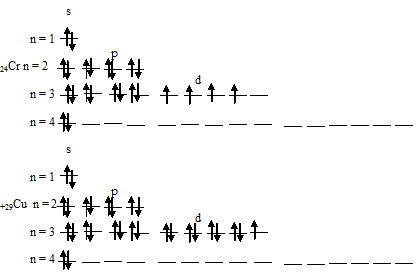
Экспериментально установлено, что на внешнем энергетическом уровне у хрома и меди находится по одному электрону. Объясняется это тем, что произошёл «провал» одного 4s-электрона у атомов хрома и меди на 3d-подуровень. Происходит это потому, что энергетически выгодным состоянием является состояние атома, когда при четырёх неспаренных электронах на 3d-подуровне происходит заполнение пятой свободной атомной орбитали. Поэтому электронная формула атома хрома имеет следующий вид: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 .
У атома меди все атомные орбитали 3d-подуровня заполнены, причём четыре полностью, а на пятой находится один неспаренный электрон. Такая система 3d-подуровня, состоящая из девяти электронов является энергетически неустойчивой, и поэтому происходит «провал электрона с 4s-орбитали на 3d-орбиталь. Электронную формулу атома меди можно теперь представить следующим образом: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 .
Таким образом, атомы хрома и меди на внешних энергетических уровнях содержат по одному 4-электрону. Графические схемы распределения электронов по квантовым ячейкам у атомов хрома и меди в стационарном состоянии будут иметь следующий вид:
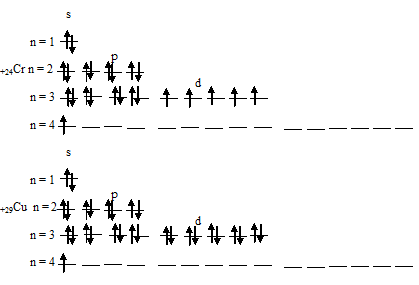
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Равновесие в системе, рН среды. Задачи 1134 — 1135
Источник: buzani.ru
ЕГЭ ПО ХИМИИ. ЗАДАНИЕ № 1. СТРОЕНИЕ АТОМА
По-моему скромному мнению, именно этот вопрос в тестовой части ЕГЭ по химии является самым сложным. Если честно попытаться разобраться в теории и научиться давать правильный ответ обоснованно, то придётся немного попотеть, так как эта часть химической теории очень тесно связана с физикой. (Но не выходит, конечно, при этом за пределы школьной программы.)
В течение ближайших недель мы обязательно поговорим о внутреннем устройстве атомов обстоятельно, и попробуем во всём разобраться. А пока давайте лишь только вспомним те правила и законы, которые используют химики для предсказания строения электронных оболочек атомов.
Сколько неспаренных электронов у серебра











Последнее обновление
12 декабря 2021г.
Атом — мельчайшая химически неделимая частица вещества.
В центре атома находится ядро, состоящее из протонов и нейтронов. Протоны имеют единичный положительный заряд и массу. Нейтроны имеют такую же по величине массу, но не имеют заряда. Вокруг ядра движутся электроны. Они имеют единичный отрицательный заряд, а их масса настолько мала, что условно принимается за ноль
Порядковый номер элемента в таблице Д.И.Менделеева соответствует количеству протонов и электронов в атоме, т.к. в целом атом электронейтрален.
Количество нейтронов определяется разностью между массовым числом и количеством протонов.
Совокупность всех электронов в атоме называют электронной оболочкой. Электроны, обладающие близкими значениями энергии образуют единый электронный слой или энергетический уровень. Количество энергетических уровней в атоме соответствует номеру периода. Каждый последующий уровень устроен сложнее предыдущего.
Так первый энергетический уровень имеет только s-орбитали, второй — s и три р-орбитали, на третьем добавляются пять d-орбиталей, на четвертом — семь f-орбиталей. Каждую орбиталь могут занимать два электрона.
Посмотреть презентацию «Расположение и движение электронов» (щелкнуть по ссылке и, если скачать, то в презентации можно посмотреть движение электронов)
Расположение электронов описывается электронной формулой.
Порядок заполнения орбиталей электронами для элементов первых пяти периодов следующий:
При заполнении электронами d-подуровня следует помнить о явлении, которое называется «проскоком электрона». Дело в том, что энергетически устойчив d-подуровень, если он заполнен электронами наполовину (5 электронов) или полностью (10 электронов). Поэтому у элементов VI группы побочной подгруппы хрома и молибдена один из электронов переходит на d-орбиталь и вместо s 2 d 4 электронная конфигурация будет s 1 d 5 . У элементов I группы побочной подгруппы меди, серебра и золота вместо s 2 d 9 будет s 1 d 10 .
Элементы, расположенные в одной и той же группе главной подгруппе имеют сходное строение внешнего энергетического уровня. Количество электронов на внешнем энергетическом уровне равно номеру группы и определяет валентность элемента в высшем оксиде.
Обратить внимание на электронную конфигурацию атомов в возбужденном состоянии.
Примеры заданий
1. Элемент, электронная конфигурация атома которого
образует водородное соединение:
Решение: сложим все верхние индексы (выделены красным) и получим общее количество электронов, а следовательно и порядковый номер элемента. 2+2+6+2+4=16. Это сера. Ответ 4)
Решение: сложим все верхние индексы (выделены красным) и получим общее количество электронов у частицы 2+2+6+2+6=18. Чтобы получить порядковый номер элемента надо:
в ответе 1) прибавить 4, получится 22. Это титан, а не сера.
в ответе 2) отнять 3, получится 15. Это фосфор. Ответ верный. Но все же проверим остальные:
в ответе 3) прибавить 3, получится 21. Это скандий, а не алюминий.
в ответе 4) отнять 2, получится 16. Это сера, а не кислород.
Ответ 2)
3. Атом химического элемента, высший оксид которого RO2, имеет конфигурацию внешнего уровня:
Решение: валентность кислорода равна двум, следовательно валентность элемента R равна четырем. Значит это элемент четвертой группы и количество электронов внешнего энергетического уровня равно четырем. Ответ: 2)
6. Неспаренные электроны содержит ион
1) Zn 2+ 2) Cu + 3) Mg 2+ 4) Cr 3+
Решение: атом цинка, потеряв два электрона с внешнего энергетического уровня, имеет завершенный третий энергетический уровень. Атом меди, потеряв один электрон с внешнего энергетического уровня, (помним про проскок электрона) также имеет завершенный третий энергетический уровень. Атом магния, отдав два электрона имеет завершенный второй энергетический уровень. И только атом хрома, имея один неспаренный 4s-электрон и 5 неспаренных электронов на 3d-подуровне, отдав три из них все равно будет иметь неспаренные электроны. Ответ 4)
7. Неспаренные электроны содержит ион
1) Ca 2+ 2) Cu 2+ 3) Ag + 4) Cr 6+
Решение: атом кальция, потеряв два электрона с внешнего энергетического уровня, имеет 2 s-электрона и 6 р-электронов на третьем энергетическом уровне. Атом меди, потеряв два электрона (один с внешнего энергетического уровня и один d-электрон с предвнешнего уровня, (помним про проскок электрона) имеет теперь девять d-электронов. Один из них и будет неспаренным. Атом серебра, отдав один электрон имеет полностью заполненный 4d-подуровень (помним про проскок электрона) . Атом хрома, имея один неспаренный 4s-электрон и 5 неспаренных электронов на 3d-подуровне, отдав шесть, т.е. их все, будет иметь два спаренных электрона на 4s-подуровне. Ответ 2)
Источник: school4eg.jimdofree.com