Формула изобретения
2. Способ по п.1, отличающийся тем, что используют раствор натрий-ацетатного буфера с ионной силой 0,025-0,05.
Описание изобретения к патенту
Изобретение относится к области получения бактерицидных препаратов, которые могут быть также использованы в качестве ингредиента косметических средств.
Известен способ получения раствора электролитического серебра (Ag+), предусматривающий электролиз электролита, содержащего раствор соли щелочного металла в дистиллированной воде, с помощью серебряных электродов (SU №1556679).
Технической задачей изобретения является создание эффективного способа, получения стабильных растворов электролитического серебра, а также расширение арсенала способов получения растворов электролитического серебра.
Технический результат, обеспечивающий решение поставленной задачи, состоит в увеличении количества свободных ионов серебра в растворе до уровня теоретически значимых величин, обеспечение значимой биологической активности и тем самым улучшение бактерицидных и регенеративных свойств, а также увеличения срока хранения полученных растворов.
ЗОЛОТО и СЕРЕБРО из ~ 800 ЧИПОВ СТАРЫХ ОЗУ!
Предпочтительно жидкая фаза натрий-ацетатного буфера имеет ионную силу 0,025-0,05.
Способ получения раствора электролитического серебра реализуется следующим образом.
Камера электролизера заполняется электролитом в виде жидкой фазы натрий-ацетатного буфера с рН=3,6-5,6 и с ионной силой 0,025-0,05.
От стабилизированного источника тока с помощью электродов через электролит пропускается постоянный ток с плотностью 0,15-5,0 мA/см 2 и напряжением 3-12 В. Причем каждые 15 минут автоматически меняются полюса на электродах, что позволяет равномерно проводить электролиз серебряных электродов.
Под действием тока с анода выделяются ионы серебра, насыщающие электролит. Выход свободных ионов серебра в раствор тестировали методом определения серебра с помощью Ag-ионоселективных электродов. Полученные данные сравнивали с теоретически возможным выходом ионов серебра при электролизе, рассчитанным по формуле Фарадея, по которой установлено, что электролиз в режиме 1А/ч растворяет 4,023 г Ag.
В последующих примерах убедительно показано, что использование натрий-ацетатного буфера рН 3,6-5,6, ионная сила 0,025-0,05 в качестве жидкой фазы при получении электролитического серебра приводит к получению высокоактивных растворов, содержащих Ag+. В системе натрий-ацетатного буфера не происходит комплексообразование с серебром, поэтому в растворе присутствуют практически в расчетных количествах и длительно сохраняются практически все выделенные ионы серебра.
В опытах 1-3 производились контрольные проверки, выполненные по методикам, отличным от заявляемого способа.
В опытах 4-6 производились контрольные проверки, выполненные по методикам, соответствующим заявляемому способу.
Исходный раствор — водопроводная вода.
Теоретическая концентрация серебра в растворе, рассчитанная по формуле Фарадея, должна быть 80 мг/л.
В электролизере наблюдается образование бело-серого осадка.
Концентрация иона серебра, определенная ионометрическим методом, менее 0,1 мг/л.
Исходный раствор — 2,5·10 -3 М раствор NaHCO 3 .
Теоретическая концентрация серебра в растворе — 120 мг/л.
В электролизере наблюдается незначительное образование серо-черного осадка.
Концентрация иона серебра в растворе составила 20±2 мг/л.
Исходный раствор — 1,25·10 -3 М раствор MgSO 4 .
Теоретическая концентрация серебра в растворе — 80 мг/л.
В электролизере наблюдается образование черного осадка.
Концентрация иона серебра в растворе 43±3 мг/л.
Исходный раствор — раствор натрий-ацетатного буфера ионной силой 0,035 М (рН=4,5).
Теоретическая концентрация серебра в растворе — 200 мг/л.
Электролит прозрачен, ощущается незначительный запах уксусной кислоты.
Концентрация ионов серебра в растворе 198 мг/л.
Исходный раствор — раствор натрий-ацетатного буфера ионной силой 0,025 М (рН=3,6).
Теоретическая концентрация серебра в растворе — 200 мг/л.
Электролит прозрачен, ощущается запах уксусной кислоты.
Концентрация иона серебра в растворе 199 мг/л.
Исходный раствор — раствор натрий-ацетатного буфера ионной силой 0,05 М (рН=5,6).
Теоретическая концентрация серебра в растворе — 200 мг/л.
Электролит прозрачен, ощущается запах уксусной кислоты.
Концентрация иона серебра в растворе 227±20 мг/л.
Результаты контроля изменения во времени концентрации ионов серебра, полученного в опытах, приведены в таблице.
| Таблица | ||||
| Опыт № | Количество серебра, растворившегося в электролите, рассчитанное по формуле Фарадея (мг/л) | Количество серебра, определенное ионометрическим методом с помощью Ag+-ионселективных электродов (мг/л) | ||
| В день электролиза | Через 6 месяцев | Через 12 месяцев | ||
| 1 | 80 | 0,1 | ||
| 2 | 120 | 20 | 8 | 2 |
| 3 | 80 | 43 | 15 | 6 |
| 4 | 200 | 198 | 196 | 192 |
| 5 | 200 | 199 | 196 | 190 |
Таким образом, опытным путем подтверждено, что при получении раствора электролитического серебра заявленным способом обеспечивается максимально возможная концентрация свободных ионов серебра в растворе, и, следовательно, максимальные биологическая активность и бактерицидные свойства этого раствора, увеличивающие, в частности, и срок хранения этого раствора.
В результате изобретения создан эффективный способ получения стабильных растворов электролитического серебра, а также расширен арсенал способов получения растворов электролитического серебра.
При этом увеличено количество свободных ионов серебра в растворе до уровня теоретически значимых величин, обеспечена значимая биологическая активность и тем самым улучшены бактерицидные и регенеративные свойства, а также увеличен срок хранения полученных растворов.
Источник: www.freepatent.ru
Расчет концентрации ионов металла в насыщенном растворе
Задача 571.
Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе AgCl, если прибавить к нему столько соляной кислоты, чтобы концентрация ионов Cl — в растворе стала равной 0,03 моль/л?
Решение:
Уравнение диссоциации AgCl имеет вид:
AgCl ⇔ Ag+ + Cl — ;
ПР(AgCl) = [Ag + ] + [Cl — ] = 1,8 . 10 -10 .
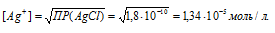
Поскольку [Ag +] = [Cl — ], то после прибавления соляной кислоты концентрация ионов Ag + и ионов Cl — стала равной 0,03 моль/л, т.е. [Ag + ] = [Cl — ] = 0,03 моль/л.
Рассчитаем уменьшение концентрации ионов Ag + :
0,03/(1,34 . 10-5) = 2239.
Ответ: в 2239 раз.
Задача 572.
Вычислить растворимость (в моль/л) CaF2 в воде и в 0,05 М растворе CaCl2. Во сколько раз растворимость во втором случае меньше, чем в первом?
Решение:
а) Вычисление растворимости соли CaF2 в воде
Обозначим искомую растворимость соли CaF2 через S (моль/л). Тогда в насыщенном растворе CaF2 содержится S моль/л) ионов Ca 2+ и 2S (моль/л) ионов Cl — .
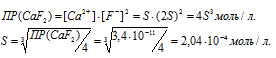
б) Вычисление растворимости соли CaF2 в 0,05 М растворе CaCl2
Находим растворимость соли CaF2 в 0,05М раствора CaCl2, обозначив её через S’. Концентрация ионов F- в насыщенном растворе будет равна 2S’, а концентрация ионов Ca 2+ составит (S’ + 0,05) Поскольку S’
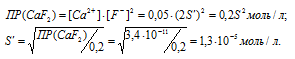
Находим, во сколько раз растворимость соли CaF2 уменьшилась в присутствии 0,05М раствора CaCl2:
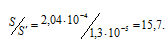
Ответ: а) 2,04 . 10 -4 моль/л; б) 1,3 . 10 -5 моль/л; в) в 15,7 раза.
Задача 573.
Во сколько раз растворимость AgCl в 0,001 н. растворе NaCl меньше, чем в воде? Расчет произвести с учетом коэффициентов активности, пользуясь табличными данными.
Решение:
Обозначим искомую растворимость соли через S(моль/л). Тогда в насыщенном растворе AgCl содержится S (моль/л) ионов Ag + и S(моль/л) ионов Cl — .
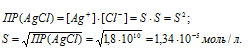
Выразим произведение растворимости соли AgCl через активности ионов:
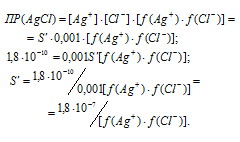
Для нахождения значений коэффициентов активностей ионов нужно вычислить значение ионной силы раствора сильного электролита NaCl:
I(NaCl) = 1/2[CM(Na + ) . Z 2 (Na + ) + CM(Cl — ) . Z 2 (Cl — )] =
= 1/2[(0,001 . 12) + (0,001 . 12)] = 0,001 моль/л.
Согласно табличным данным при ионной силе раствора равной 0,001 коэффициенты активностей однозарядных ионов равны 0,98.
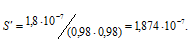
Рассчитаем, во сколько раз S’ меньше, чем S:
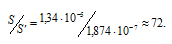
Ответ: в 72 раза.
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Произведение растворимости | Задачи 559 — 562
Источник: buzani.ru
Индикатор серебра в растворе
Не все скупочные организации, ломбардные магазины и ювелирные мастерские, могут позволить себе иметь на своих рабочих местах пробирные камни и эталонные иглы, для определения пробы серебра , золота и платины. Поэтому часто определение пробы испытуемых металлов, осуществляют — простым капельным способом.
Надфилем на поверхности ювелирного изделия, в неприглядном месте, осторожно наносят потертость. Затем на потертую часть испытуемого драгоценного металла, наносят каплю химического реактива. Через 15 – 20 секунд, салфеткой убирают с поверхности металла — каплю химического реактива и определяют пробы драгоценных металлов по реакции реагента.
Капельный способ определения пробы серебра, в сравнении с анализом проб на пробирном камне , является менее точным. Но капельный способ имеет одно очень важное преимущество, это доступность и скорость. Однако для определения пробы серебра капельным способом, нужно полагаться на собственные ощущения. Для этого необходимо иметь хорошую цветовую память, на реакции реактива с драгоценными металлами.
Капельным способом очень тяжело определяются пробы платины. Однако капельный способ при большом опыте и квалификации приемщиков, позволяет с достаточно большой точностью определить, как пробу серебра и золота, так и платины.
Серебро , золото и платина , это по своей природе инертные металлы, которые очень устойчивы к действию различных кислот, щелочей и солей. Некоторые кислоты, щелочи и соли, могут использоваться для анализа пробы драгоценных металлов.
При нанесении химических реактивов, на чистые драгоценные металлы или на их высокопробные сплавы, наблюдается слабая химическая реакция и незначительные изменения цветового оттенка испытуемых металлов. А вот сплавы с более низкими пробами драгоценных металлов, лучше реагируют на химические реактивы, с интенсивным изменением цветового оттенка реагентов.
Очень часто для определения пробы серебра пользуются — хромпиком. На предварительно зачищенную и потертую часть сплава серебра, наносят — хромпик. Если сплав драгоценного металла, состоит из серебра и меди, то на его поверхности будут образовываться соответствующие сульфаты этих металлов.
Собственный цвет хромпика, ярко – оранжевый. Хромпик или двухромовокислый калий, будет оставлять на поверхности испытуемых сплавов — красные пятна различной степени интенсивности. На сплавах серебра ниже 600 пробы, хромпик будет оставлять, темно — красные пятна. При повышении пробы, интенсивность красного цвета — будет меняться. Пятна, оставленные реактивом, будут светлеть и становится ярче.
Вторичное серебро Ag
Шукшенцева Валентина Александровна
Производственное издание
Для технологов, фотографов и фотолаборантов, а также заведующих лабораториями и цехами регенерации серебра, фотографиями и фотокинолабораториями.
IV. МЕТОДЫ АНАЛИЗА НА СОДЕРЖАНИЕ СЕРЕБРА В ОТХОДАХ И ШЛАМЕ
IV.1. ЖИДКИЕ ОТХОДЫ
Первый химический метод.
Приборы, оборудование и посуда. Весы лабораторные технические; ручная центрифуга; мерные стаканы, колбы на 100 мл; центрифужные пробирки с ценой деления не более 0,02 мл; пипетки на 5 мл.
Реактивы. Сульфид натрия (сернистый натрий); гидроксид натрия (едкий натр).
Второй химический метод.
Приборы, оборудование и посуда те же, что и для первого метода.
Реактивы . 40%-й раствор формалина; азотная кислота (уд.в. 1,18-1,2).
В центрифужную 10-мл пробирку наливают 5 мл отработанного фиксажного раствора, добавляют 1-1,5 мл 40%-го раствора формалина и взбалтывают, затем добавляют 3 мл азотной кислоты и снова центрифугируют, после чего дают раствору отстояться и через 10-20 мин измеряют объем выпавшего осадка. Объем осадка 0,12 мл в пробирке соответствует 1 г серебра в 1 л отработанного фиксажного раствора. С увеличением содержания серебра в растворе увеличивается и объем осадка.
Третий химический метод.
Приборы, оборудование и посуда . Весы технические лабораторные; нагревательный прибор, химическая посуда.
Реактивы и растворы . Сульфид натрия; нитрат серебра; концентрированная азотная кислота; роданид аммония или калия; железоаммонийные квасцы; 10%-й раствор сульфида натрия; 10%-й раствор нитрата серебра; 0,1%-й раствор роданида аммония или калия; насыщенный раствор железоаммонийных квасцов.
К 50 мл исследуемого фиксажа доливают 10 мл 10%-го раствора сульфида натрия и кипятят 10-15 мин. Просветленный раствор проверяют на полноту осаждения и еще горячим пропускают через фильтровальную бумагу, осадок на фильтре промывают горячей водой до тех пор, пока пробы промывной воды с каплей 10%-го раствора нитрата серебра не перестанут давать коричневую окраску.
Фильтр с промытым осадком переносят в стакан, где проводилось осаждение сульфида серебра, доливают туда 15 мл воды и при нагревании до кипения растворяют в 20 мл концентрированной азотной кислоты. После удаления оксидов азота в раствор по стенкам колбы добавляют 10-15 мл воды и снова доводят его до кипения. Затем раствор охлаждают, переносят вместе с белой массой фильтровальной бумаги в мерную колбу и после охлаждения доливают дистиллированную воду до метки 200 мл.
50 мл полученного раствора переносят с помощью пипетки в коническую колбу и титруют 0,1%-м раствором роданида аммония или калия, добавляют в качестве индикатора 1-2 мл насыщенного раствора железоаммонийных квасцов. Под конец титрование ведут при энергичном взбалтывании раствора.
1 мл 0,1%-го раствора роданида аммония или калия соответствует 0,010788 г серебра.
Метод потенциометрического титрования.
Сущность метода состоит в потенциометрическом титровании серебросодержащего раствора тиоацетамидом в щелочной среде. Мешающие определению тяжелые металлы (Сu, Fe и т.п.) связываются в комплексы соответственно трилоном Б и оксиэтилидендифосфоновой кислотой (ОЭДФ). Погрешность метода 1-2%.
Посуда, приборы . Бюретка с автоматическим нулем и склянкой (ГОСТ 20292-74) вместимостью 10 мл; пипетки (ГОСТ 20292-74) вместимостью 2, 5,10, 25, 50 и 100 мл; стакан (ГОСТ 10394-72) вместимостью 150 мл; цилиндр (ГОСТ 1770-74) вместимостью 25 мл; мешалка магнитная любого типа; рН-метр (милливольтметр) или иономер (марки И-102, И-115) с индикаторным серебряным электродом (покрытым сульфидом серебра) или сульфидсеребряным электродом (марки ЭСС-01) и хлоросереб-ряным (типа ЭВЛ-1М) электродом сравнения с погрешностью не более ±0,05.
Реактивы и растворы . 0,4%-й раствор желатины; 0,2%-й раствор оксиэтилидендифосфоновой кислоты (ОЭДФ) (ТУ 6-02-1215-81); 0,01 н. раствор нитрата серебра (азотнокислого серебра); смесь гидроксида натрия и трилона Б; 0,01 н. раствор тиоацетамида.
Подготовка к анализу .
Приготовляют 0,01 н. раствор нитрата серебра, 0,01 н. раствор тиоацетамида, смесь гидроксида натрия и трилона Б, 0,4%-й раствор желатины и 0,2%-й водный раствор ОЭДФ. Подготавливают серебряный или сульфидсеребряный электрод согласно паспорту, прилагаемому к электроду.
Проведение анализа содержания серебра в фиксирующих растворах концентрацией 0,1-5 г/л .
Пипеткой отмеряют 2-5 мл пробы фиксирующего раствора и переносят их в стакан для потенциометрического титрования вместимостью 150 мл. В этот же стакан добавляют отмеренные цилиндром 25 мл воды, 10 мл 0,4%-го раствора желатины и 20 мл смеси гидроксида натрия и трилона Б. Перемешивая полученный раствор с помощью магнитной мешалки, титруют его 0,01 н. раствором тиоацетамида на установке по ОСТ 19-1-83. Вблизи точки эквивалентности, когда скорость приращения потенциала увеличивается, раствор тиоацетамида добавляют порциями по 0,1 мл, ожидая после добавления каждой порции полной остановки стрелки прибора. Конечную точку титрования определяют по наибольшему приросту потенциала.
Проведение анализа содержания серебра в промывной воде концентрацией 0,005-0,2 г/л .
Пипеткой отмеряют пробу промывной воды в стакан для потенциометрического титрования. При содержании серебра 0,05-0,2 г/л объем пробы составляет 25 мл, при содержании серебра менее 0,05 г/л — 50 или 100 мл. В этот же стакан добавляют отмеренные цилиндром 10 мл 0,4%-го раствора желатины и 20 мл смеси гидроксида натрия и трилона Б. Перемешивая полученный раствор с помощью магнитной мешалки, титруют его 0,01 н. раствором тиоацетамида так же, как и в предыдущем случае.
Примечание. При наличии железа в пробы фиксирующего раствора и промывной воды перед титрованием добавляют дополнительно 5 мл 0,5%-го раствора комплексона ОЭДФ.
Обработка результатов.
Содержание серебра (А) г/л, вычисляют по формуле А = 0,001079 V1 К × 1000 / V,
где 0,001079 — количество серебра, эквивалентное 1 мл 0,01 н. раствора тиоацетамида, г; V1 — объем 0,01 н. раствора тиоацетамида, пошедший на титрование, мл; К — коэффициент поправки 0,01 н. раствора тиоацетамида; V — объем анализируемой пробы, мл.
Колориметрический метод.
Сущность метода состоит в измерении оптической плотности окраски коллоидного раствора сульфида серебра, образующейся при взаимодействии ионов серебра и сульфида натрия. Погрешность метода для растворов с концентрацией серебра 0,1 г/л и выше ±2%, менее 0,1 г/л ±5%.
Посуда, приборы . Бюретка (ГОСТ 20292-74) вместимостью 100 мл; колбы мерные (ГОСТ 1770-74) вместимостью 100, 500 и 1000 мл; пипетки (ГОСТ 20292-74) вместимостью 2, 5, 10 мл; колориметр фотоэлектрический или спектрофотометр с погрешностью не более ± 1%.
Реактивы и растворы . Буферный, цитратный (рН 5,5-5,6) или ацетатный (ГОСТ 4919.1-77) растворы; 10%-й раствор 9-водного сульфида натрия; 0,4%-й раствор желатины фотографической.
Подготовка к анализу .
Приготовляют буферный раствор, цитратный (раствор А) рН 5,5-5,6, 0,4%-й раствор желатины (раствор В) и 10%-й раствор сульфида натрия (раствор С).
Проведение анализа .
Отбирают пробу фиксирующего раствора или серебросодержащей воды. Объем пробы выбирается по таблице 8. В мерную колбу вместимостью 100 мл пипеткой вносят пробу испытуемого раствора. При малом объеме пробы добавляют воду примерно до половины объема колбы.
Затем в колбу последовательно вводят по 5 мл растворов А и В, содержимое колбы взбалтывают и добавляют 2 мл раствора С. Смесь тщательно перемешивают, доводят до метки водой и снова перемешивают раствор. В качестве раствора сравнения используют «холостую» пробу, приготовленную так же, как испытуемая, но без сульфида натрия. Измерение оптической плотности окраски испытуемого раствора проводят на фотоэлектрическом колориметре с ртутно-кварцевой лампой за светофильтром № 2, пользуясь 10-мл кюветой, или на спектрофотометре при λ = 320 нм. По полученному значению оптической плотности окраски с помощью градуировочной кривой (см. приложение 2) определяют количество серебра в испытуемой пробе фиксирующего раствора или серебросодержащей промывной воды.
Обработка результатов .
Содержание серебра в растворе вычисляют следующим образом. В 1-й группе растворов концентрация серебра равна величине, полученной по градуировочной кривой; во 2-й группе — той же величине, но уменьшенной в 5 раз; в 3-й — в 20 раз; в 4-й -в 40 раз.
Примечания:
1. Допускается использовать аргентометр типа КВУ-19 с погрешностью ±5%. При этом измерение проводится в соответствии с прилагаемой к прибору инструкцией.
2. Допускается применять индикаторную бумагу ИС-1 для грубого предварительного определения серебра.
Контроль на полноту осаждения серебра из растворов.
В сосуд из прозрачного стекла наливают небольшое количество осветленного раствора, в который добавляют 1-2 мл 5%-го раствора сульфида натрия. При полном осаждении серебра раствор остается прозрачным, при неполном появляется бурый или черный осадок. При появлении в контрольной пробе осадка или мути весь раствор подвергают повторной обработке, после чего снова проверяют на полноту осаждения.
- Свежие записи
- Где находится датчик температуры охлаждающей жидкости на ЯМЗ 534?
- Эффект Холла и измерение величин датчиками Холла
- Датчик холла на ВАЗ 2109 инжектор: устройство и функции
- Датчик глубины в телефонах Samsung: что это такое и для чего нужен?
- Последствия неисправности датчика распредвала и как ее обнаружить
Источник: ollimpia.ru