Полный курс химии вы можете найти на моем сайте CHEMEGE.RU . Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу в ВКонтакте или на Facebook . Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс » 40 шагов к 100 баллам на ЕГЭ по химии «.
При электролизе расплавов или водных растворов солей протекают окислительно-восстановительные реакции на электродах (аноде и катоде). В статье рассмотрены расчетные задачи, в которых основной химической реакцией является электролиз — основные приемы и типы решения таких задач.
Какие именно процессы протекают при электролизе и как составлять уравнения химических реакций, протекающих при электролизе, вы можете узнать из статьи .
При решении задач на электролиз необходимо учитывать , что растворенное вещество может подвергнуться электролизу не полностью . Если вещество полностью разложилось под действием тока, далее может протекать электролиз воды по уравнению:
ШОК!!! 3.5 кг серебра в советском ионаторе.
2H ₂ O → O ₂ + 2H ₂
При действии тока на растворы некоторых веществ (например, соли активных металлов и кислородсодержащих кислот, щелочи, кислородсодержащие кислоты) количество этих веществ фактически не меняется, т.к. протекающие на катоде и аноде процессы приводят к электролизу воды.
Электролиза с растворимыми электродами или электролиза растворов, в которых содержится несколько растворенных веществ, в ЕГЭ по химии пока нет.
Давайте рассмотрим несколько простых задач на электролиз, а затем перейдем к более сложным.
1 . Провели электролиз водного раствора нитрата серебра с инертным анодом. Масса восстановленного на катоде серебра оказалась равной 2,16 г. Какой объём газа (н.у.) выделился на аноде? Вычислите массовую долю кислоты в полученном растворе, если масса раствора 250 г.
Решение и ответ:
Запишем уравнение электролиза раствора нитрата серебра:
4AgNO ₃ + 2H ₂ O → 4Ag + 4HNO ₃ + O ₂
Количество вещества серебра, образовавшегося на катоде:
n(Ag) = m/M = 2,16 г/107 г/моль = 0,02 моль
На аноде выделился кислород. Количество кислорода можем определить из количества серебра по уравнению реакции:
n(O₂) = 1/4·n(Ag) = 1/4 · 0,02 = 0,005 моль
V(O₂) = n·Vm = 0,005·22,4 = 0,112 л
Количество вещества азотной кислоты:
n(HNO₃) = n(Ag) = 0,02 моль
m(HNO₃) = n·M = 0,02 моль·63 г/моль = 1,26 г
Массовая доля азотной кислоты в полученном растворе:
ω(HNO₃) = m(HNO₃)/*mр-ра = 1,26/250 = 0,005 = 0,5%
Ответ: V(O₂) = 0,112 л, ω(HNO₃) = 0,5%
2. Провели полный электролиз 200 г раствора хлорида калия с ω(KCl) = 7,45%. К полученному раствору добавили 50 г раствора фосфорной кислоты с ω(H ₃ PO ₄ ) = 19,6%. Определите формулу образовавшейся при этом соли.
Решение и ответ:
Запишем уравнение электролиза раствора хлорида калия:
2KCl + 2H ₂ O → 2KOH + Cl ₂ + H ₂
При полном электролизе вступит в реакцию весь хлорид калия. Определим массу и количество вещества хлорида калия:
а вы знали сколько серебра в автоматических выключателях РФ.
m(KCl) = mр-ра(KCl) ·ω(KCl) = 200 г · 0,075 = 14,9 г
n(KCl) = m/M =14,9 г / 74,5 г/моль = 0,2 моль
Определим количество образовавшейся щелочи:
n(KOH) = n(KCl) = 0,2 моль
Определим количество фосфорной кислоты:
m(H₃PO₄) = mр-ра(H₃PO₄) ·ω(H₃PO₄) = 50 г · 0,196 = 9,8 г
n(H₃PO₄) = m/M =9,8 г / 98 г/моль = 0,1 моль
При взаимодействии фосфорной кислоты с щелочью возможно образование трех типов солей:
H ₃ PO ₄ + KOH → KH ₂ PO ₄ + H ₂ O
H ₃ PO ₄ + 2KOH → K ₂ HPO ₄ + 2H ₂ O
H ₃ PO ₄ + 3KOH → K ₃ PO ₄ + 3H ₂ O
При соотношении кислоты и щелочи n(H₃PO₄):n(KOH) = 0,1:0,2 или 1:2 протекает вторая реакция и образуется гидрофосфат калия. Количество вещества гидрофосфата калия равно:
n(K ₂ HPO ₄) = n(H₃PO₄) = 0,1 моль
Ответ : K ₂ HPO ₄
3. В процессе электролиза 500 мл раствора гидроксида натрия с ω(NaОН) = 4,6% (ρ = 1,05 г/мл) массовая доля NaОН в растворе увеличилась до 10%. Вычислите объёмы газов (н.у.), выделившихся на электродах.
Решение и ответ:
Уравнение реакции, которая протекает при электролизе раствора гидроксида натрия:
2H ₂ O → O ₂ + 2H ₂
Фактически, на катоде восстанавливается водород, на аноде окисляется кислород. Количество щелочи в растворе при этом не изменяется. Определим количество щелочи:
mр-ра(NaOH) = Vр-ра(NaOH) ·ρ(NaOH) = 500 мл · 1,05 г/мл = 525 г
m(NaOH) = mр-ра(NaOH) ·ω(NaOH) = 525 г · 0,046 = 24,15 г
n(NaOH) = m/M =24,15 г / 40 г/моль = 0,604 моль
За счет чего же меняется массовая доля? Все очень просто — за счет электролиза воды . Зная, что масса гидроксида натрия не изменилась, найдем массу конечного раствора:
mр-ра,₂(NaOH) = m(NaOH) / ω(NaOH) = 24,15 г / 0,1 = 241,5 г
Количество воды, которая подверглась электролизу:
m(H ₂ O ) = mр-ра,1(NaOH) – mр-ра ,₂ (NaOH) = 525 – 241,5 = 283,5 г
n(H₂O) = m/M =283,15 г / 18 г/моль = 15,75 моль
Из уравнения электролиза определим количество вещества водорода и кислорода и их массу:
n(H₂) = n(H2O) = 15,75 моль
V(H₂) = n·Vm =15,75 моль · 22,4 л/моль = 352,8 л
n(О₂) = 1/2·n(H2O) = 7,875 моль
V(O₂) = n·Vm = 7,875 моль · 22,4 л/моль = 176,4 л
Ответ : V(H₂) = 352,8 л, V(O₂) = 176,4 л
Задачи на электролиз встретились в ЕГЭ по химии в 2018 году. Вот одна из задач реального экзамена по химии:
4. При проведении электролиза 500 г 16% раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Во-первых, составляем уравнение реакции электролиза раствора сульфата меди. Как это делать, подробно описано в статье Электролиз .
2CuSO ₄ + 2H ₂ O → 2Cu + 2H ₂ SO ₄ + O ₂
Находим массу чистого сульфата меди:
m(CuSO₄) = mраствора*ω( CuSO ₄) = 500*0,16 = 80 г
Количество вещества сульфата меди:
n(CuSO₄) = m/M = 80/160 = 0,5 моль
Видно, что на аноде должно выделиться 0,25 моль газа, или 5,6 л.
Однако, в условии сказано, что выделилось только 1,12 л газа. Следовательно, сульфат меди прореагировал не полностью, а только частично.
Находим количество и массу кислорода, который выделился на аноде:
n(O₂) = V/Vm = 1,12/22,4 = 0,05 моль,
m(O₂) = n*M = 0,05*32 = 1,6 г.
Следовательно, в электролиз вступило 0,1 моль сульфата меди.
В растворе осталось 0,4 моль сульфата меди . При этом образовалось 0,1 моль серной кислоты массой 9,8 г и 0,1 моль меди выпало в осадок (масса меди 6,4 г) .
При этом масса полученного раствора после электролиза mр-ра₂ равна:
mр-ра₂ = 500 – 1,6 – 6,4 = 492 г
Из полученного раствора отобрали порцию массой 98,4 г. При этом количество растворенных веществ поменялось. Зато не поменялась их массовая доля.
Найдем массовую долю сульфата меди ω( CuSO ₄)₂ и серной кислоты ω(H₂SO₄) в растворе, который остался после электролиза:
m(CuSO₄)ост = n*M = 0,4*160 = 64 г
ω(CuSO₄)₂ = m(CuSO₄)₂/*mр-ра₂ = 64/492 = 0,13 = 13%
ω(H₂SO₄) = m(H₂SO₄)/*mр-ра₂ = 9,8/492 = 0,02 = 2%
Найдем массу и количество серной кислоты и массу сульфата меди в порции массой mр-ра3 = 98,4 г, которую мы отобрали:
m(CuSO₄)3 = ω( CuSO ₄)₂ *mр-ра3 = 0,13*98,4 = 12,79 г
m(H₂SO ₄ )₂ = ω(H₂SO₄)*mр-ра3 = 0,02*98,4 = 1,97 г
n(CuSO₄) = m/M = 12,79/160 = 0,08 моль
n(H₂SO₄) = m/M = 1,97/98 = 0,02 моль
Чтобы осадить ионы меди, гидроксид натрия должен прореагировать и с серной кислотой в растворе, и с сульфатом меди:
H₂SO₄ + 2NaOH = Na ₂ SO₄ + 2H ₂ O
CuSO ₄ + 2NaOH = Cu(OH) ₂ + 2H ₂ O
В первой реакции израсходуется 0,04 моль гидроксида натрия, во второй реакции 0,16 моль гидроксида натрия. Всего потребуется 0,2 моль гидроксида натрия. Или 8 г чистого NaOH, что соответствует 40 г 20%-ного раствора.
Ответ: mр-ра = 40 г.
Задача из досрочного ЕГЭ по химии-2020 на электролиз:
5. Через 640 г 15%-ного раствора сульфата меди(II) пропускали электрический ток до тех пор, пока на аноде не выделилось 11,2 л (н.у.) газа. К образовавшемуся раствору добавили 665,6 г 25%-ного раствора хлорида бария. Определите массовую долю хлорида бария в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение и ответ:
2CuSO ₄ + 2H2O = 2Cu↓ + 2H2SO ₄ + O2↑ (электролиз)
BaCl ₂ + H ₂ SO ₄ = BaSO ₄ ↓ + 2HCl
Количество вещества реагентов и масса продуктов реакций:
m(CuSO₄) = 640 · 0,15 = 96 г
n(CuSO₄) = 96 / 160 = 0,6 моль
n(O₂) = 11,2 / 22,4 = 0,5 моль
n(Cu) = n(CuSO₄) = 0,6 моль
m(Cu) = 0,6 · 64 = 38,4 г
n(H₂SO₄) = n(CuSO₄) = 0,6 моль
При электролизе сульфата меди может выделится максимальное количество кислорода:
n(O₂ [1]) = 0,5n(CuSO₄) = 0,3 моль
Однако, по условию, на аноде всего выделилось 0,5 моль газа. Следовательно, дальше протекает электролиз воды:
2H ₂ O → O ₂ + 2H ₂ (электролиз)
Количество кислорода ,который выделится при электролизе воды:
n(O₂ [2]) = 0,5 – 0,3 = 0,2 моль
Отсюда можно найти массу воды, которая разложилась под действием тока:
n(H₂O прореаг.) = 2n(O₂ [2]) = 0,4 моль
m(H₂O прореаг.) = 0,4 · 18 = 7,2 г
m(O₂ [1]) = 32 · 0,3 = 9,6 г
m(BaCl₂) = 665,6 · 0,25 = 166,4 г
n(BaCl₂) = 166,4 / 208 = 0,8 моль
n(BaCl₂ прореаг.) = n(H₂SO₄) = 0,6 моль
n(BaCl₂ осталось) = 0,8 – 0,6 = 0,2 моль
m(BaCl₂ осталось) = 0,2 · 208 = 41,6 г
n(BaSO₄) = n(BaCl₂ прореаг.) = 0,6 моль
m(BaSO₄) = 0,6 · 233 = 139,8 г
Массовая доля хлорида бария в растворе:
m(р-ра) = 640 + 665,6 – 38,4 – 7,2 – 139,8 – 9,6 = 1110,6 г
ω(BaCl₂) = 41,6 / 1110,6 = 0,037, или 3,7 %
Ответ : ω(BaCl₂) = 3,7 %
Еще больше задач на электролиз вы можете найти в моей статье .
Источник: dzen.ru
Сколько серебра
Найдите правильный ответ на вопрос ✅ «Сколько серебра выделится на катоде, если через раствор азотно-серебряной пропустить заряд 100 соли Кл? . » по предмету Физика, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Новые вопросы по физике
Проводники сообщили заряд 1*10’9 кл, его зарядили до потенциала 100 в. Определить электроемкость проводника?
Две стальные проволоки, имеющие одинаковые длины, но разные сечения, включены параллельно в цепь. В какой из них будет выделяться большее количество теплоты за одно и то же время?
Что определяется выражением Q/m
Скорость автобуса равна20 м/с а скорость гоночного автомобиля 360 км/ч. Во сколька раз скорость гоночного автомобиля больше скорости автобуса
Кубик со стороной 2 см имеет массу 16 грамм. Найти плотность. Ответ дать в системе СИ
Главная » Физика » Сколько серебра выделится на катоде, если через раствор азотно-серебряной пропустить заряд 100 соли Кл?
Источник: iotvet.com
Электролиз
Пример 1. Сколько граммов меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А?
Решение. Согласно законам Фарадея

где m — мaсса вещества, окисленного или восстановленного тока на электроде; Э — грамм-эквивалент вещества; i – сила тока, А; t — продолжительность электролиза, с.
Грамм-эквивалент меди в CuSO4 63,54: 2 = 31,77 г
Подставив в формулу (1) значение Э = 31,77, i = 4, t = 6060=3600, получим

г.
Пример 2. Сколько времени надо проводить электролиз при силе тока 8А, чтобы из раствора AgNO3 выделить 5,3935 г серебра?
Решение. Из формулы (1)

мин 3 с,
где т = 5,3935 г; ЭAg = 107,87; i = 8.
Пример 3. Вычислить эквивалент металла, зная, что при электролизе раствора хлорида этого металла затрачена 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Из формулы (1)

где m=11,742 г; it = Q 3880 Кл.
Пример 4. На сколько граммов уменьшится масса серебряного анода, если электролиз раствора AgNO3 проводить при силе тока 2 А в течение 33 мин 20 с?
Решение. Из формулы (1)

г,
где ЭАg = 107,87; i = 2; t = 3360 + 20 = 2000.
Пример 5. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях?
Решение. Из формулы (1)
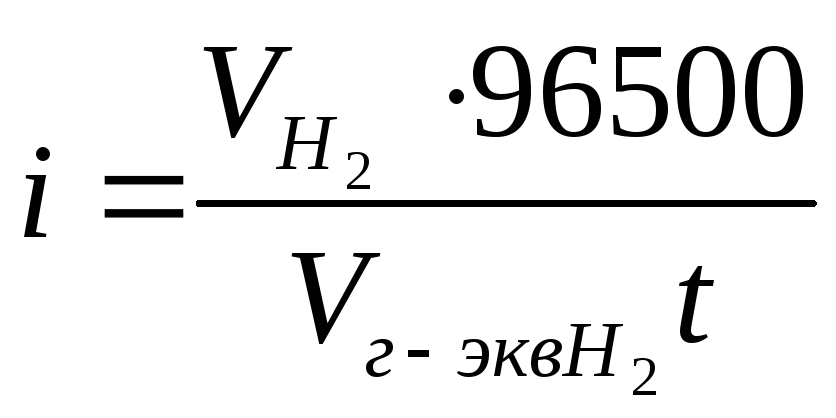
Так как количество водорода дано в объемных единицах, то отношение т/Э заменяем отношением,  где
где  – объем водорода в литрах;
– объем водорода в литрах;  – объем грамм-эквивалента водорода в литрах.
– объем грамм-эквивалента водорода в литрах.

Объем грамм-эквивалента водорода при н.у. равен половине грамм-молекулярного объема 22,4/2=11,2 л. Подставим в приведенную формулу значения  =1,4,
=1,4, =11,2,t=6025 (1 ч 40 мин 25 с=6025 с), находим
=11,2,t=6025 (1 ч 40 мин 25 с=6025 с), находим

Пример 6. Сколько граммов едкого кали образовалось у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода, измеренного при нормальных условиях?
Решение. Объем грамм-эквивалента кислорода (н.у.) 22,4/4 = 5,6 л. Следовательно, 11,2 л составляют 2 г-экв кислорода. Столько же, т. е. 2 г-экв, КОН образовалось у катода или 56,11-2 = 112,22 г (56,11 г – г-экв КОН).
261. Электролиз раствора К2SО4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах, вычислите объем выделяющихся на электродах веществ.
262. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов А1С13, NiSO4. В обоих случаях анод угольный.
263. При электролизе раствора CuSO4 на аноде выделилось 168 см 3 кислорода, измеренного при н.у. Сколько граммов меди выделилось на катоде?
264. Сколько граммов воды разложилось при электролизе раствора Na2SO4 при силе тока 7 А в течение 5 ч?
265. Электролиз раствора нитрата серебра проводили при силе тока 2А в течение 4 ч. Сколько граммов серебра выделилось на катоде?
266. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалент металла.
267. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН, расплава КОН.
268. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода, измеренного при н.у. Вычислите силу тока.
269. Составьте электронные уравнения процессов, проводящих на электродах при электролизе раствора A12(SO4)3 в случае угольного анода; в случае алюминиевого анода.
270. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора NaI в течение 2,5 ч, если сила тока равна 6 А?
271. При электролизе раствора AgNO3 масса серебряного анода уменьшилась на 5,4 г. Сколько кулонов электричества израсходовано на этот процесс?
272. Какие вещества и в каком количестве выделяются на угольных электродах при электролизе раствора КВr в течение 1 ч 35 мин при силе тока 15 А?
273. Составьте электронные уравнения процессов, происходящих при электролизе СuС12, если анод медный; если анод угольный?
274. На электролиз раствора СаС12 израсходовано 10722,2 Кл электричества. Вычислите массу выделяющихся на угольных электродах и образующегося возле катода веществ.
275. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КСl ,расплава КСl.
276. Сколько времени проводят электролиз раствора электролита при силе тока 5 А, если на катоде выделяется 0,1 г-экв вещества? Сколько выделится вещества на аноде?
277. При электролизе растворов MgSO4 и ZnCl2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Сколько граммов вещества выделится на другом катоде; на анодах?
278. Чему равна сила тока, если при электролизе раствора MgCl2 в течение 30 мин на катоде выделилось 8,4 л водорода, измеренного при н.у. Вычислите массу вещества выделяющегося на аноде.
279. Сколько граммов H2SO4 образуется возле анода при электролизе раствора Na2SO4, если на аноде выделяется 1,12 л кислорода, измеренного при н.у.? Вычислите массу вещества, выделяющегося на катоде.
280. Вычислите силу тока, зная, что при электролизе раствора КОН в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г кислорода. Какое вещество и в каком количестве выделяется на катоде?
Источник: studfile.net