Для решения этой задачи, нужно использовать формулу для расчета количества осадка на катоде в процессе электролиза:
Количество осадка = (сила тока * время) / (электрохимический эквивалент)
Тема 4. Электролиз. Инверсионная вольтамперометрия
Пример 1. Сколько граммов меди выделится на катоде при пропускании через раствор сульфата меди (II) СuSO4 тока силой 5 ампер в течение 10 минут?
Решение. Определим количество протекшего через раствор электричества:
где I – сила тока в амперах; t – время в секундах.
Молярная масса эквивалента меди (молярная масса 64) равняется 64:2 = 32 г/моль. Следовательно, 96500 кулон выделяют 32 г меди. Искомое количество меди вычисляют исходя из закона Фарадея:
Э – эквивалентный вес вещества г/моль; I – сила тока, А; t – время электролиза, сек; F – число Фарадея, 96500 Кл.
Пример 2. При пропускании тока через раствор нитрата серебра на катоде выделилось за 10 мин. 1 г серебра. Определите силу тока.
Решение. Масса 1 моль эквивалентов серебра равна 108 г. Для выделения 1 г серебра через раствор должно пройти 96500: 108» 894 кулона. Отсюда сила тока:
Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | Умскул
Пример 3. Для анализа взяли 0,5 г почвы провели мокрое озоление с 50%-ным раствором HNO3. Золу растворили в 10 мл бидистиллированной воды, после чего отобрали 0,2 мл вытяжки для анализа. Определить массу цинка и свинца по вольтамперограммам.
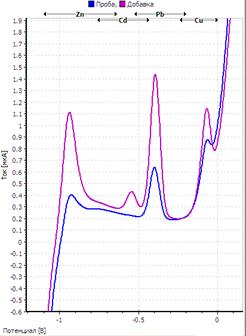
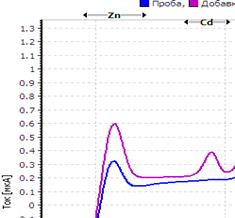
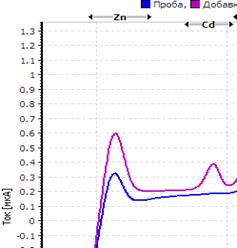
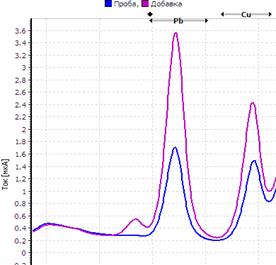
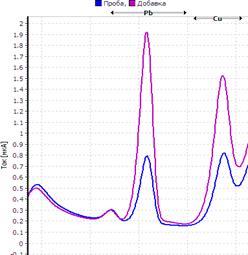
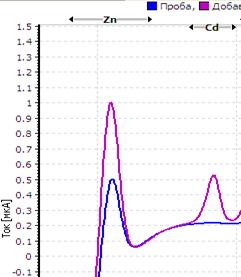
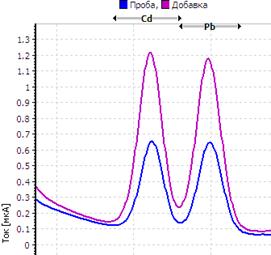
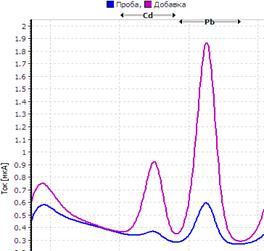
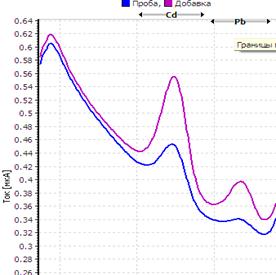
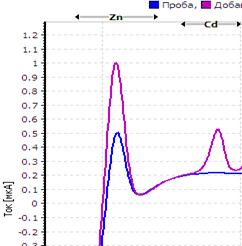
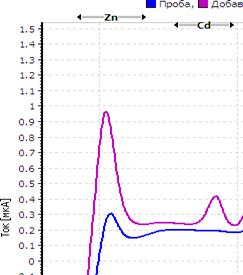
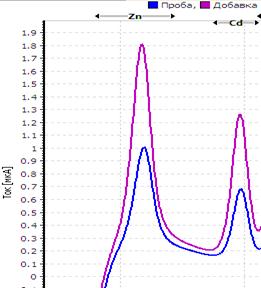
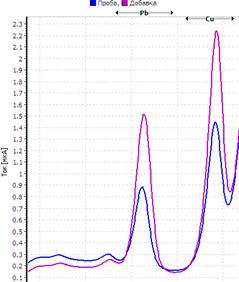
Рис. Вольтамперограмма анализируемой пробы
Решение. Находим величину пика (мкА) цинка и свинца в анализируемой пробе. Для цинка – 0,4 мкА, для свинца 0,64 мкА (рис.). Величина пика добавки, цинка – 1,05 мкА (концентрация добавки 1,0 мг/л, объем – 0,04 мл), свинца – 1,44 мкА (концентрация добавки 1,0 мг/л, объем – 0,06 мл).
Содержание тяжелых металлов методом инверсионной вольтамперометрии в анализируемой пробе Хi, мг/кг, с вычисляют по формуле.
где – концентрация контрольного раствора элемента, из которого берется добавка к анализируемой пробе, мг/л;
– объём добавки контрольного раствора элемента, мл;
– величина пика элемента в анализируемой пробе, мкА;
– величина пика элемента в пробе с добавкой контрольного раствора, мкА;
– навеска пробы, взятой для анализа, г;
– объём обессоленной воды, в котором растворена зола, мл;
– объём минерализата, добавленный для анализа в стаканчик, мл
Ответ: концентрация цинка в анализируемой пробе составило 2,46 мг/кг, свинца 0,464 мг/кг.
1. Какая масса никеля выделится в процессе электролиза раствора нитрата никеля в течение 1 ч при силе тока 20 А? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
2. При какой силе тока необходимо проводить процесс электролиза раствора нитрата серебра, чтобы в течение 10 ч получить 0,005 кг чистого металла? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
Электролиз. 10 класс.
3. Какая масса меди выделится при электролизе расплава хлорида меди (II) в течение 2 ч при силе тока 50 А? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
4. В течение какого времени нужно проводить процесс электролиза водного раствора сульфата цинка при силе тока 120 А, чтобы при этом получить 3,5 г цинка? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
5. Какая масса железа выделится в процессе электролиза раствора сульфата железа (III) при силе тока 200 А в течение 2 ч? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
6. При какой силе тока необходимо проводить процесс электролиза раствора нитрата меди (II), чтобы в течение 15 ч получить 200 г чистого металла? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
7. Определить время, теоретически необходимое для полного выделения на катоде кадмия из 40, мл раствора CdSO4 концентрации 0,0466 экв/л, если электролиз проводился при силе тока 0,15 А. Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
8. В течение какого времени необходимо проводить процесс электролиза расплава хлорида железа (II) при силе тока 30 А, чтобы при этом получить 20 г чистого железа? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
9. При какой силе тока необходимо проводить процесс электролиза раствора нитрата ртути (II), чтобы в течение 1,5 ч получить 0,5 кг чистого металла? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
10. При какой силе тока необходимо проводить процесс электролиза расплава хлорида натрия, чтобы в течение 1,5 ч получить 100 г чистого металла? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
11. При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла.
12. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Составьте электронные уравнения процессов, происходящих на электродах (электроды инертные). Какая масса серебра выделилась на катоде.
13. При электролизе раствора соли кадмия израсходовано 3434 Кл электричества. Выделилось 2 г кадмия. Чему равна молярная масса эквивалента кадмия? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
14. В течение, какого времени проводили электролиз раствора Cr2(SO4)3 током силой 3А, если выделилось на катоде 9 гр хрома? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
15. Электролиз протекал 20 мин при силе тока 1,5 А. За это время на катоде выделилось 594 мг вещества, какое это вещество?
16. Определить время, теоретически необходимое для полного выделения на катоде кадмия из 20, мл раствора CdSO4 концентрации 0,0622 экв/л, если электролиз проводился при силе тока 0,1 А. Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
17. Сколько времени надо производить электролиз для полного выделения никеля из 50 мл 2 %-ного раствора NiSO4·7H2O (плотность раствора ρ = 1,01 г/мл) током 0,3 А. Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
18. Какой силы ток надо пропускать через 0,1 н раствор Bi(NO3)3, чтобы в течение 30 мин. полностью выделить металл из 30 мл раствора. Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
19. При пропускании тока силой 2 А в течение 1 часа 14 мин 24 с через вод-ный раствор хлорида металла (II) на одном из графитовых электродов выделился металл массой 2,94 г. Чему равна атомная масса металла, и что это за металл?
20. Сколько времени необходимо для осаждения всей меди из 200 мл 0,2 М раствора CuSO4 в ходе электролиза при силе тока 2 А? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
21. Какова должна быть длительность процесса электролиза при утилизации серебра из 7 л 0,005 М раствора AgNO3? Составить электронные уравнения процессов, происходящих на электродах (электроды инертные).
22. При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислить эквивалентную массу металла.
23. Электролиз раствора нитрата серебра проводили при силе тока 2 А в те-чение 4 ч. Составить электронные уравнения процессов, происходящих на электродах (электроды инертные). Какая масса серебра выделилась на катоде?
24. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислить эквивалентную массу металла.
25. Электролиз раствора СuSО4 проводили в течение 1,5 мин при силе тока 2,5 А, при этом выделилось 0,72 г меди. Составить электронные уравнения процессов, происходящих на электродах в случае угольного анода.
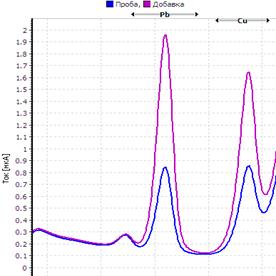
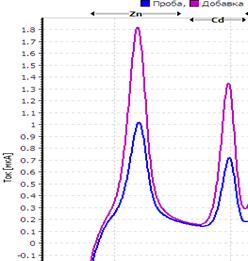
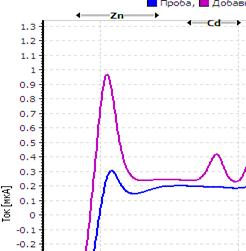
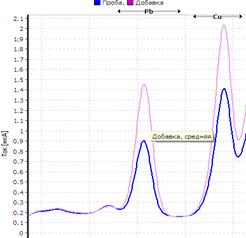
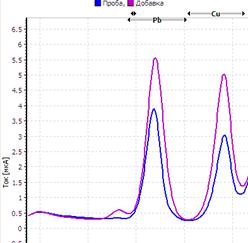
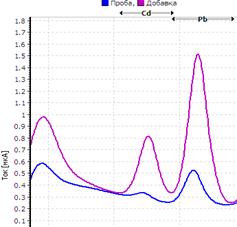
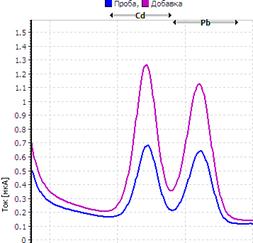
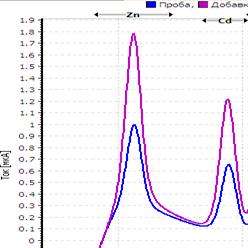
25. Таблица. Вольтамперные кривые
| № | № |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| № | , мг/л | , мл | , г | , мл | , мл |
| 1,0 | 1,0 | 0,04 | 0,04 | 0,979 | 0,2 |
| 10,0 | 10,0 | 0,01 | 0,01 | 0,995 | 0,2 |
| 1,0 | 1,0 | 0,01 | 0,005 | 1,001 | 0,2 |
| 1,0 | 1,0 | 0,04 | 0,04 | 0,975 | 0,5 |
| 1,0 | 1,0 | 0,05 | 0,05 | 0,983 | 0,2 |
| 1,0 | 1,0 | 0,04 | 0,04 | 0,996 | 0,2 |
| 1,0 | 1,0 | 0,01 | 0,005 | 0,990 | 0,5 |
| 1,0 | 1,0 | 0,05 | 0,04 | 0.993 | 0,5 |
| 1,0 | 1,0 | 0,01 | 0,01 | 0,987 | 0,2 |
| 1,0 | 1,0 | 0,04 | 0,04 | 1,002 | 0,5 |
| 1,0 | 1,0 | 0,05 | 0,05 | 0,998 | 0,2 |
| 1,0 | 1,0 | 0,05 | 0,04 | 0,992 | 0,2 |
| 10,0 | 10,0 | 0,01 | 0,01 | 0,978 | 0,2 |
| 1,0 | 1,0 | 0,01 | 0,01 | 0,987 | 0,2 |
| 1,0 | 1,0 | 0,01 | 0,005 | 0,969 | 0,2 |
| 1,0 | 1,0 | 0,05 | 0,05 | 0,999 | 0,5 |
| 1,0 | 1,0 | 0,05 | 0,04 | 1,004 | 0,2 |
| 1,0 | 1,0 | 0,01 | 0,005 | 0,997 | 0,2 |
| 1,0 | 1,0 | 0,01 | 0,01 | 0,995 | 0,5 |
| 10,0 | 10,0 | 0,01 | 0,01 | 0,999 | 0,5 |
| 0,1 | 0,1 | 0,04 | 0,04 | 0,968 | 0,5 |
| 1,0 | 1,0 | 0,04 | 0,04 | 0,971 | 0,2 |
| 1,0 | 1,0 | 0,01 | 0,005 | 0,989 | 0,2 |
| 1,0 | 1,0 | 0,01 | 0,005 | 1,005 | 0,2 |
| 1,0 | 1,0 | 0,04 | 0,04 | 0,997 | 0,5 |
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Определите выход по току, если при прохождении через раствор AgNO3 96500Кл электричества на катоде выделилось 100г серебра

Готовое решение: Заказ №8655

Тип работы: Задача

Статус: Выполнен (Зачтена преподавателем ВУЗа)

Предмет: Химия

Дата выполнения: 22.09.2020

Цена: 228 руб.
Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Определите выход по току, если при прохождении через раствор AgNO 3 96500Кл электричества на катоде выделилось 100г серебра. Составьте электронные уравнения процессов, протекающих на угольных электродах.
Решение :

- Предложите катодное покрытие для защиты меди от атмосферной коррозии. Составьте электронные уравнения катодного и анодного процессов
- Почему в качестве абразивных материалов (режущих) часто применяют алмаз, а для смазочных – графит? Дайте теоретическое объяснение
- По каким критериям можно отличить чистое вещество от раствора?
- Рассчитайте стандартную ЭДС элемента, в котором установилось равновесие: Mg + Zn2+«Zn+Mg2++ Zn; aZn2+=10-2 моль/л, àMg2+=10-3 моль/л
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
В случае копирования материалов, указание web-ссылки на сайт natalibrilenova.ru обязательно.
Источник: natalibrilenova.ru