Ремонт в регионах
- Главная
- Строительные материалы
- Кристаллическое строение металлов
- Альфа-бета-сигма-гамма железо
Аустенит, феррит, цементит, перлит
Ярким примером аллотропии является железо, образующее в зависимости от температуры четыре основных аллотропических видоизменения, которые называют: α-Fе, β-Fe, γ-Fe, δ-Fe.
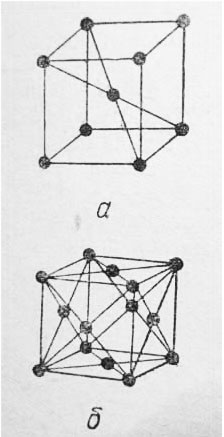
Аллотропические формы α-Fe — альфа железо, β-Fe — бета железо и δ-Fe — сигма железо имеют кристаллическую решетку в форме центрированного куба ( рис. 1, а).
Аллотропическая форма γ-Fe — гамма железо имеет кристаллическую решетку в форме куба с центрированными гранями (рис. 1, б).
Переход железа из одной формы в другую — при охлаждении происходит с выделением тепла, а при нагревании — с поглощением тепла. Это отмечается на графиках охлаждения или нагревания железа На рис. 2 дан схематический график охлаждения чистого железа.
Фото кристаллических решеток железа
Кристаллические решетки металлов | Матвед 1
Кристаллическая решетка — это пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Ha этой кривой при переходах одной аллотропической формы в другую наблюдаются площадки постоянных температур, а именно:
при t=1535°— затвердевание железа с образованием δ-Fe;
фото кристаллических решеток железа
при t= 1390°—переход δ-Fe — γ-Fe;
при t=898° —переход γ-Fe — β-Fe;
при t=775° —переход β-Fe — α-Fe.
При нагревании железа превращения совершаются в обраном порядке, причем переход β -Fe — > γ-Fe происходит при t= 910°
В γ-Fe атомы расположены более тесно, чем в β-Fe, поэьтому переход γ-Fe в β-Fe сопровождается увеличением объема, и наоборот, переход β-Fe в γ-Fe сопровождается уменьшена объема.
Фора γ-Fe не магнитна.
Форма α-Fe магнитна. Форма β-Fe не магнитна, но имеет такую же кристаллическую решетку, как магнитная форма α-Fe — поэтому в металлографическом отношении форма β-Fe отождествляется с формой α-Fe и обе формы условно объединяю под одним названием α-Fe.
Главную роль в технологических процессах горячей механической и термической обработки железоуглеродистых сплавов играют: α -Fe и γ-Fe.
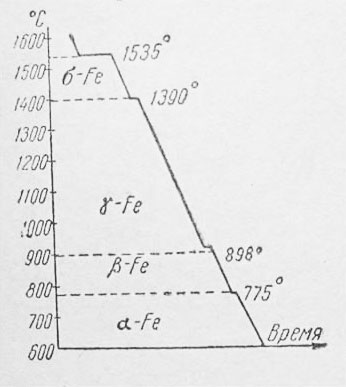
Рис. 2 Кривая охлаждения железа
Важное значение для термообработки имеет свойство γ -Fe давать с углеродом твердые растворы. Наибольшая растворимость углерода в γ-Fe (до 1,7%) наблюдается при t=1130°. При повышении и понижении температуры от t= 1130° растворимость углерода в γ-Fe понижается.
Твердый раствор углерода и других элементов в γ-Fe называется аустенитом.
α-Fe не образует с углеродом устойчивых твердых растворов, подобно аустениту. Растворимость углерода в α -Fe ничтожна. Твердые растворы небольших количеств С и прочих элементов в α-Fe называют ферритом.

Кроме твердых растворов углерода в железе, в железоуглеродистых сплавах встречается химическое соединение железа с углеродом — карбид железа Fe3C, который называется цементитом. Цементит содержит С — 6,67 %.
Аустенит и феррит отличаются пластичностью, феррит, кроме того, — мягкостью. Цементит чрезвычайно тверд и хрупок.
Что такое перлит и эвтектоид
Наблюдения показывают, что этот переход происходит следующим образом: по достижении температур GS по границам Наблюдения показывают, что этот переход происходит следующим образом : по достижении температур GS по границам аустенитовых кристаллов выделяются первые порции α — Fe, т. е. феррита, количество которого постепенно увеличивается.
Так как феррит почти не растворяет углерода, то при переходе γ-Fe -> α-Fe концентрация углерода в остаточном аустените постепенно увеличивается и может быть определена по линии G S в зависимости от температуры. Процесс выделения феррита протекает так до тех пор, пока концентрация углерода не будет соответствовать точке 5, т. е. до С=0,83%, а температура не достигнет t=723°.
В точке S кривая GS пересекается с ES — кривой предельной растворимости углерода в аустените. Поэтому дальнейшее насыщение остаточного аустенита углеродом становится уже невозможным, и последующее охлаждение вызывает окончательный распад аустенита, который совершается при постоянной температуре t=723°.
При этом распаде завершается переход γ- Fe->α-Fe, а выделившийся из кристаллической решетки железа углерод образует частицы цементита F3C. Распад аустенита происходит в стесненном объеме в пределах каждого зерна, поэтому продукты распада (феррит и цементит) образуются в виде тесно перемешанных частиц, обычно в виде чередующихся пластинок феррита и цементита.
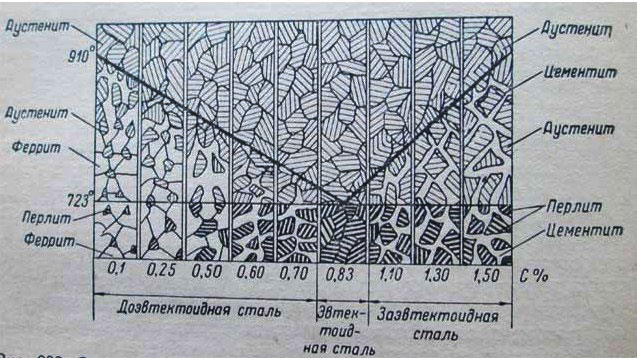
Схема изменений структуры сталей при переходе через критические точки
Этот продукт распада аустенита называется перлитом; так как перлит имеет строение, подобное эвтектике, то он называется эвтектоидом. Разница между эвтектикой и эвтектоидом заключается в том, что эвтектика образуется из жидкого раствора, а эвтектоид — из твердого.
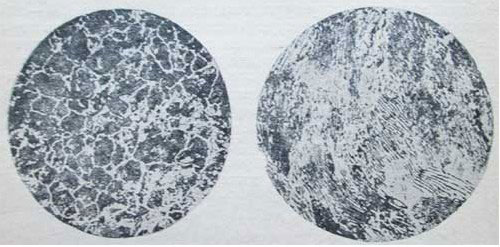
Образование перлита начинается и заканчивается при постоянной t=723°. Так ппявляется феррито-перлитовая структура сталей, которая при дальнейшем охлаждении от t=723° не претерпевает больше никаких структурных изменений. На рисунке представлены микроструктуры чистого железа и стали при С =0,15% и при С=0,6% (увеличение 100) после травления по-шрованной поверхности микрошлифа 4% раствором HNO3 в этиловом спирте.
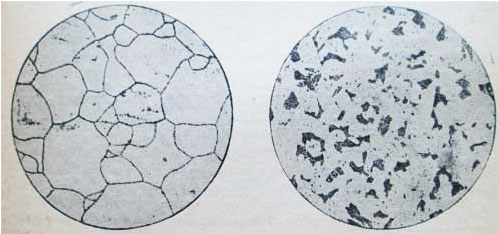
На рис. 1, где показана микроструктура чистого железа, четко выявились границы между светлыми зернами феррита. На рис. 2 представлена микроструктура строительной стали (С=0,15%); светлые поля — это феррит, темные участки — перлит.
На рис. 3 приведена микроструктура машиностроительной стали (С=0,6%), из которой изготовляют оси, валы, шатуны и т. п.; большая часть шлифа занята перлитом, а феррит наблюдается только в виде тонкой сетки.
Чем больше углерода, тем больше в структуре стали перлита, состав перлита одинаков (С=0,83%). Строение перлита обычно пластинчатое (рис. 4).
Феррит, как было указано выше, представляет собой наиболее мягкую пластичную составляющую железоуглеродистых сплавов; цементит, входящий в состав перлита, наиболее твердую и хрупкую, поэтому с увеличением содержания углерода увеличивается прочность и твердость стали, но пластичность и вязкость уменьшаются
Чтобы строительная сталь была достаточно пластичной, количество перлита в ней не должно превосходить 25%, что соответствует содержанию углерода до 0,2%.
Возникновение цементно-перлитовой структуры
В сплавах, содержащих больше 0,83% углерода, структурные изменения при переходе через линии АС и А1Е протекают так же. Поэтому ниже линии А1Е структура затвердевшего сплава представляет собой аустенит. При дальнейшем охлаждении структурные изменения наступают тогда, когда достигнута SE —линия предельной растворимости углерода в аустените.
На рис. 1 цементит заметен в виде тонкой светлой сети окаймляющей темные зерна перлита, а на рис. 2 в виде темпе сетки. Стали с цементито-перлитовой структурой вследствие слишком малых пластичности и вязкости неприменимы для изготовления строительных конструкций и деталей машин. Из них делают инструменты, которым термической обработкой придают необходимую высокую твердость.
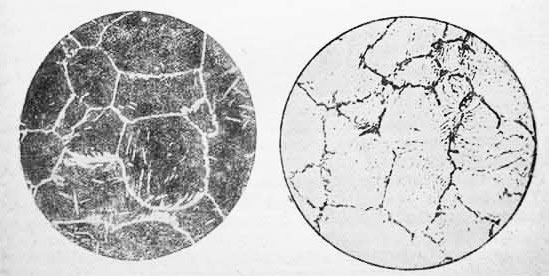
Рис.1 Заэвтектоидная сталь (после травления 4% раствором HNO3 в этиловом спирте. Рис.2 Заэвтектоидная сталь ( после травления пикратом натрия)
Этот процесс продолжается до тех пор, пока не будет достигнута температура линии ЕС. Концентрация углерода в выпадающих дендритах аустенита постепенно изменяется по линии А1Е. Концентрация углерода в жидком растворе увеличивается по линии АС и при t=1130° достигает С=4,3%, т. е. эвтектической концентрации. Дальнейшее охлаждение вызывает полный переход жидкого раствора, достигшего эвтектической концентрации, в твердое состояние.
Этот переход происходит при постоянной температуре t= 1130°; в результате образуется эвтектика, представляюшая собой смесь частиц аустенита и цементита—ледебурит. Таким образом, рассматриваемый сплав непосредственно после затвердевания будет состоять из аустенита и ледебурита. Дальнейшее охлаждение ниже t=1130° вызывает (вследствие уменьшения растворимости углерода по линии ES) выделение вторичного цементита из дендритов аустенита и из аустенита, входящего в состав ледебурита.
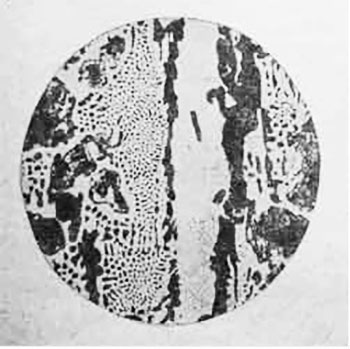
Рис. 3 Белый чугун (микроструктура — перли + цеменит + ледебурит)
Выделение вторичного цементита наблюдается при падении температуры в интервале 1130—723°, причем при снижении температуры до t=723° концентрация углерода в остаточном аустените снижается до эвтектоидной концентрации, т. е. до С=0,83%. Дальнейшее охлаждение вызывает окончательный распад остаточного аустенита.
Этот распад происходит при постоянной температуре t=723°, причем весь аустенит (и выпавший в виде дендритов и входящий в состав ледебурита) переходит в перлит. Таким образом, ниже t=723° в структуре рассматриваемого сплава (рис. 3) содержится перлит, вторичный цеменит и видоизмененный ледебурит, состоящий из цеменита (основная масса) и перлита (округлые вкрапления).
Обычно и первоначальный ледебурит и видоизмененный объединяют общим названием ледебурит. Дальнейшее охлаждение не вызывает изменений в структуре сплава.
Источник: www.masterovoi.ru
Железо: микроструктура и кристаллическая решетка


Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe (выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).

В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
В интервале температур от самых низких до 910°С — а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна.





Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
СВОЙСТВА
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью.
Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все.
Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля.
А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
Типы кристаллических решеток
Дистанцию соседними атомами называют параметром решетки, у разных металлов он составляет 2 — 6 ангстрем. Существуют три основных типа кристаллических решеток:
- Кубическая: объемно-центрированная — включает в себя девять атомов. Свойственна железу, хрому, молибдену, и ванадию.
- Кубическая гранецентрированная: включает в себя уже 14 атомов. Присуща меди, золоту, свинцу, алюминию.
- Гексагональная: атомов уже 17 и размещены они наиболее плотно. Так кристаллизуются магний, цинк кадмий и другие.
ЗАПАСЫ И ДОБЫЧА

Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70% Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4% Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O).
Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.

Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород.
Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
Биологическое воздействие
Для человека железо как микроэлемент (0,02%) на особом счету: он регулирует клеточное дыхание, входит в состав крови.
Значение для здоровья
Организм взрослого человека содержит 3,5 грамма железа. Из них три четверти входит в гемоглобин крови, остальное распределяется по другим структурам организма.
Недостаток микроэлемента порождает анемичность у человека или животных, хлороз у растений.
Питание
В организм железо доставляется пищей.
Самые богатые микроэлементом продукты обнаружены во всех пищевых группах:
- Хлеб, крупы.
- Печень, мясо.
- Яйца.
- Свекла, листовая зелень.
- Бобовые.
- Сухофрукты, орехи, семечки.
Продукты питания содержат разные виды железа: гемовое и негемовое. Гемовое содержит «животный» ассортимент, негемовое – растительный.
Потребность
Суточная потребность в железе (мг):
- дети – 4-18;
- женщины – 18;
- мужчины – 10.
При беременности норма увеличивается вдвое. Больше требуется анемичным людям и донорам.
Организму легче усваивать гемовое железо, поэтому веганам либо вегетарианцам ежесуточно требуется 30-33 мг.
Опасность переизбытка
Однако избыток вещества не приветствуется, поскольку «придавливает» образование антиоксидантов в организме.
По стандартам РФ, в литре воды должно быть не более 0,3 мг железа.
ПРОИСХОЖДЕНИЕ
Происхождение теллурическое (земное) железо редко встречается в базальтовых лавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
ПРИМЕНЕНИЕ
Железо — один из самых используемых металлов, на него приходится до 95% мирового металлургического производства.

Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых. Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Когда было открыто
История знакомства человека с железом начинается с Космоса. Судя по древним (например, древнеегипетским) названиям элемента, это было метеоритное железо. Хеттские тексты упоминают о нем как об «упавшем с неба».
Человек использует металл 6 тысяч лет.
Археологи откопали используемые древними шумерами и египтянами инструменты. Они сделаны из метеоритного железа.
Железные изделия завоевывали мир. Металлу посвящены стихи Гомеровой «Илиады», его упоминают Аристотель и Страбон.
Небесным происхождением обусловлено античное наименование железа: «сидер» («звездный»).
Ученые исследуют потенциал металла постоянно. Так, в 1868 году русский ученый Д. К. Чернов открыл кристаллические модификации вещества.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.

При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Научно-популярный журнал Познавайка
Эта статья доступна на английском – Crystal Lattice in Chemistry.
Кристаллическая решетка железа
Основными строительными блоками твердых веществ, таких как соль или лед, являются молекулы. Каждая молекула состоит из двух или более атомов, например, натрий+хлор (NaCl), как у поваренной соли и водород+кислород, как у льда (H2O). В металлах, однако, такими строительными блоками являются отдельные атомы металла: атомы железа (Fe) в железном прутке или меди (Cu) в медной проволоке.
Каждое зерно на рисунке 1 есть то, что называется кристаллом. В кристалле, который состоит из атомов, все атомы однородно расположены по слоям. Как показано на рисунке 2, если провести линии, которые соединяют центры атомов, то трехмерные ряды маленьких кубиков заполнят все пространство, занимаемое отдельным зерном. Эту трехмерную структуру и называют кристаллической решеткой атомов.
Рисунок 2 – Кристаллическая решетка железа
Источник: spvhmao.ru
1.Физические свойства железа.
2. Кристаллическая структура и область существования модификаций железа.
Структура решетки: кубическая объемоцентрированная. Период решетки: 2,870 А. Температура Дебая: 460 К. Для Fe характерен полиморфизм, он имеет 4 кристаллические модификации: 1) до 910°С сущ-ет α-Fe (феррит) с ОЦК решеткой; 2) в температурном интервале 768-910°С сущ-ет β-Fe, кот отличается от α-Fe только параметрами кристаллической решетки и магнитными св-вами; 3) в температурном интервале 910-1401°С сущ-ет γ-Fe (аустенит) с ГЦК решеткой; 4) выше 1401°С до температуры плавления устойчив δ-Fe с ОЦК решеткой.
3. Кристаллическая структура и область существования модификаций углерода.
Углерод обладает свойством полиморфного превращения: имеет гексагональный тип решетки (графит) или решетку с КЧ=4(типа алмаза). Период решетки: 3,570 А. Кристаллические модификации углерода — алмаз и графит. В виде графита углерод находится в сплавах железа типа чугунов.
Тпл графита -3500°С , плотность 2,5 г/см 3 . В сплавах железа с углеродом углерод находится в состоянии твердого раствора с Fe и в виде хим соединения Fe3C – цементита(6,67%С). При норм усл термодинамически устойчив только графит, а алмаз и другие формы метастабильны. При атмосферном давлении и темп-ре выше 1200 K алмаз начинает переходить в графит. Также известны модификации углерода: фуллерены (получают при высоких темп-рах, 64 атома выстраиваются на равных расстояниях в сферу), трубки, карбин.
4. Цементит. Физические св-ва и кристал-ская структура.
Источник: studfile.net