| IA | IIA | IIIB | IVB | VB | VIB | VIIB | —- | VIIIB | —- | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Период | ||||||||||||||||||
| 1 | 1 H Водород |
2 He Гелий |
||||||||||||||||
| 2 | 3 Li Литий |
4 Be Бериллий |
5 B Бор |
6 C Углерод |
7 N Азот |
8 O Кислород |
9 F Фтор |
10 Ne Неон |
||||||||||
| 3 | 11 Na Натрий |
12 Mg Магний |
13 Al Алюминий |
14 Si Кремний |
15 P Фосфор |
16 S Сера |
17 Cl Хлор |
18 Ar Аргон |
||||||||||
| 4 | 19 K Калий |
20 Ca Кальций |
21 Sc Скандий |
22 Ti Титан |
23 V Ванадий |
24 Cr Хром |
25 Mn Марганец |
26 Fe Железо |
27 Co Кобальт |
28 Ni Никель |
29 Cu Медь |
30 Zn Цинк |
31 Ga Галлий |
32 Ge Германий |
33 As Мышьяк |
34 Se Селен |
35 Br Бром |
36 Kr Криптон |
| 5 | 37 Rb Рубидий |
38 Sr Стронций |
39 Y Иттрий |
40 Zr Цирконий |
41 Nb Ниобий |
42 Mo Молибден |
(43) Tc Технеций |
44 Ru Рутений |
45 Rh Родий |
46 Pd Палладий |
47 Ag Серебро |
48 Cd Кадмий |
49 In Индий |
50 Sn Олово |
51 Sb Сурьма |
52 Te Теллур |
53 I Иод |
54 Xe Ксенон |
| 6 | 55 Cs Цезий |
56 Ba Барий |
* | 72 Hf Гафний |
73 Ta Тантал |
74 W Вольфрам |
75 Re Рений |
76 Os Осмий |
77 Ir Иридий |
78 Pt Платина |
79 Au Золото |
80 Hg Ртуть |
81 Tl Таллий |
82 Pb Свинец |
83 Bi Висмут |
(84) Po Полоний |
(85) At Астат |
86 Rn Радон |
| 7 | 87 Fr Франций |
88 Ra Радий |
** | (104) Rf Резерфордий |
(105) Db Дубний |
(106) Sg Сиборгий |
(107) Bh Борий |
(108) Hs Хассий |
(109) Mt Мейтнерий |
(110) Ds Дармштадтий |
(111) Rg Рентгений |
(112) Cp Коперниций |
(113) Uut Унунтрий |
(114) Uuq Унунквадий |
(115) Uup Унунпентий |
(116) Uuh Унунгексий |
(117) Uus Унунсептий |
(118) Uuo Унуноктий |
| 8 | (119) Uue Унуненний |
(120) Ubn Унбинилий |
||||||||||||||||
| Лантаноиды * | 57 La Лантан |
58 Ce Церий |
59 Pr Празеодим |
60 Nd Неодим |
(61) Pm Прометий |
62 Sm Самарий |
63 Eu Европий |
64 Gd Гадолиний |
65 Tb Тербий |
66 Dy Диспрозий |
67 Ho Гольмй |
68 Er Эрбий |
69 Tm Тулий |
70 Yb Иттербий |
71 Lu Лютеций |
|||
| Актиноиды ** | 89 Ac Актиний |
90 Th Торий |
91 Pa Протактиний |
92 U Уран |
(93) Np Нептуний |
(94) Pu Плутоний |
(95) Am Америций |
(96) Cm Кюрий |
(97) Bk Берклий |
(98) Cf Калифорний |
(99) Es Эйнштейний |
(100) Fm Фермий |
(101) Md Менделевий |
(102) No Нобелей |
(103) Lr Лоуренсий |
|||
68% учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Идея организовать элементы в порядке возрастания веса их атомов. Химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом.
Закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме.
Сейчас используем понятие атомного числа (количества протонов) для того, чтобы правильно упорядочить систему элементов, это решает техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
Короткая форма таблицы, содержащая восемь групп элементов, была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию использовать длинную форму, короткая форма продолжила приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, вместо неё используется длинная форма. Такую ситуацию некоторые исследователи связывают в том числе с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной международной информации.
Периодический закон Дмитрия Ивановича Менделеева является фундаментальным законом описывающим периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов).
Термин «периодический закон» Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». Графическое табличное выражение периодического закона — периодическая система элементов разработанна Дмитрием Ивановичем Менделеевым.
Источник: himsnab-spb.ru
7 элементов в таблице Менделеева, которые здравому смыслу не оставляют ни единого шанса
Какой самый интересный и сумасшедший элемент в периодической таблице химических элементов?

Почти любой элемент в периодической таблице Менделеева удивителен и имеет долю сумасшествия. Сера, похоже, не принадлежит к сумасшедшему клубу. Но тем не менее факты о ней удивительно интересны.
Учтите, что вода – это H20. Это необходимо для жизни. Она не пахнет. Это жидкость.
Чуть ниже кислорода в периодической таблице находится сера. У нее, по логике, должны быть похожие свойства. Но это не так. Согласитесь, это поразительно. Но есть в нашем мире химии и более необычные элементы, которые могут удивить еще больше.
Мы в 1Gai.Ru изучили всю таблицу Менделеева, отобрав для вас самые интересные факты о самых удивительных элементах.
Цезий как эталон самого точного времени в мире

Цезий – прекрасный пример управляемого хаоса. Этот элемент известен как радиоактивный отход от ядерных взрывов. Цезий является одним из пяти элементов, которые находятся в жидком состоянии при комнатной температуре.
Но самое удивительное изменение состояния цезия происходит, когда вы помещаете его в воду. Вот что при этом происходит:

Также у цезия электронные переходы настолько точны, что он стал использоваться в качестве основного стандарта для определения самого точного в мире времени.
Так, секунда – это время, равное 9 192 631 770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133.
Цезий применяется в атомных часах. Вот как они выглядят:

Эти атомные часы настолько точны, что не потеряют ни секунды за 20 миллионов лет. Это безумие, как такой нестабильный элемент может быть использован, чтобы стать нашим точным определением времени.
Смотрите также
Олово – элемент, который совершает самоубийство!
Олово (Sn) – это 50-й элемент периодической таблицы Менделеева.

Олово издавна известно человечеству. Так, есть доказательства, что человек знал об олове уже в IV тысячелетии до нашей эры. Этот металл был очень дорог и мало кому доступен. Именно поэтому изделия из него редко встречаются среди римских и греческих древних находок. Примечательно, что об олове даже есть информация в Библии (Четвертой Книге Моисея).
Обычно олово существует в его так называемой бета-форме (олово белое β-форма). Олово в этой форме белое, блестящее и сохраняет свою форму. Но когда температура опускается ниже 13 ° C, олово начинает менять свою красивую форму – переходит в альфа-форму ( α -модификация серого олова), которая в основном представляет собой сероватый порошок. Этот переход металлического олова в бесполезный пепел называется «оловянной чумой».


Примечательно, что вокруг олова в нашем мире есть множество интересных легенд. Одна из самых интересных – это легенда о том, как свойства олова сыграли с Наполеоном Бонапартом злую шутку.
Легенда гласит, что это необычное химическое поведение олова способствовало падению императора Наполеона Бонапарта. В те времена олово использовалось для изготовления пуговиц и других застежек солдатской формы. Пока армия французов шла в сторону России, с пуговицами солдат было все порядке. Но все изменилось, когда солдаты ступили на российскую землю, где свирепствовали морозы.

Вот тут-то и началась метаморфоза с оловянными пуговицами, которые начали разрушаться, в результате чего форма не могла согреть солдат. В действительности же олову требуется несколько месяцев, чтобы буквально уничтожить себя, преобразовавшись в другую форму. Но, с другой стороны, когда французы вторглись в Россию, температура была ниже минус 30 ° C.
Так что, как полагают некоторые историки и химики, это и послужило сильным толчком для перехода оловянных пуговиц в порошкообразную форму. Правда, все это исторически не подтверждено. А согласитесь, легенда хорошая. Ведь один факт, что легендарный Наполеон потерпел крах своей армии на территории России из-за проблем с форменным обмундированием и виной всему химические свойства олова… Звучит красиво!
Если вам интересно, вот видео, которое показывает переход олова из его бета-формы в альфа-форму:
Висмут
Обычно это выглядит так:

Но при правильных условиях это может выглядеть так:

Характеристики таблицы Менделеева
Каждый человек из школьного курса химии знает, что существует система элементов, распределенных определенным образом. Визуально эта система представлена в таблице Менделеева. Сейчас трудно представить развитие науки без этого фундаментального труда. Ее можно увидеть в научных лабораториях, учебных аудиториях ВУЗов и школ. Для многих она так и осталась разноцветной картинкой с непонятными надписями в клетках.
История создания
Существует множество мифов о появлении всемирно известного научного труда. Один из них гласит, будто бы ученому знания привиделись во сне. На самом же деле, появлению на свет химической таблицы предшествовали многолетние исследования. В 1869 году Менделеев вывел только периодический закон, который был понятен лишь одному ученому.
В голове гения науки вся информация была упорядочена. Сам он прекрасно знал, что такое химические элементы с их физико-химическими свойствами, но свести ее к понятному непросвещенному человеку он не мог. Об этом он поведал своему соратнику А.А. Иностранцеву. Кстати, последний и придумал в шутку миф о легендарном сне ученого.
Менделеев начал кропотливо работать, перебирая различные варианты структуризации информации: диаграммы, графики, аналитические кривые и т.п. Наконец, в 1871 году получился конечный вариант периодической таблицы Менделеева, который мы видим сегодня.

Таблица Менделеева: значение и структура
Структура
- К примеру, атомы элементов второго периода имеют 2 уровня, а в пятом периоде их будет 5;
- Нумерация периодов расположена слева от таблицы.
Периоды бывают большие и малые, в зависимости от количества элементов, находящихся внутри. Возьмем, к примеру, II и III периоды (строка 2 и 3). В начале каждого стоят два элемента, затем идет большое пустое пространство, а в конце находятся еще несколько элементов. В I периоде всего 1 элемент. Поэтому I-III периоды называются малыми, а IV-VII – большими.
Элементы обладают определенными химическими свойствами, по которым они распределяются на группы химических элементов. К примеру, у водорода атомный номер 1, а у гелия 2, однако они расположены в разных концах таблицы, т.к. принадлежат разным группам.
По группам, расположенным в вертикальных столбцах, можно быстро определить схожие химические свойства. У всех элементов группы одинаковое количество электронов в оболочке атома.
Свойства химических элементов
Основными физико-химическими свойствами элементов являются:
- Металлическое свойство (восстановительное) – способность атома отдавать электроны.
- Неметаллическое свойство (окислительное) – способность атома принимать электроны.
- Электроотрицательность – способность атома притягивать к себе электроны от атомов других элементов.
Если заняться просмотром периода, мы сможем наблюдать, как увеличивается заряда ядра и количество электронов на внешнем энергетическом уровне. Также увеличивается электроотрицательности атомов. При этом идет уменьшение атомного радиуса в таблице Менделеева.
Просматривая группу (вертикальную колонку), можно наблюдать за увеличением заряда ядра и радиуса атома. Металлические свойства усиливаются, а неметаллические ослабевают.
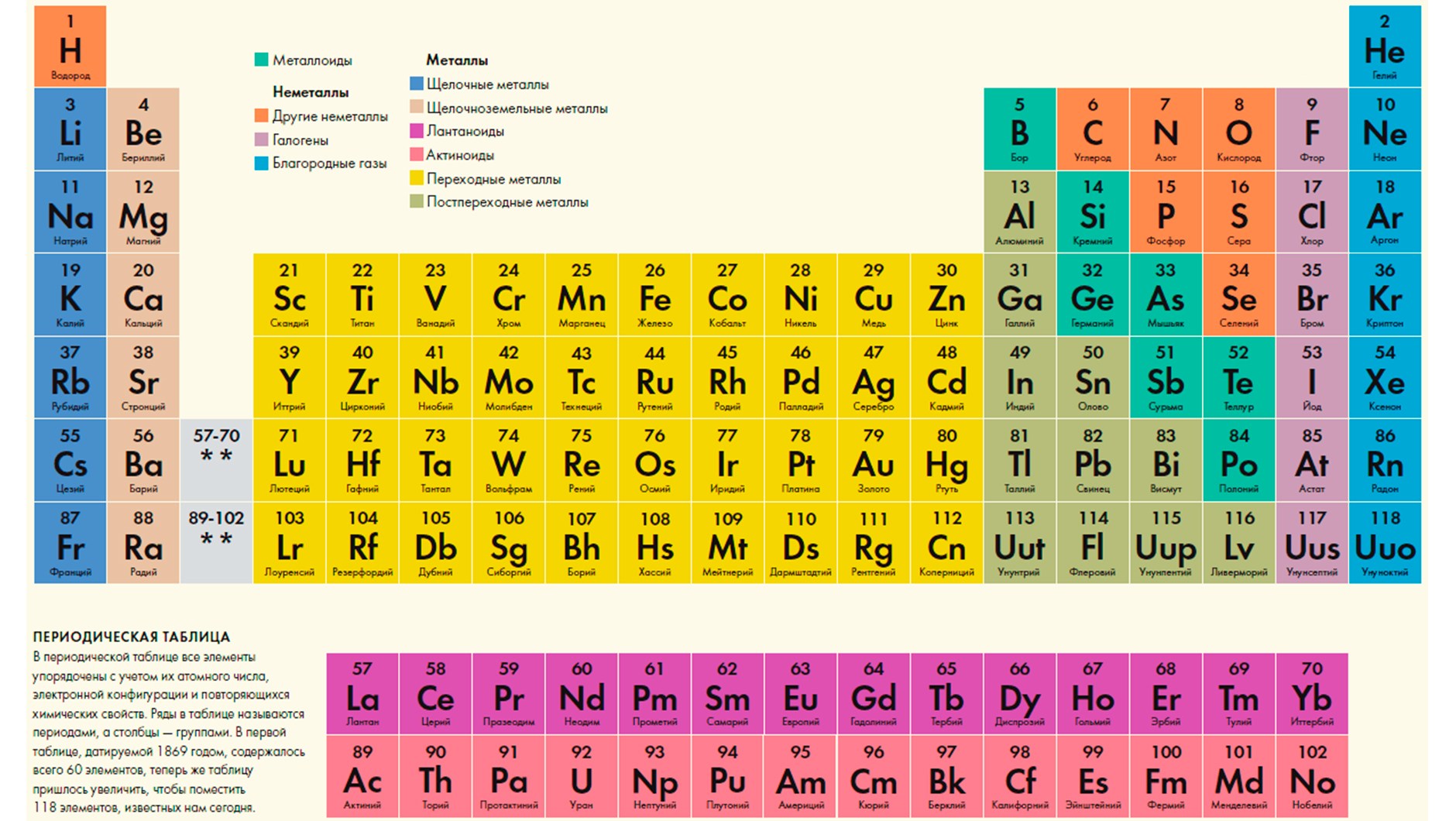
Таблица Менделеева: значение и структура
Подгруппы
Если внимательно посмотреть на вертикальную колонку, можно увидеть, что символы располагаются неодинаково. Это сделано для обозначения принадлежности элемента к определенной подгруппе «А» или «В». «А» является главной подгруппой в таблице Менделеева. Элемент, располагающийся в левой части ячейки, принадлежит к подгруппе «А» (главной).
Разберем на примере принадлежность химического элемента. Углерод (С) принадлежит к II периоду, главной подгруппе IV группы. У титана (T) IV период, IV группа и побочная (B) подгруппа.
Что находится в ячейках
- Водород является одновременно щелочным металлом и галогеном, поэтому встречается в двух местах таблицы;
- Металлы обладают хорошей тепло- и электропроводностью. В обычных условиях имеют твердое состояние. Исключением является ртуть;
- Неметаллы имеют газообразное состояние, однако при определенном давлении и температурных условиях могут затвердевать или принимать жидкое состояние;
- У металлоидов могут быть свойства металлов и неметаллов.

Классификация химических элементов
Щелочные металлы дают начало, а инертные газы завершают каждый период, кроме первого (т.к. там находится только водород).
1-й столбец (главная подгруппа) – это щелочные металлы. Это очень мягкие вещества серебристого или, в случае цезия, золотистого цвета с мягкой структурой. Они не тонут в воде, вступая с ней в реакцию с обильным выделением водорода и щелочи. Для них необходимы особые условия хранения – в керосине или вазелине, т.к. при взаимодействии с кислородом взрывоопасны.
Щелочноземельные металлы, входящие во 2-ю главную подгруппу (IIA) имеют 2 электрона на внешней энергетической оболочке атома. Плавятся при более высоких температурах, чем у щелочные металлы.
- Лантаноиды – вещества, найденные в редких минералах, поэтому называются «редкоземельными элементами».
- Актиноиды – радиоактивные вещества, полученные синтезировались искусственно. Единственным актиноидом природного происхождения является уран (U).
Все металлы, входящие в побочные группы (за исключением лантаноидов и актиноидов) называются переходными.
В правом верхнем углу таблицы находятся неметаллы, обладающей низкой тепло- и электропроводностью. Встречаются во всех агрегатных состояниях.
Углеродная – это 4-я главная подгруппа (IVA). Она разнообразна по составу входящих в нее элементов и их свойствам: кремний и углерод относятся к неметаллам, олово и германий – металлоиды, свинец – металл. Большая часть элементов является полупроводниками. При помощи кремния, германия и графита производят процессоры, транзисторы и т.п.

Таблица Менделеева: значение и структура
Азотная – 5-я главная (VA), включающая химические элементы с различными свойствами:
- Фосфор, обладающий мягкой консистенцией, может иметь несколько оттенков – белый, черный и красный;
- Азот – бесцветный газ.
- Висмут – блестящий металл сребристо-белого цвета с разноцветными оттенками.
- Мышьяк является твердым полуметаллом с хорошей электропроводностью.
В азотной подгруппе присутствуют вещества опасные для человека, но полезные для других микроорганизмов и растений. Фосфор является необходимым для питания растений, но токсичен для человеческого организма. Азот – одно из основных веществ, формирующих атмосферу земли.
Кислородная подгруппа – 6-я главная подгруппа (VIA). У элементов проявляется сильные окислительные характеристики. По мере приближения к полонию свойства окисления становятся более слабыми.
Галогены – 7-я главная подгруппа (VIIA). Элементы, входящие в ее состав, обладают сильнейшими окислительными свойствами. Быстро вступают в реакцию с металлами с выделением солей.
Последняя, 8-я главная подгруппа (VIIIA) включает в себя инертные газы. Один из элементов – неон. Его используют для производства ламп для рекламных вывесок. Ксенон, входящий в подгруппу, используется при производстве лампочек для автомобильных фар. Эти газы имеют свойство светиться под воздействием электромагнитного излучения.
Подгруппа завершает периоды II-VII.

Какая информация содержится в ячейках
В каждом элементе указан его атомный номер, название, буквенное выражение и массовое число. В некоторых таблицах (не во всех) указывается полное название . Оно располагается под его буквенным обозначением (к примеру, Sn в таблице Менделеева – это олово).
Буквенное обозначение (символ) отражает название элемента. Для примера возьмем тот же бериллий. Его символ в периодической системе химических элементов «Be». Часто в таблицах название вещества отсутствует и приводится лишь его химический символ. Буквенное обозначение располагается в центре клетки и пишется латинскими буквами.
Каждому элементу присваивается атомный номер от 1 до 118. Он написан в в середине или в углу верхней части ячейки. Например, 73 в таблице Менделеева – это химический элемент Тантал. По числу атомных номеров можно сказать, сколько элементов в таблице Менделеева — 118.
Под буквенным обозначением указывается атомная масса. Этот показатель является суммарную массу протонов и нейтронов. Является средней величиной и обозначается десятичной дробью (для большинства элементов).
Следующая информация – это массовое число. С помощью него можно понять, какое количество протонов и нейтронов содержится в ядре. Оно не написано отдельно – определить его можно, округлив атомную массу элемента до целого числа. К примеру, бериллий (Be) имеет показатель атомной массы равный 9.0122. Округлив значение, получим массовое число равное 9.
Примечание: Единственное вещество из таблицы, значение которого не округляется до целого числа – хлор (Cl). Его атомная масса равняется 35.453, поэтому массовое число будет равно 35.5.

Таблица Менделеева: значение и структура
Таблица Менделеева ЕГЭ
Список разрешенных материалов при сдаче единого государственного экзамена ограничен. Экзаменуемые, при сдаче химии, могут использовать:
- Периодическую систему химических элементов Д. И. Менделеева.
- Ряд активности металлов.
- Таблицу растворимости.
Эти материалы содержат минимальную информацию, достаточную для решения задач. Такие требования связаны с тем, чтобы избежать использования шпаргалок, т.к. в некоторые учебники предлагают таблицы, которые, фактически, являются готовым решением.
Подготовку в школе лучше начинать именно с материалов, допущенных к использованию на ЕГЭ. К таблице Менделеева ОГЭ предъявляются аналогичные требования.
След в истории
Периодическая система химических элементов Д.И. Менделеева – это, несомненно, одно из величайших достижений в области науки. В свое время великий ученый предсказал появление новых видов веществ, что и произошло спустя долгие годы после его смерти. До сих пор таблица Менделеева является фундаментальной основой в области химии.
Существует множество вариаций классического варианта. Современная таблица Менделеева с названиями элементов на русском висит в каждом классе химии в школе. Огромное количество выдающихся открытий были сделаны на основе трудов ученого.
Источник: egevpare.ru