К пятой аналитической группе катионов относятся ионы Fe 2+ , Fe 3+ , Mn 2+ , Mg 2+ , Ионы Мn 2+ и Mg 2+ — бесцветные, ионы Fe 2+ — бледно-зеленые, а ионы Fe 3+ — желтые. Нитраты, сульфаты и хлориды катионов этой группы хорошо растворимы в воде. Гидроксиды катионов этой группы слабые труднорастворимые электролиты. Они не растворяются в избытке щелочи и в растворе аммиака, чем отличаются от гидроксидов четвертой и шестой групп. Групповым реагентом является NaOH.
Все соли катионов пятой аналитической группы подвергаются гидролизу, особенно соли железа (III).
Ионы Fe 2+ и Fe 3+ легко образуют комплексные соединения. Это свойство широко используется не только для открытия, но и для маскировки ионов Fe 3+ .
Элементы пятой аналитической группы имеют переменную степень окисления (кроме магния) и поэтому для них характерны окислительно-восстановительные реакции. Это свойство используется для открытия ионов Мn 2+ (окисление до фиолетового иона МnО4 — ).
Свежеосажденные сульфиды и гидроксиды элементов пятой аналитической группы аморфны и способны довольно легко переходить в коллоидное состояние. Это происходит в том случае, когда при определенных условиях рост частиц труднорастворимого соединения задерживается и образуются так называемые коллоиде частицы. Таким образом, труднорастворнмое соединение не выпадает в осадок, а образует коллоидный раствор, занимающий промежуточное положение между грубыми суспензиями (взвесями) и истинными растворами.
Румянцева М.Н.- Общая и неорганическая химия. Лекции — 13. Элементы 15 группы (продолжение)
Если в коллоидный раствор добавить избыток какого-либо электролита, происходит процесс коагуляции: образующиеся крупные частицы уже не могут удерживаться во взвешенном состоянии и начинают быстро оседать. Коагуляции также способствует повышение температуры. Склонность сульфидов и гидроксидов образовывать коллоидные растворы усложняет анализ, так как коллоидные частицы не могут быть отделены центрифугированием.
Поэтому осаждение необходимо вести в условиях, способствующих разрушению коллоидных частиц, т. е. при нагревании раствора и прибавлении к нему электролита. Промывать такие осадки надо горячей водой с небольшим количеством электролита (обычно добавляют хлорид или нитрат аммония). Если этого не сделать, то при промывании водой электролит с осадка полностью удаляется и частицы осадка вновь образуют коллоидный раствор.
Железо, марганец и магний относятся к элементам, необходимым для жизнедеятельности организма человека. Железо входит в состав гемоглобина и ряда ферментов. Большая часть железа содержится в гемоглобине эритроцитов, часть находится в печени в соединении с белком. Марганец участвует в обмене углеводов.
Количество магния в природной воде определяет ее жесткость. Соли магния необходимы для питания растений, так как магний входит в состав хлорофилла. Магний содержится в теле человека, в основном в костной ткани, и, кроме того, регулирует работу сердца.
В медицине нашли применение перманганат калия КМnО4, раствор которого используется как антисептическое средство. Препараты железа применяют при анемии. Соединения магния употребляются как антацидные средства. Сульфат магния используется в качестве слабительного, успокаивающего и спазмолитического средства.
Соли. Свойства солей.
Частные реакции катионов пятой аналитической группы
1. Гидроксиды щелочных металлов NaOH и КОН количественно осаждают гидроксид железа (II) бледно-зеленого цвета:
Гидроксид растворяется в кислотах, но не растворяется в щелочах
При стоянии на воздухе осадок быстро буреет вследствие окисления до гидроксида железа (III):
2. Гексацианоферрат (III) калия Кз[Fе(СN)6] выделяет темно-синий осадок турнбулевой сини:
Осадок практически нерастворим в кислотах, но разлагается щелочами. Это самая чувствительная реакция на соли железа (II). Для подавления гидролиза солей железа реакцию проводят в кислой среде. Избытка реактива следует избегать, так как его желтая окраска придает осадку зеленоватый оттенок. Реакция является фармакопейной.
3. Сульфид аммония (NH4)2S количественно осаждает железо (II) в виде сульфида железа (II) черного цвета:
Осадок растворяется в кислотах. Данная реакция является фармакопейной.
1. Гидроксиды щелочных металлов и аммиак выделяют бурый студенистый осадок гидроксида железа (III):
Гидроксид железа (III) растворяется в кислотах, но не растворяется в избытке щелочей.
2. Роданид калия KSCN дает с раствором соли железа (III) в слабокислой среде кроваво-красное окрашивание вследствие образования железо-роданистых комплексов. Реакция применяется для качественного и количественного определения Fe(III). Упрощенное уравнение может быть записано следующим образом:
Fe 3+ + 3SCN — → Fe(SCN)3.
Реакция обратима, поэтому для повышения ее чувствительности реактив должен быть взят в избытке. Реакция фармакопейная.
3. Гексацианоферрат (II) калия K4 Fe(CN)6] осаждает из нейтральных или кислых растворов солей железа (III) берлинскую лазурь — осадок интенсивного синего цвета:
В кислотах осадок заметно не растворяется, щелочи его разлагают. Реакция очень чувствительна и поэтому обычно применяется для определения Fe 3+ в анализируемых растворах.
4. Сульфид аммония (NH4)2S, прибавленный к раствору солям железа (III), дает черный осадок сульфида железа (III):
Этот осадок растворяется в кислотах.
5. Иодид калия или натрия окисляется солями железа (III) в кислой среде до свободного йода.
Выполнение реакции . На фильтровальную бумагу наносят последовательно по одной капле растворов FeСl, НС1 и KI. Наблюдают появление бурого пятна. При добавлении 1 капли крахмала пятно становится темно-синим.
6. Реакция с сульфосалициловой кислотой. Катион Fe 3+ реагирует в водных растворах с сульфосалициловой кислотой с образованием окрашенных комплексов. Наиболее устойчив комплекс желтого цвета. Точное строение комплексов в растворе неизвестно.
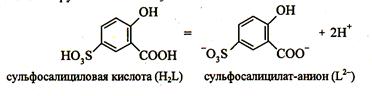 |
Соли висмута (Ш) гидролизуются в водных растворах с образованием осадков малорастворимых оксосоединений — солей висмутила, формально содержащих катион висмутила ВiО + (например, BiOCl, ВiONОз и др.). Если соль висмута (Ш) растворить в воде, то получают мутный раствор вследствие образования частиц продуктов гидролиза. для подавления гидролиза и получения прозрачных растворов соль висмута (Ш) растворяют не в чистой воде, а в растворах кислот, чаще всего — в растворе HCl, в котором висмут (Ш) присутствует в форме хлоридных комплексов [ВiСl6] З — . На практике обычно используют солянокислые растворы хлорида висмута(Ш).
Осадок растворяется в минеральных кислотах. При нагревании белый осадок Вi(ОН)3 желтеет вследствие образования оксогидроксида висмута (Ш) ВiO(ОН) (гидроксида висмутила):
2. Реакция гидролиза. Разбавление водой растворов солей висмута (Ш) приводит к их гидролизу с выделением белого осадка оксохлорида висмута BiOCl (хлорида висмутила):
[ВiСl6] 3 — + Н2О = ВiOСl + 2НСl+ЗСl —
При прибавлении раствора HCl и нагревании осадок растворяется (обратная реакция). Осадок оксохлоридависмута (Ш) не растворяется в растворах винной кислоты и ее солей.
3. Реакция с сульфид-ионами (фармакопейная). Висмут (Ш) при реакции с сульфид — ионами в кислой среде образует черно-коричневый осадок сульфида висмута (Ш) Вi2Sз:
Осадок не растворяется в разбавленных минеральных кислотах, за исключением разбавленной НNОз, в которой он растворяется с выделениемсвободной серы:
Осадок сульфида висмута растворяется в присутствии хлорида железа(Ш) FеСlз — также с выделением свободной серы:
Вi2Sз + 6FеСlз → 2ВiСlз + 6FeCl2 + 3S
4. Реакция с иодидами (фармакопейная). При прибавлении растворов иодидов к кислым растворам висмута (Ш) выпадает черный осадок иодида висмута (Ш) ВiI3, растворимый в избытке реагента с образованием желто- оранжевого раствора, содержащего тeтpаиодовисмутат (Ш)-ионы:
Разбавление полученного раствора водой приводит к выпадению осадка ВiI3 с последующим его гидролизом и образованием желто-оранжевого оксоиодида висмута BiOI (иодида висмутила). Суммарно реакцию гидролиза можно описать схемой:
5. Реакция восстановления висмута (Ш) до висмута(0) соединениями олова (П). В щелочной среде (рН ≈10) олово (П) восстанавливает висмут(IП) до металлического висмута(0), выделяющегося в виде черного осадка. Олово (П) при этом окисляется до олова(IV):
При большом избытке щелочи и нагревании выпадает также черный осадок металлического олова вследствие протекания реакции диспропорционирования:
При недостатке щелочи может выпасть черный осадок оксидаолова (II) SnO:
1. Гидроксиды щелочных металлов NaOH и КОН с солями марганца (II) дают белый осадок гидроксида марганца (II):
Осадок быстро буреет на воздухе вследствие окисления кислородом воздуха до MnО(OH)2 (Н2МnОз)
Осадок растворим в разбавленных растворах сильных кислот и в насыщенном растворе хлорида аммония:
2. Пероксид водорода Н2О2 в щелочной среде окисляет соли марганца (II) до темно-бурого осадка Н2МnО3 или МnО(ОН)2:
Бромная вода оказывает такое же действие. В отличие от Мn(ОН)2 осадок МnО(ОН)2 не растворяется в разбавленной серной кислоте.
3. Диоксид свинца РbО2 в присутствии концентрированной азотной кислоты при нагревании окисляет Мn(II) до МnО4 — с образованием марганцевой кислоты малинового цвета:
2Mn 2+ + 5РbO2 + 4H + → 2MnO4 — + 5Pb 2+ + 2H2O
Эта реакция дает отрицательные результаты в присутствии восстановителей, например хлороводородной кислоты и ее солей, так как они взаимодействуют с диоксидом свинца, а также с образовавшейся марганцевой кислотой.
При больших количествах марганца эта реакция не удается, так как избыток ионов Мn 2+ восстанавливает образующуюся марганцевую кислоту НМnО4 до МnО(ОН)2 и вместо малиновой окраски появляется бурый осадок. Вместо диоксида свинца для окисления Мn 2+ в МnО4 — могут быть использованы другие окислители, например персульфат аммония (NH4)2S2O8 в присутствии катализатора ионов Ag + или висмутат натрия NaBiO3:
Выполнение реакции. В пробирку вносят стеклянным шпателем немного РbСl, а затем 5 капель концентрированной азотной кислоты НNО3 и нагревают смесь на кипящей водяной бане. В нагретую смесь добавляют 1 каплю раствора сульфата марганца MnSO4 и снова нагревают 10—15 мин, встряхивая время от времени содержимое пробирки. Дают избытку диоксида свинца осесть и наблюдают малиновую окраску образовавшейся марганцевой кислоты.
При окислении висмутатом натрия реакцию проводят следующим образом. В пробирку помещают 1—2 капли раствора сульфата марганца (II) и 4 капли 6 моль/л HNO3, добавляют несколько крупинок висмутата натрия и встряхивают. Наблюдают появление малиновой окраски раствора.
4. Сульфид аммония (NH4)2S, прибавленный к раствору солям марганца (II), дает розово- телесный осадок сульфида марганца (II):
Этот осадок растворяется в разбавленных кислотах.
1. Гидроксиды щелочных металлов NaOH, KOH осаждают белый студенистый осадок гидроксида магния:
Mg 2+ + 2 OH — → Mg(OH)2 ↓
в присутствии аммонийных солей осаждение не может быть полным. При высокой концентрации солей аммония осадок Mg(OH)2 может совсем не образовываться, так Mg(OH)2 как растворяется в избытке аммонийных солей:
2. Гидрофосфат натрия Na2HPO4 является характерным реактивом на магний. В растворах солей магния, содержащих хлорид аммония, в присутствии аммиака образуется белый мелкокристаллический осадок аммония- магния — фосфат
Эта реакция — важнейшая качественная реакция на ион является фармакопейной. Реакцию нельзя проводить в присутствии остальных катионов пятой группы.
Гидрофосфат натрия является хорошим реактивом для микрокристаллоскопической реакции. На предметное стекло помещают по одной капле растворов соли магния, аммиака и хлорида аммония. Смешивают эти капли. Рядом с этой смесью помещают 1 каплю раствора Na2HPO4 и соединяют их стеклянной палочкой, потирая по стеклу. Выпавшие кристаллы рассматривают под микроскопом
3. 8-Оксихинолин HC9H6NO. Катионы Mg 2+ с 8-Оксихинолином образуют в аммиачной среде при рН≈8-13 (лучше — при нагревании)
зеленоватожелтый кристаллический осадок оксихинолята магния:
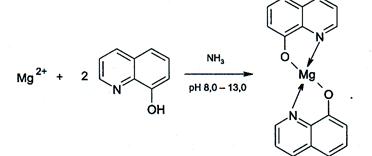
Схема анализа катионов пятой аналитической группы представлена на рисунке 5
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Большая Энциклопедия Нефти и Газа
Обе основные соли висмута применяют в фармакологии при лечении расстройства желудка, воспаления слизистой оболочки кишок и язвы желудка, а также для того, чтобы сделать пищеварительный тракт непрозрачным при рентгеноскопии. [3]
Природа основных солей висмута почти не изучена. [4]
Осадок основных солей висмута переменного состава и гидроокиси висмута в избытке реактива не растворяется. Амидохлорид ( хлористый меркураммоний) ртути растворим в избытке аммонийных солей, концентрированной HNO3 и царской водке. [5]
Осадок основных солей висмута переменного состава и гидроокиси висмута в избытке реактива не растворяется. Амидохлорид ( хлористый меркураммоний) ртути растворим в избытке аммонийных солей, концентрированной HN03 и царской водке. [6]
Осадок основных солей висмута переменного состава и гидроокиси висмута в избытке реактива не растворяется. Амидохлорид ( хлористый меркураммоний) ртути растворим в избытке аммонийных солей, концентрированной HNO3 и царской водке. [7]
Осадок основных солей висмута переменного состава и гидроокиси висмута в избытке реактива не растворяется. Амидохлорид ( хлористый меркураммоний) ртути растворим в избытке аммонийных солей, концентрированной HN03 и царской водке. [8]
При этом основные соли висмута ( также сурьмы и олова, если присутствуют катионы V группы) переходят в раствор. [9]
При этом основные соли висмута ( также сурьмы и олова, если присутствуют ионы V группы) переходят в раствор. [10]
Аммиак осаждает основную соль висмута , состав которой зависит от температуры и концентрации. [11]
К нерастворимым галогенидам относятся основные соли висмута и сурьмы. Кроме того, иодиды BiJ3, AuJ3, HgJ2 нерастворимы в воде, тогда как соответствующие бромиды и хлориды в воде растворяются. [12]
Ни гидроокись, ни основные соли висмута не осаждают в присутствии винной и лимонной кислот, а также глицер. В этих случаях образуются устойчивые растворимые комшш ные соединения. [13]
К нерастворимым галогенидам относятся основные соли висмута и сурьмы. Кроме того, иодиды BiJ3, AuJ3, HgJ2 нерастворимы в воде, тогда как соответствующие бромиды и хлориды в воде растворяются. [14]
При повышении рН образуется малорастворимая основная соль висмута , и раствор обесцвечивается. [15]
Источник: www.ngpedia.ru
Экология СПРАВОЧНИК
Висмут металлический и оксид висмута относятся к малотоксичным соединениям. Нитрат висмута относится к умеренно токсичным веществам. Сульфид висмута обладает слабовыраженным фиброгенным действием. Выявлено отсутствие кожно-резорбтивного действия висмута и его соединений.[ . ]
ПДК висмута и его соединений в воздухе 0,5 мг/м3.[ . ]
Ионы висмута образуют с тиомочевиной окрашенное в желтый цвет комплексное соединение. Оно менее устойчиво, чем комплексное соединение висмута с комплексоном. Поэтому при титровании кислого анализируемого раствора, содержащего комплексон, солью висмута в присутствии тиомочевины раствор остается бесцветным, пока весь комплексон (свободный или соединенный с кальцием и магнием) не перейдет в комплексонат висмута, и лишь тогда следующая капля раствора соли висмута вызовет желтое окрашивание комплекса висмута с тиомочевиной. Можно проводить как прямое, так и обратное титрование.[ . ]
ПДК в водоемах для соединений пятивалентного висмута — ОД мг/л, для соединений трехвалентного висмута — 0,5 мг/л установлены по санитар-но-токсикологическому показателю [0-19].[ . ]
В случае пересчета висмута на его соединения в числитель вводится коэффициент К, равный: на нитрат висмута — 2,32; на оксид висмута— 1,11; на сульфид висмута — 1,23.[ . ]
Сущность метода. Ионы висмута (III) образуют с диэтилдитиокарбаматом натрия (C2H5)2NCS2Na внутрикомплексное соединен ние Bi[(C2H5)2NCS2]3, растворимое в тетрахлориде углерода с образованием окрашенного раствора. Его максимальная оптическая плотность находится при X = 370 нм (е = 8,6-103), но можно проводить измерение и при к = 400 нм, хотя молярный коэффициент поглощения при этом несколько снижается (е =,< = 6,7-103) и чувствительность соответственно падает.[ . ]
Мешающее влияние алюминия, железа, висмута, титана устраняют повторной экстракцией хлороформного экстракта буферным раствором. Влияние органических соединений устраняют окислением азотной кислотой или сплавлением со щелочью. Мешает определению вольфрам при содержании более 0,5 мг.[ . ]
Для получения спектров летучих элементов (мышьяк, сурьма, висмут, селен, теллур и др.) лучше подходят безэлектродные лампы с высокочастотным возбуждением (27 Мгц и выше). Они представляют собой небольшие кварцевые ампулы, заполненные инертным газом и содержащие примерно 10 мг летучего соединения определяемого элемента. Газовый разряд в безэлект-родных лампах происходит в очень тонком слое непосредственно у стенок ампулы (скин-эффект высокочастотного поля).[ . ]
Мешающие влияния. Многие из тяжелых металлов дают с диэтилдитиокарбаминатом соединения, окрашенные или бесцветные. Железо в кислой и нейтральной среде образует буро-черный осадок, но в небольших количествах не реагирует с диэтилдитиокарбаминатом в аммиачном растворе с pH 9 в присутствии цитрата. Мешают определению меди никель, кобальт, висмут, которые образуют в аммиачном растворе соединения, окрашенные соответственно в зеленовато-желтый, бледно-зеленый и желтый цвета, переходящие в органический растворитель, который применяют для экстрагирования. Однако окраска соединений этих металлов значительно слабее окраски соединении меди.[ . ]
Аналогично мышьяковистому водороду сурьмянистый водород образует окрашенные соединения с нитратом серебра, бромидом и хлоридом ртути, нитратом висмута. Обесцвечивает бумажки, обработанные раствором йода и крахмала, восстанавливает молибдат аммония и фосфорномолибденовую кислоту до молибденовой сини.[ . ]
Дополнительную очистку проводят с помощью Ре(ОН)з Предел обнаружения метода (3-5) 10 1 Ки/препарат Измерение активности радионуклидов (114С5, ’ ’ ’Сб, 7С5) проводят на многоканальном у-спектрометре в диапазоне энергий 0-1700 кэВ. Метод применим для определения радиоизотопов Се в морской и пресной воде, в атмосферных осадках, в аэрозольных пробах, а также в пробах биологического происхождения после их соответствующей обработки В водных пробах с низкой удельной активностью необходимо провести предварительное концентрирование цезия.[ . ]
Обожженные концентраты ¡подвергают магнитной сепарации, в процессе которой удаляются соединения железа и вольфрама; удаление примесей висмута, свинца, меди и других металлов достигается путем выщелачивания в кислотах.[ . ]
В первом случае соединение, образуемое реактивом с неионогенными СПАВ, центрифугируют и по высоте осадка судят о содержании неионогенпых СПАВ [43]. По другому варианту полученный осадок выделяют, растворяют в растворе тартрата аммония и определяют висмут фотометрически или потенциометрически с пироллидинтиокарбаматом [44].[ . ]
Сущность метода. Раствор свободного индикатора в кислой среде окрашен в желтый цвет, раствор его комплексного соединения с висмутом — в синий цвет. При прямом титровании раствором соли висмута кислого анализируемого раствора, содержащего ЭДТА, в присутствии индикатора окраска раствора сначала желтая. В конце титрования образуется комплексное соединение висмута с пирокатехиновым фиолетовым: окраска раствора становится сначала фиолетовой, потом синей.[ . ]
Принцип метода. Метод основан на поглощении аллилгорчич-ного масла ледяной уксусной кислотой и взаимодействии его с нитратом висмута и аммиаком. В результате реакции образуется окрашенное соединение, которое определяют колориметрически, по стандартной шкале.[ . ]
Сущность метода. Неионогенные ПАВ в водных растворах образуют с реактивом Дрангендорфа [висмутоиодидом бария Ва (ВН г] нерастворимое в воде соединение, в состав которого входят и висмут, и барий, и иод. Соотношение между этими элементами в молекуле образующегося вещества может колебаться, но всегда в нем на одну молекулу ПАВ приходится один атом висмута.[ . ]
Стиросорбы очень хорошо сорбируют и легко «отдают» сконцентрированные примеси загрязнений, например, могут поглотить из воды не менее 40% содержащихся в ней соединений ртути и саму металлическую ртуть. Предполагается [85], что сорбция ионов ртути обусловлена их комплексооб-разованием с фенильными группами рыхлой полистирольной сетки. Стиросорбы могут сорбировать из воды и другие ионы — серебра, свинца и висмута, но в меньших количествах и не так прочно. Поэтому с известным приближением можно считать эти сорбенты селективными для извлечения ртути.[ . ]
К числу тяжелых металлов относят хром, марганец, железо, кобальт, никель, медь, цинк, галлий, германий, молибден, кадмий, олово, сурьму, теллур, вольфрам, ртуть, таллий, свинец, висмут. Употребляемый иногда термин «токсические элементы» неудачен, так как любые элементы и их соединения могут стать токсичными для живых организмов при определенной концентрации и условиях окружающей среды.[ . ]
Ниже приводятся методы определения общего содержания ЭДТА в сточных водах, свободного и связанного. Методы основаны на том, что в кислой среде (pH = 1—2) комплексонаты кальция и магния малоустойчивы, а висмут образует с ЭДТА очень прочное комплексное соединение, при этом кальций и магний вытесняются из комплексов. Для определения ЭДТА применяют прямое или обратное титрование в присутствии индикатора, по реакции которого устанавливают присутствие или отсутствие ионов висмута в кислой среде, — пирбкатехиновый фиолетовый или тио карбамид.[ . ]
Кроме ламп с полым катодом, в практике атомно-абсорбционного анализа применяют высокочастотные безэлектродные лампы, представляющие собой кварцевый или стеклянный баллон (шарик), в который введены соответствующий металл (или его соединение) и инертный газ, поддерживающий разряд в лампе. Высокочастотные лампы наиболее часто используют для определения тех элементов, для которых лампы с полым катодом не отличаются высокой стабильностью и надежностью в работе. Это — мышьяк, сурьма, висмут, селен, теллур.[ . ]
Максимальной чувствительности и специфичности метода можно добиться с помощью различных химических манипуляций, необходимых для того, чтобы выделить и сконцентрировать пробу, хотя иногда удается одновременно определять несколько соединений. Полярографический метод можно использовать для определения следующих веществ: сурьмы, мышьяка, бензола, висмута, кадмия, хрома, кобальта, меди, формальдегида, свинца, марганца, никеля, окислов азота, таллия, олова, титана, ванадия и цинка. Чувствительность метода позволяет иногда определить до 0,1 ¡лг альдегида в 1 мл раствора.[ . ]
По токсичности, присутствию в современной окружающей среде и вероятности попадания в живые организмы может быть выделена наиболее опасная группа ТМ: свинец, ртуть, кадмий, мышьяк, медь, цинк, хром, никель. Несколько менее опасны таллий, висмут, олово, ванадий, сурьма, марганец, кобальт, молибден и селен. Все эти металлы за исключением указанной выше небольшой группы «биофильных» ТМ по крайней мере по отношению к высшим животным и человеку токсичны. Они попадают в организм с пищей, водой, при вдыхании загрязненного воздуха и, в зависимости от химической формы их соединений с той или иной скоростью, иногда довольно быстро выводятся из организма. Но незначительная их часть задерживается в органах и тканях, вступая в соединение с биогенными элементами и радикалами. Так как эти соединения не участвуют в нормальном обмене веществ и для большинства из них характерны длительные периоды полувы-ведения (от месяцев до десятков лет), происходит постепенное накопление ТМ, ведущее к различным поражениям и тяжелым хроническим заболеваниям (см. п. 8.2).[ . ]
Третий этап ЬСА, анализ улучшения, напрямую следует из итоговой матрицы. Очевидно, уместно сократить использование свинца при монтаже печатных плат там, где это возможно. Во-первых, имеет смысл исследовать ниши альтернативных применений, в которых индий, висмут и проводящие эпоксидные смолы используются в малых объемах. Во-вторых, рекомендуется исследовать новые методы крепления и новые конструкции электронных печатных плат, требующие меньше соединений.[ . ]
Значение 6, =2 для выбрасываемых в атмосферный воздух легко диссоциирующих кислот и щелочей (фтористого водорода, соляной и серной кислоты и т. п.) молекулярного фтора и хлора; 6, = 1,5 для сернистого газа, окислов азота, сероводорода, сероуглерода, озона, хорошо растворимых неорганических соединений фтора; 6; = 1,2 для органических пылей, не содержащих ПАУ и другие опасные соединения (древесной пыли и др.), нетоксичных металлов и их окислов (натрия, магния, калия, кальция, железа, стронция, молибдена, бария, вольфрама, висмута), а также для реактивной органики (альдегидов и т. п.), аммиака, неорганических соединений кремния, плохо растворимых соединений фтора; б, = 1 для прочих соединений (СО, легких углеводородов, ПАУ, токсичных металлов и их окислов и др.).[ . ]
Известны также рН-метры, в которых в качестве измерительного элемента используются металлооксидные электроды. Наибольшее распространение получил сурьмяный электрод. Его целесообразно применять тех случаях, когда стеклянному электроду противопоказан состав контролируемых вод, например при наличии в них соединений фтора (более 30 мг/л) или сильноабразивных частиц.
Диапазон измерения сурьмяного электрода лежит в пределах pH = 1 -ь 13. Точность измерений не превышает ± 0,2 pH. Сурьмяный электрод непригоден для работы в растворах, содержащих ионы с большим потенциалом, чем сурьма, т. е. ионы висмута, свинца, олова и др. Ошибка измерения увеличивается при наличии в измеряемой среде сероводорода, перекиси водорода, сульфитных щелочей и высоких концентраций сернистой, хромовой кислот-и других окислителей и восстановителей.[ . ]
В США, по данным Горного управления, ежегодные по к ганца достигают 700 тыс. т, что соответствует 50% годов., требности страны (цит. по Leclerc, 1962). В Великобрита, ущерб в промышленности и на транспорте исчислен в 115 мль. фунтов стерлингов. Здесь, например, ежегодно теряется 1000 т галлия, 2000 т германия, 2300 тыс. т серы и других ценных материалов. Пылевидные загрязнения обжиговых газов медеплавильных заводов содержат до 15% меди, 50—60% окиси железа, 4% соединений мышьяка, сурьмы, висмута, кадмия, селена, теллура, серебра и других ценных веществ (В. А. Покровский, 1966).[ . ]
Простое экстрагирование, как правило, не приводит к полном чению растворенной ртути, кроме того, вместе с ртутью соэкстра] большое количество других металлов. Поэтому для количественш центрирования ртути тщательно подбирают условия и экстрагир) творенные формы металла, чаще всего в виде комплексных соеди органическими реагентами и красителями. ПО для ртути составил 60 нг/л.[ . ]
Результаты зависят не только от типа теста, но и от метода анализа. Биодеградация должна пройти настолько глубоко, чтобы образовались продукты, приемлемые для окружающей среды (environmentally acceptable). Изучают как первичную, так и полную деградацию ПАВ.
Под первичной подразумевают потерю веществом поверхностной активности, которую определяют, измеряя специфическими методами поверхностное натяжение или устанавливая концентрацию веществ, способных соединяться с метиленовой синью (metylen blue active substances — MBAS),— для АПАВ, и веществ, способных соединяться с висмутом (Bi-active substances—BiAS),— для НПАВ. Весьма приблизительные представления о первичном разложении ПАВ дают наблюдения за потерей ими способности к ценообразованию [302]. О частичном разложении ПАВ до безвредных продуктов судят по поведению живых организмов (дафний, рыб) в исследуемой очищенной воде. Полное разложение поверхно-стно-активных соединений до неорганических веществ оценивают неспецифическими методами, определяя БПК, ХПК, общий органический углерод, выделение ССЪ. Некоторые авторы [452] предлагают судить о разрушении ПАВ по интенсивности роста бактерий-деструкторов на средах с этими веществами.[ . ]
Источник: ru-ecology.info