Изомеры-это вещества одинакового состава, т.е. имеют одинаковую молекулярную формулу, но разную структурную формулу. Это могут быть соединения в пределах одного класса (тогда в названиях будет одинаковый суффикс) либо это могут быть межклассовые изомеры, в случае простых эфиров это одноатомные спирты.
Из предложенных соединениях изомерами будут бутанол-2 и метилпропиловый эфир.
- Установите соответствие между названием вещества и классом (группой) органических соединений, к которому(-ой) оно принадлежит.
3) одноатомный спирт
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| А | Б | В |
Толуол – метилбензол С6H5CH3 ароматический углеводород (арен)
Глицерин – 1,2,3-пропантриол – многоатомный спирт
| А | Б | В |
| 2 | 4 | 1 |
- С каждым из веществ: водой, хлороводородом, водородом — могут реагировать
В ответе укажите два верных вещества.
100-градусный СПИРТ своими руками. @ognennoetv
| 4 | 5 |
- Этанол взаимодействует с
1) оксидом меди(II)
2) гидроксидом калия
4) аммиачным раствором оксида серебра(I)
5) гидроксидом меди(II)
В ответе укажите два верных вещества.
Этанол относится к одноатомным спиртам. Окисляется оксидом меди (II) до этаналя. С бромоводородом вступает в реакцию нуклеофильного замещения.
Ответ:
| 1 | 3 |
1) не имеет запаха
2) относится к вторичным аминам
3) является жидкостью при комнатной температуре
4) реагирует с кислотами
5) является более слабым основанием, чем аммиак
В ответе укажите два верных утверждения.
Амины с низкой молекулярной массой имеют запах и являются газами (при нормальных условиях). CH3-NH-CH3 относится к вторичным аминам. Амины являются производными аммиака и проявляют основные свойства, значит вступают в реакцию с кислотами. Из-за индуктивного эффекта двух метильных групп является более сильным основанием чем аммиак.
| 2 | 4 |
- Из синтез – газа получили 240 г метанола. Сколько литров водорода (н.у.) вступило в реакцию?
Ответ: ___________
По уравнению реакции n(H2) = 2 n(CH3OH) = 15 моль
V(H2) = n(H2) * 22.4 л/моль= 15 моль * 22.4 л/моль= 336 л
Ответ: 336л
веществами Х и Y являются
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
| X | Y |
Получение этаналя из ацетилена – реакция гидратации, значит Х – это вода
Окисление этаналя гидроксидом меди (II) дает уксусную кислоту, в то время как окисление аммиачным раствором оксида серебра дает соль карбоновой кислоты (ацетат аммония)
| X | Y |
| 2 | 4 |
Абсолютный спирт. Химия – Просто
- Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
Б) этилен и бензол
В) метанол и глицерин
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| А | Б | В | Г |
А) Ацетилен и пропилен. Ацетилен может реагировать с аммиачным раствором оксида серебра, а этилен – нет
Б) Этилен и бензол. Бензол несмотря на наличие кратных связей не обесцвечивает бромную воду
В) Метанол и глицерин. Глицерин многоатомный спирт, при реакции со свежеосажденным гидроксидом меди(II) будет давать сине-фиолетовую окраску, а одноатомный спирт метанол – нет.
Г) Фенол (р-р) и этанол. Фенол образует осадок 2,4,6-трибромфенола при реакции с водным раствором брома, а этанол реагировать не будет.
| А | Б | В | Г |
| 4 | 1 | 2 | 1 |
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С2Н6 → С2Н5Сl → С2Н5ОН → СН3СНO → СН3СООН → CH2ClCOOH
При написании уравнений реакций используйте структурные формулы органических веществ.
- При сгорании органического вещества, не содержащего кислород, выделилось 4.48 л углекислого газа, 3.6 г воды и 7.3 г хлороводорода. Определить формулу сгоревшего веществаи напишите уравнение реакции
1.Напишем формулу сгоревшего вещества: CxHyClz.
Найдем количества веществ:
n (CO2) = V / Vm = 4,48 / 22,4л/моль = 0,2моль
n (Н2О) = m / M = 3,6г / 18г/моль = 0,2моль
n(HCl) = m / M = 7.3г / 36,5г/моль = 0.2моль
Найдем количества элементов:
n(С) = n (СО2) = 0,2 моль
n(Н) = 2 ∙ n(Н2О) + n(НСl) = 2 ∙ 0,2 + 0,2 = 0,6 моль
n (Сl) = n(HCl) = 0,2моль
Найдем соотношение индексов:
х : y : z = 0,2 : 0,6 : 0,2 = 2 : 6 : 2 = 1:3:1
Ответ: CH3Cl.
- Из предложенного перечня выберите два вещества, которые являются гомологами уксусного альдегида.
4) уксусная кислота
Гомологи – это вещества, которые относятся к одному классу соединений и различаются на группу –СН2-. Среди перечисленных соединений необходимо выбрать альдегиды. Этаналь и уксусный альдегид – это одно и тоже вещество. Пропаналь и метаналь соответственно гомологи уксусного альдегида. Этанол – одноатомный спирт.
Уксусная кислота – предельная одноосновная кислота.
- Установите соответствие между названием вещества и классом (группой) органических соединений, к которому(-ой) оно принадлежит.
3) одноатомный спирт
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| А | Б | В |
Стирол – винилбензол С6H5CH=СH2 ароматический углеводород (арен)
Изопрен– 2-метил-1,3-бутадиен– алкадиен
Ацетилен HC≡CH алкин
| А | Б | В |
| 2 | 1 | 4 |
- Перманганом калия в кислой среде окисляются:
В ответе укажите два верных вещества.
Пермангатом калия в кислой среде окисляются углеводороды с кратной связью и производные бензола. Сам бензол перманганатом не окисляется. Из представленных соединений этилен и пропин окисляются перманганатом калия в кислой среде.
| 1 | 4 |
- Уксусная кислота взаимодействует с
2) гидроксидом натрия
4) аммиачным раствором оксида серебра(I)
5) гидроксидом меди (II)
В ответе укажите два верных вещества.
Уксусная кислота – карбоновая кислота. Взаимодействует с металлами, стоящими в электрохимическом ряду напряжения металлов до водорода. Как любая кислота взаимодействует с растворами щелочей и оснований.
1) проявляет амфотерные свойства
2) относится к ароматическим аминам
3) является жидкостью при комнатной температуре
4) реагирует с кислотами
5) не имеет оптических изомеров
В ответе укажите два верных утверждения.
Аланин – α-аминокислота, проявляет амфотерные свойства, взаимодействуя как с кислотами, так и с основаниями. В молекуле аланина имеется ассиметричный атом углерода, соответственно молекула аланина имеет оптические изомеры.
| 1 | 4 |
- При гидролизе карбида алюминия выделилось 6,72 л газа (н.у.). Рассчитайте массу карбида алюминия, подвергшегося гидролизу. Ответ: ___________
По уравнению реакции n(Al4C3) = n(CH4) /3 = 0.3 моль/3 =0.1 моль
веществами Х и Y являются
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
| X | Y |
Хлорэтан получается при взаимодействии этанола с хлороводородом. Х- HCl
Получение бутана из хлорэтана – реакция Вюрца (удлинение углеводородной цепочки при взаимодействии галогеналкана с металическим натрием)
| X | Y |
| 2 | 5 |
- Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
Б) ацетилен и бензол
В) фенол и толуол
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| А | Б | В | Г |
А) Уксусную кислоту и этанол можно различить с помощью гидрокарбоната натрия. При взаимодействии с уксусной кислоты с гидрокарбонатом натрия выделяется углекислый газ.
Б) Ацетилен и бензол. Бензол несмотря на наличие кратных связей не обесцвечивает бромную воду
В) Фенол (р-р) и толуол. Фенол образует осадок 2,4,6-трибромфенола при реакции с водным раствором брома, а толуол реагировать не будет.
Г) Этиленгликоль и этанол. Этиленгликоль двухатомный спирт, при реакции со свежеосажденным гидроксидом меди(II) будет давать сине-фиолетовую окраску, а одноатомный спирт этанол – нет.
| А | Б | В | Г |
| 3 | 1 | 1 | 2 |
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СН4 → С2Н2 → СН3СНO → СН3СООН → CH3COONa → CH3CH3
При написании уравнений реакций используйте структурные формулы органических веществ.
- При сгорании органического вещества, не содержащего кислород, выделилось 8.96 л углекислого газа, 18 г воды и 4.48 л азота (н.у.). Определить формулу сгоревшего вещества и напишите уравнение реакциигорения.
Найдем количества веществ:
n (CO2) = V / Vm = 8.96 / 22,4л/моль = 0,4моль
n (Н2О) = m / M = 18г / 18г/моль = 1 моль
n(N2) = V / Vm = 4.48л / 22,4л/моль = 0.2моль
Найдем количества элементов
n(С) = n (СО2) = 0,4 моль
n(Н) = 2 ∙ n(Н2О) = 2 ∙ 1 = 2 моль
Найдем соотношение индексов:
х : y : z = 0,4 : 2 : 0,4 = 1 : 5: 1
Источник: vuz-24.ru
Этиловый спирт не реагирует с аммиачным раствором оксида серебра
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:

Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
| Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. |
Структурная формула альдегидов:

| Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами . |
Структурная формула кетонов:

Химические свойства альдегидов и кетонов
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:


1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.

1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.

| Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. |
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:

1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):

2. Окисление альдегидов и кетонов
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Альдегид → карбоновая кислота
Формальдегид→ муравьиная кислота→ углекислый газ
в торичные спирты → кетоны
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.

| Например, муравьиный альдегид окисляется гидроксидом меди (II) |
HCHO + 2Cu(OH)2 = 2Cu + CO2 + 3H2O
Чаще в этой реакции образуется оксид меди (I):
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).

Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
| Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония |

| Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония |
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:

2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
| Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота |

Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |

2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метаналя: |
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
| Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя |

Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:

Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:

Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
Источник: ollimpia.ru
Химические свойства спиртов

Спирты являются очень слабыми кислотами .Их pKa = 16-18. Однако они гораздо более сильные кислоты, чем ацетилен (рКа= 22) и аммиак (рКа=35). Поэтому легко, при комнатной температуре низшие спирты реагируют с ацетиленидами щелочных металлов и с амидом натрия:
Со щелочами спирты реагируют обратимо. Равновесие сильно смещено в сторону исходных веществ, так как вода значительно более сильная кислота, чем спирты:
В связи с этим при реакциях галогенпроизводных бензола со щелочами, проводимых в спирте, получается больше продукта I, чем II, так как
скорость реакции с метилат –ионом намного выше, чем с гидроксид-ионом, хотя последнего в равновесии больше.
Спирты могут взаимодействовать с очень многими реагентами. Ниже приведены наиболее важные из этих реакций:
Спиртыреагируют с активными металлами:


спирт, содержащий около 4% воды, и кипятят, добавляя йод для активации первой реакции:
Полученный этилат магния самопроизвольно реагирует с водой – обычный гидролиз соли слабого основания и слабой кислоты:

С менее активными металлами, такими как Al, Zn, Fe спирты не реагируют.
Спирты могут реагировать с концентрированными галогеноводородными кислотами в присутствии ZnCl2 (р. Лукаса):



Эти реакции – хороший пример для иллюстрации положения теории А.М.Бутлерова о влиянии строения на химические свойства. Как видно скорость реакции с одним и тем же реагентом в случае третичных спиртов намного выше, чем для вторичных, а те в свою очередь реагируют быстрее первичных.
С кислородсодержащими кислотами спирты реагируют с образованием сложных эфиров этих кислот:



Спирты реагируют с аммиаком. Реакция обратима. Равновесие в ней смещают вправо избытком аммиака в соответствии с принципом Ле-Шателье:


Спирты реагируют с аминами.

Примежмолекулярной дегидратации спиртов образуются простые эфиры:


При дегидратировании в газовой фазе на гетерогенном катализаторе – оксиде алюминия равновесие смещают вправо, понижая давление, так как в реакции из одного моля газа получается два (в соответствии с принципом Ле-Шателье)
При внутримолекулярной дегидратации получаются алкены. В соответствии с правилом Зайцева водород преимущественно отщепляется от менее гидрогенизированного атома углерода из двух соседних с тем атомом углерода, который связан с гидроксилом
Спирты взаимодействуют с непредельными углеводородами:
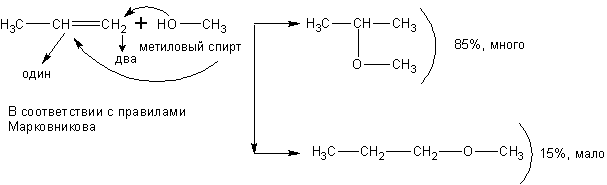

При реакции спиртов с ацетиленом получаются очень важные для синтеза полимеров виниловые эфиры:
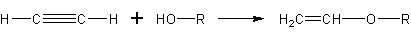
Алкадиены со спиртами так же дают непредельные простые эфиры:

С аренами спирты не реагируют. Они не реагируют также с галогенпроизводными алканов. Однако соли спиртов – алкоголяты реагируют с ними очень легко. В результате реакции получаются простые эфиры (лучший способ получения несимметричных простых эфиров):
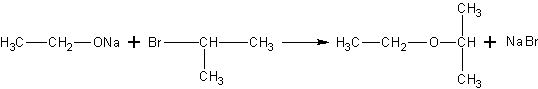

Реакция спиртов с альдегидами (получение полуацеталей).

При реакции спиртов с полуацеталями получаются ацетали:
Полуацетали и ацетали, как правило, обладают хорошим запахом, выделяются из растений и часто служат компонентами парфюмерных композиций.
Реакция спиртов с кетонами аналогична их взаимодействию с полуацеталями, но проходит в более жестких условиях.
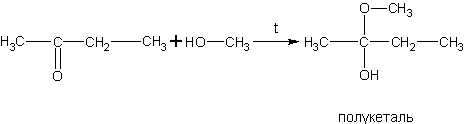

Спиртывзаимодействуют с альдегидами и кетонами по реакции Меервейна – Понндорфа – Верлея, о которой было подробно рассказано в пункте 9 способов получения спиртов. Здесь приведём другой пример этой реакции:

Спирты взаимодействуют также и с карбоновыми кислотами. При этом обратимо получаются сложные эфиры и вода. Процесс называется реакцией этерификации.
Спирты могут взаимодействовать также со сложными эфирами. Получается новый спирт и новый сложный эфир. Реакция носит характер обратимой , катализируется кислотами и называется реакцией переэтерификации спиртом. Она очень широко применяется в синтезах душистых веществ для парфюмерных композиций.

Спирты могут окислятьсяв различных условиях до различных продуктов:
а) При горении:

б) При окислении паров первичных и вторичных спиртов оксидом медиполучаютсясоответственноальдегиды и кетоны,например:

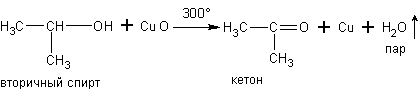
в) При дегидрировании спиртов на катализаторах платиновой группы первичные спирты окисляются до альдегидов, а вторичные — до кетонов:

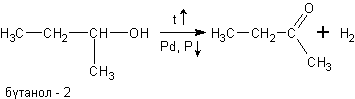
При окислении спиртов в жидкой фазе в кислой среде сильными окислителями, такими как перманганат калия, дихромат калия или висмутат натрия первичные спирты окисляются до карбоновых кислот. Вторичные — до кетонов. Например, этанол до уксусной кислоты:
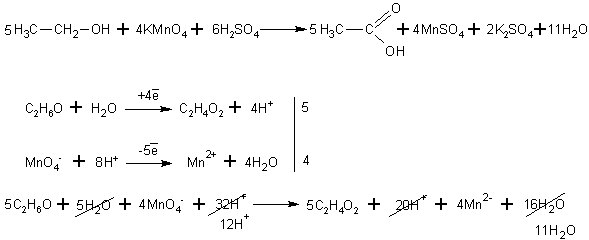
Изопропиловый спирт окисляется до кетона (до пропанона )

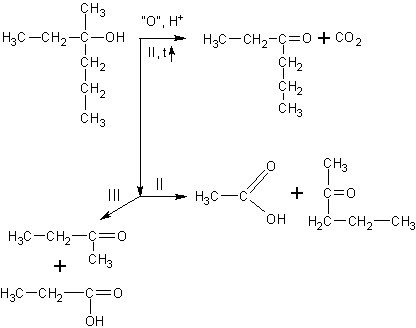
Окисление третичных спиртов идет
только при нагревании с разрывом C-C связи. Получается сложная смесь карбоновых кислот, кетонов и углекислый газ:
Если все алкильные радикалы одинаковы, то реакция может быть уравнена. Ниже приведена реакция окисления третичного спирта – триэтилкарбинола висмутатом натрия в среде разбавленной азотной кислоты:
Источник: megaobuchalka.ru