Введите химическую формулу (вводится с учетом регистра), чтобы рассчитать степень окисления элементов.
Инструкции
Enter the formula of a chemical compound to find the oxidation number of each element. A net ionic charge can be specified at the end of the compound between < and >. For example: ZnCl4 or NH2NH3.
Enter just an element symbol to show the common and uncommon oxidation states of the element.
- Используйте заглавные символы для начального знака элемента и строчные символы для второго знака. Примеры: Fe, Au, Co, Br, C, O, N, F.
- Вы можете использовать круглые () и квадратные скобки [].
Источник: www.chemicalaid.com
Как расставлять и как определить степень окисления элементов
В химических процессах главную роль играют атомы и молекулы, свойства которых определяют исход химических реакций. Одной из важных характеристик атома является окислительное число, которое упрощает метод учета переноса электронов в частице. Как определить степень окисления или формальный заряд частицы и какие правила необходимо знать для этого?
Определение степени окисления в веществах.
- Определение
- Правила определения степени окисления
- Полезное видео: определение степени окисления
- Как определить степень окисления
- Таблица оксидации
- Полезное видео: учимся определять степень окисления по формулам
- Вывод
Определение

Любая химическая реакция обусловлена взаимодействием атомов различных веществ. От характеристик мельчайших частиц зависит процесс реакции и ее результат.
Термин окисление (оксидация) в химии означает реакцию, в ходе которой группа атомов или один из них теряют электроны или приобретают, в случае приобретения реакцию называют «восстановлением».
Степень окисления – это величина, которая измеряется количественно и характеризует перераспределяемые электроны в ходе реакции. Т.е. в процессе оксидации электроны в атоме уменьшаются или увеличиваются, перераспределяясь между другими взаимодействующими частицами, и уровень оксидации показывает, как именно они реорганизуются. Данное понятие тесно связано с электроотрицательностью частиц – их умением притягивать и отталкивать от себя свободные ионы.
Это интересно! Что такое алканы: строение и химические свойства
Определение уровня оксидации зависит от характеристик и свойств конкретного вещества, поэтому нельзя однозначно назвать процедуру вычисления легкой или сложной, но ее результаты помогают условно записать процессы окислительно-восстановительных реакций. Следует понимать, что полученный результат вычислений является результатом учета переноса электронов и не имеет физического смысла, а также не является истинным зарядом ядра.
Как определить степень окисления #shorts
Важно знать! Неорганическая химия часто использует термин валентности вместо степени окисления элементов, это не является ошибкой, но следует учитывать, что второе понятие более универсальное.
Понятия и правила вычислений движения электронов являются основой для классификации химических веществ (номенклатура), описания их свойств и составления формул связи. Но наиболее часто данное понятие используется для описания и работы с окислительно-восстановительными реакциями.
Правила определения степени окисления
Как узнать степень окисления? При работе с окислительно-восстановительными реакциями важно знать, что формальный заряд частицы всегда будет равен величине электрона, выраженного в числовом значении. Эта особенность связана с тем предположением, что электронные пары, образующие связь, всегда полностью смещаются в сторону более отрицательных частиц. Следует понимать, что речь идет об ионных связях, а в случае реакции при ковалентной связи электроны будут делиться поровну между одинаковыми частицами.
Окислительное число может иметь как положительные, так и отрицательные значения. Все дело в том, что в процессе реакции атом должен стать нейтральным, а для этого нужно либо присоединить к иону некое количество электронов, если он положительный, либо отнять их, если он отрицательный. Для обозначения данного понятия при записи формулы обычно прописывают над обозначением элемента арабскую цифру с соответствующим знаком. Например, 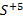 или
или 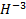 и т.д.
и т.д.
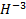
Следует знать, что формальный заряд металлов всегда будет положительным, а в большинстве случаев, чтобы определить его, можно воспользоваться таблицей Менделеева. Существует ряд особенностей, которые необходимо учитывать, чтобы определять показатели правильно.

Как определить степень окисления
- У простых элементов всегда равна нулю:
 или
или  .
. - У фтора всегда будет равна -1.
- Как и у металлов, у элементов из групп IA, IIA и IIIA групп всегда одинаковая – это номер группы, в которой они расположены.
- У кислорода в любой связи равна -2, кроме связей с пероксидами (Н2О2), когда значение равно -1 и оксидом фтора (O+2F2-1, O2+1F2-1), когда она равна +2.
- У водорода всегда +1, кроме его взаимодействия с гидридами (Na+H- и связями по типу C+4H4-1).
- У простого вещества без связей с другими элементами всегда равна нулю.
- У простого иона с одним атомом равна числу его электрона (Na+, Ca+2).
- Если рассматривается связь двух веществ различной природы (металл и неметалл), то отрицательное окислительное число будет наблюдаться у вещества, которое обладает большей электроотрицательностью (H+F-, Cu+Br-), а положительное, соответственно, у элемента с электроотрицательностью больше нуля.
- У щелочных металлов, таких как литий, натрий, калий и прочих, всегда +1.
- У металлов из главной подгруппы II (магний, барий, кальций и стронций) равна +2.
- У алюминия всегда одинаковое значение — +3.
Запомнив эти особенности, достаточно просто будет определять окислительное число у элементов, независимо от сложности и количества уровней атомов.
Полезное видео: определение степени окисления
Как определить степень окисления
Периодическая таблица Менделеева содержит почти всю необходимую информацию для работы с химическими элементами. Например, школьники используют только ее для описания химических реакций. Так, чтобы определить максимальные положительные и отрицательные значения окислительного числа необходимо свериться с обозначением химического элемента в таблице:
- Максимально положительное – это номер группы, в которой находится элемент.
- Максимально отрицательная степень окисления – это разница между максимально положительной границей и числом 8.
Таким образом, достаточно просто узнать крайние границы формального заряда того или иного элемента. Такое действие можно совершить с помощью вычислений на основе таблицы Менделеева.
Важно знать! У одного элемента могут быть одновременно несколько различных показателей оксидации.
Различают два основных способа определения уровня оксидации, примеры которых представлены ниже. Первый из них – это способ, который требует знаний и умений применять законы химии. Как расставлять степени окисления с помощью этого способа?

Правило определения степеней окисления
Для этого необходимо:
- Определить, является ли данное вещество элементарным и находится ли оно вне связи. Если да, то его окислительное число будет равно 0, независимо от состава вещества (отдельные атомы или многоуровневые атомные соединения).
- Определить, состоит ли рассматриваемое вещество из ионов. Если да, то степень оксидации будет равна их заряду.
- Если рассматриваемое вещество металл, то посмотреть на показатели других веществ в формуле и вычислить показания металла путем арифметических действий.
- Если все соединение имеет один заряд (по сути это сумма всех частиц представленных элементов), то достаточно определить показатели простых веществ, затем вычесть их от общей суммы и получить данные металла.
- Если связь нейтральная, то общая сумма должна быть равна нулю.
Это интересно! Уроки химии: что это такое галогены

Для примера можно рассмотреть объединение с ионом алюминия, чей общий заряд равен нулю. Правила химии подтверждают тот факт, что ион Cl имеет окислительное число -1, а в данном случае их три в соединении. Значит ион Al должен быть равен +3, чтобы все соединение было нейтральным.
Этот способ весьма хорош, поскольку правильность решения всегда можно проверить, если сложить все уровни оксидации вместе.
Второй метод можно применять без знания химических законов:
- Найти данные частиц, по отношению к которым нет строгих правил и точное количество их электронов неизвестно (можно путем исключения).
- Выяснить показатели всех прочих частиц и после из общей суммы путем вычитания найти нужную частицу.
Рассмотрим второй метод на примере вещества Na2SO4, в котором не определен атом серы S, известно лишь, что он отличен от нуля.
Это интересно! Уроки химии: катионы и анионы – что это такое
Чтобы найти, чему равны все степени окисления необходимо:
- Найти известные элементы, помня о традиционных правилах и исключениях.
- Ион Na = +1, а каждый кислород = -2.
- Умножить количество частиц каждого вещества на их электроны и получить степени оксидации всех атомов, кроме одного.
- В Na2SO4 состоят 2 натрия и 4 кислорода, при умножении получается: 2 X +1 = 2 – это окислительное число всех частиц натрия и 4 X -2 = -8 – кислородов.
- Сложить полученные результаты 2+(-8) =-6 – это общий заряд соединения без частицы серы.
- Представить химическую запись в виде уравнения: сумма известных данных + неизвестное число = общий заряд.
- Na2SO4 представлено следующим образом: -6 + S = 0, S = 0 + 6, S = 6.
Таким образом, чтобы использовать второй метод, достаточно знать простые законы арифметики.

Таблица оксидации
Для простоты работы и вычисления показателей оксидации для каждого химического вещества используют специальные таблицы, где прописаны все данные.
Она выглядит следующим образом:

Полезное видео: учимся определять степень окисления по формулам
Вывод
Нахождение степени окисления для химического вещества – это простое действие, которое требует лишь внимательности и знания основных правил и исключений. Зная исключения и пользуясь специальными таблицами, это действие не будет занимать много времени.
Источник: znaniya.guru
Степени окисления элементов. Как найти степени окисления?
Чтобы правильно расставлять степени окисления , необходимо держать в голове четыре правила.
1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na 0 , H 0 2 , P 0 4 .
2) Следует запомнить элементы, для которых характерны постоянные степени окисления . Все они перечислены в таблице.
| Элемент | Характерная степень окисления | Исключения |
| H | +1 | Гидриды металлов: LIH -1 |
| F | -1 | F 2 |
| O | -2 | F 2 O +2 ; пероксиды, надпероксиды, озониды |
| Li, Na, K, Rb, Cs, Fr | +1 | nbsp |
| Al | +3 | #x2022 (+1) = 0. Решение очевидно: х = -3. Ответ: N -3 H 3 +1 .
Пример 2 . Укажите степени окисления всех атомов в молекуле H 2 SO 4 . Решение . Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2 #x2022 (-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H +1 2 S +6 O -2 4 . Пример 3 . Рассчитайте степени окисления всех элементов в молекуле Al(NO 3 ) 3 . Решение . Алгоритм остается неизменным. В состав «молекулы» нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1 #x2022 (-2) = 0. Ответ: Al +3 (N +5 O -2 3 ) 3 . Пример 4 . Определите степени окисления всех атомов в ионе (AsO 4 ) 3- . Решение . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4 молекулу», а как объединение двух ионов: NH 4 + и SO 4 2- . Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N -3 H 4 +1 ) 2 S +6 O 4 -2 . Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте «разделить» молекулу на несколько частей. Как расставлять степени окисления в органических соединенияхПример 6 . Укажите степени окисления всех элементов в CH 3 CH 2 OH. Решение . Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы. Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность С превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3. Атом С в составе группы -СН 2 ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1. Ответ: С -3 H +1 3 C -1 H +1 2 O -2 H +1 . Не смешивайте понятия «валентность» и «степень окисления»!Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
Степень окисления (точнее, ее модуль) часто численно равен валентности, но еще чаще эти величины НЕ совпадают. Например, степень окисления углерода в CO 2 равна +4; валентность С также равна IV. А вот в метаноле (CH 3 OH) валентность углерода остается той же, а степень окисления С равна -1. Небольшой тест на тему «Степень окисления»Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов! Для желающих еще немного потренироваться рекомендую соответствующий тематический тест. Источник: www.repetitor2000.ru
Загрузка ...
|