Стеклянным электродом условно называется система, в состав которой входят стеклянный корпус с горловиной, на конце которой напаян шарик (мембрана) из специального электропроводного стекла, в котором мигрируют ионы Na + или Li + , стандартный внутренний раствор электролита и токоотвод. Стандартным внутренним раствором служит 0,1 М раствор НСl (иногда с добавками КС1 или NСl) или буферный раствор с добавками хлоридов или бромидов.
Токоотводом является стержень серебра, покрытый хлоридом серебра. К стержню припаивают изолированный экранированный и заземленный медный провод.
В системе возникают два внутренних скачка потенциала: один, характерный для хлорсеребряного электрода: Ag, Ag С1| С1, другой – на границе стеклянной мембраны с внутренним стандартным раствором. Сумма этих скачков потенциала при измерениях рН остается постоянной, так как состав и концентрация внутреннего раствора не меняется. При погружении стеклянного электрода в раствор с неизвестным рН (внешний раствор) в поверхностный слой электродного стекла проникают ионы Н + , вытесняя содержащиеся в стекле ионы щелочного металла. Когда электрохимические потенциалы ионов в стекле и в растворе станут одинаковыми и наступит равновесие, ионы Н + окажутся распределенными между стеклом и раствором так, что поверхности фаз приобретут двойной электрический слой и разность потенциалов (скачок потенциала), зависящую от концентрации (активности) ионов Н + во внешнем растворе, что и позволяет использовать стеклянный электрод для определения рН растворов.
Стеклянные электроды
По принципу действия стеклянный электрод относится к мембранным электродам. Разность потенциалов, возникающая по разные стороны мембраны, зависит от отношения активностей ионов Н + в растворах по одну и по другую стороны мембраны. Если концентрация Н + во внутреннем растворе сохраняется постоянной, то потенциал стеклянного электрода ( .) определяется только активностью ионов Н + во внешнем растворе (
.) определяется только активностью ионов Н + во внешнем растворе ( ) :
) :


где — стандартный для данного стеклянного электрода потенциал.
Стеклянный электрод обладает рядом преимуществ по сравнению с другими электродами, пригодными для определения рН. При его использовании не нужно вводить в раствор дополнительно какие–либо вещества (например, водород, в случае водородного электрода, или хингидрон – в случае хингидронного), не опасны окислители, восстановители, поверхностно-активные вещества, другие ионы. Потенциал устанавливается сравнительно быстро. Электрод надежен и прост в обращении.
В качестве электрода сравнения, т. е. электрода, относительно которого определяется потенциал индикаторного электрода, могут быть мспользованы различные электроды. Основное требование, предъявляемое к ним – постоянство потенциала во всех измеряемых растворах.
Стеклянный электрод своими руками
Хлорсеребряный электрод.
Хлорсеребряный электрод представляет собой серебряный электрод, покрытый слоем труднорастворимого хлорида серебра и погруженный в насыщенный раствор хлорида серебра и хлорида калия.
Электрохимическая схема хлорсеребряного электрода:

Но так как активность ионов металла () в растворе его труднорастворимой соли в присутствии соли, содержащей тот же анион, ничтожно мала, ее обыкновенно не включают в электрохимическую схему электрода:
На электроде протекает электрохимический процесс
в соответствии с которым

(1)
Однако в насыщенном растворе труднорастворимого AgCl существует равновесие:
поэтому произведение активностей ионов Ag + и С1 – является константой при постоянной температуре

Подставляя значение активностей ионов Ag + , выраженное через произведение растворимости (LAgCl), в уравнение (1), имеем:

(2)
В полученном уравнении (2) два первых слагаемых есть величина постоянная, которая представляет собой стандартный электродный потенциал хлорсеребряного электрода, т. е. потенциал при активности ионов хлора в растворе, равной 1:

Подставив в это уравнение значение электродного потенциала серебряного электрода Ag+|Ag и произведения растворимости хлорида серебра LAgC1 при t = 25°С, получим значение стандартного электродного потенциала хлорсеребряного электрода:

Следовательно, уравнение, определяющее электродный потенциал хлорсеребряного электрода:

Если при изготовлении хлорсеребряного электрода используют насыщенный раствор хлорида калия, то в соответствии с при t = 25°С электродный потенциал

В данной работе используется гальванический элемент, образованный стеклянным и насыщенным хлорсеребряным электродом.
Потенциометрическое титрование основано на резком изменении потенциала электрода, обратимого по отношению к ионам титруемого вещества, в момент достижения точки эквивалентности.
В основе метода потенциометрического титрования могут лежать реакции осаждения, комплексообразования, окисления и восстановления, а также ацидиметрия и алкалиметрия.
Во всех этих реакциях вблизи точки эквивалентности концентрация титруемого вещества резко уменьшается, а концентрация реагента резко увеличивается.
Для выяснения принципов потенциометрического титрования мы можем пренебречь разницей между активностью и концентрацией и в уравнениях для электродных потенциалов заменить активность концентрацией. Данные, которые мы при этом получим, не будут точными, но они будут правильно передавать характер изменения потенциалов в процессе титрования и правильно указывать положение конечной точки титрования.
Численные значения констант равновесия, вычисляемых на основании полученных данных, также не будут точными. Ошибка в величине констант будет зависеть от ионной силы раствора. Определенные таким образом константы (Кс)принято называть «концентрационными». Истинные константы представляют предел, к которому стремятся концентрационные константы при уменьшении ионной силы растворов до нуля.
Уравнение для потенциала можно тогда написать следующим образом:

,
где с – концентрация электромоторноактивного иона.
Уравнение лежит в основе теории потенциометрического титрования.
Таким образом, резкому изменению концентрации ионов при титровании отвечает резкое изменение потенциала электрода, обратимого по отношению к ионам титруемого вещества или реагента.
Воспользуйтесь поиском по сайту:

studopedia.org — Студопедия.Орг — 2014-2023 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.006 с) .
Источник: studopedia.org
Классификация электродов

Электроды в зависимости от устройства и типа, протекающих в них реакций делятся на электроды: первого, второго и третьего рода.
Электроды первого рода
Электродами первого рода называются электроды состоящие из металла, опущенного в раствор своей хорошо растворимой соли:
К электродам первого рода в качестве исключения относятся водородный электрод, его устройство отличается от электродов первого рода. К ним он относится только по типу реакции:

2Н + + 2е Н2.
Замечательным достоинством НВЭ является то, что его потенциал равен 0 В, т.е. получается, что измеряемая ЭДС по величине равна электродному потенциалу изучаемого электрода.
Потенциал электрода, погруженного в раствор соответствующей соли с активностью ионов 1 моль-ион/л, измеренный относительно НВЭ, называется нормальным электродным потенциалом.
Нормальный водородный электрод
Он представляет собой платиновую пластинку, покрытую платиновой чернью, опущенную в раствор серной кислоты с активностью ионов водорода [H + ] = 1 моль-ион/л. Через раствор пропускают водород при этом он в большом количестве поглощается платиновой чернью, которой покрыт платиновый электрод. В результате этого поверхность пластины покрыта большим количеством водорода.
Равновесный электродный потенциал устанавливается на границе: газообразный водород на платиновой пластине и ионы водорода в растворе.
Схема водородного электрода записывается:

Pt(H2) | H + .
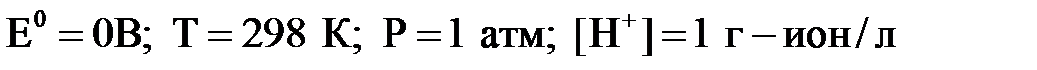
При эксплуатации НВЭ возникает ряд проблем:
1. Проблема получения водорода.
2. Проблема поддержания давления водорода постоянным Р(Н2) = 1 атм.
3. Большое усложнение установки (выпрямитель, устройство для электролиза NaOH, очистка водорода от примесей).
Электроды второго рода
Электродом II рода называется электрод, представляющий собой металл, покрытый слоем своей трудно растворимой соли, содержащей одноименный анион и обратимый вокруг этого аниона. Примерами электродов II рода могут служить каломельный и хлорсеребряный электроды.
Каломельный электрод состоит из металлической ртути и раствора KCl, насыщенного относительно каломели:
При работе каломельного электрода протекает следующая реакция:

2Hg 0 + 2Cl — Hg2Cl2 + 2e.
Каломельный электрод промышленного изготовления представляет собой стеклянную трубку с шариком на конце, заполненную ртутью (1), и каломелью (2). Трубка заполнена раствором хлорида калия (3). Соединение с другим раствором осуществляется через капилляр (солевой мостик) (4). В нижнюю часть шарика впаяна платиновая проволока (5) для контакта.
Каломель готовят истиранием в агатовой ступке металлической ртути с кристаллами KCl в присутствии нескольких капель воды. В результате получается серая пастообразная масса – каломель.
Раствор KCl используется виде трех концентраций: 1н; 0,1н; насыщенный.
Потенциал КЭ при постоянных условиях является очень стабильным, однако потенциалы сильно разняться в зависимости от концентрации раствора и температуры.
В качестве электрода используют Pt с другим электродом. КЭ соединяется с помощью полунепроницаемой перегородке.
+ очень устойчив в работе; долго держит постоянный потенциал;
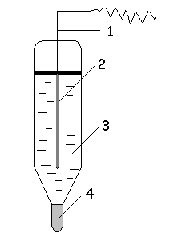
Хлорсеребряный электрод в настоящее время является более распространенным электродом.
Хлорсеребряный электрод представляет собой стеклянную трубку, внутри которой помещена серебряная проволочка (1), покрытая плохо растворимой солью хлорида серебра AgCl (2), погруженная в насыщенный раствор хлорида калия (3). Солевой мостик представлен узким отверстием, заполненным асбестом (4).
Хлорсеребряные электроды входят в комплекты многих лабораторных измерительных приборов, выпускаются промышленностью, каждый электрод имеет свой паспорт, где указывается его потенциал.
В среднем потенциал хлорсеребряного электрода равен, Ехс = 0,222 В.
Записывается хлорсеребряный потенциал, следующим образом:
При его работе осуществляется следующая реакция:
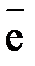
Ag o + Cl — ® AgCl + .
Потенциал хлорсеребряного электрода можно вывести из уравнения Нернста для электродов I рода:
Exc = E o + 0,059 lg[Ag + ].
Так как хлорид серебра является малорастворимой солью, то концентрацию ионов серебра для реакции: AgCl ↔ Ag + +Cl — , можно вычислить из произведения растворимости соли: ПР = [Ag + ] [Cl — ].
Отсюда находим концентрацию ионов серебра:
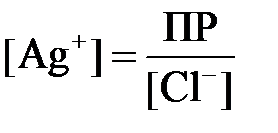
Подставляем полученное значение в уравнение Нернста:
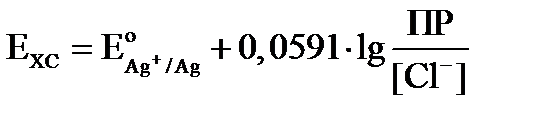
Расписываем логарифм частного как разность логарифмов:

Величина 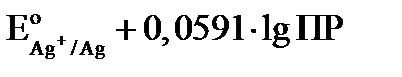 и обозначим её как
и обозначим её как 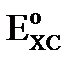 , тогда уравнение Нернста для электродов II рода имеет вид:
, тогда уравнение Нернста для электродов II рода имеет вид:
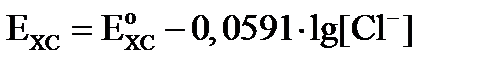
(9)
Хлорсеребряный электрод в настоящее время является самым распространенным электродом, так как обладает следующими достоинствами:
1. держит постоянный потенциал в течение очень длительного времени,
2. механически устойчив,
3. не капризен в работе,
4. работает в среде окислителей и восстановителей,
5. может применяться в реакциях нейтрализации, осаждения, комплексообразования, окисления-восстановления.
К его недостаткам можно отнести погрешности, возникающие в случае, если анализируемый раствор содержит ионы Cl — и (или) Ag + .
Источник: megaobuchalka.ru
Хлоридсеребряный электрод

Представляет собой серебряную пластинку или проволоку, покрытую слоем малорастворимого хлорида серебра, контактирующую с раствором содержащим хлорид ионы (чаще всего раствором хлорида калия).
Схематически записывается как: Ag(тв.), AgCl(тв.) | КCl (водн.) ┊ исследуемый раствор.
Это электрод второго рода, потенциал которого определяется концентрацией аниона хлорида в равновесии:
Ag + Cl − ↔ AgCl + е
Стандартный электродный потенциал всегда определяется при эффективной концентрации растворимых компонентов системы 1 Моль/кг растворителя, что для хлоридсеребряного электрода соответствует одномолярному раствору хлорида калия и при температуре 25° равен Eo ХСЭ = 0.22234 В (относительно стандартного водородного электрода). [1] .
В области температур 0-95 °С стандартный потенциал хлорсеребряного электрода описывается уравнением:
Еo ХСЭ = 0,23655 — 4,8564 × 10 −4 t — 3,4205 × 10 −6 t 2 + 5,869 × 10 −9 t 3
Воспроизводимость значений потенциалов ± 0,2 мВ; при низких температурах (15 °С) может быть достигнута воспроизводимость ± 0,05 мВ.
Значения стандартных потенциалов хлорсеребряного электрода при различных температурах:
В лабораторной практике обычно используется насыщенный хлоридсеребряный электрод, объём которого заполняют насыщенным раствором KCl, концентрация которого, хотя и отличается от стандартной одномоляльной, является достаточно стабильной для определённой температуры и может быть проконтролирована визуально (по наличию кристаллов нерастворенной соли, подтверждающей насыщенность раствора). Как правило, потенциал насыщенного хлорсеребряного электрода оказывается в интервале 0,197-0,202 В при комнатной температуре и указывается производителями электродов сравнения в документации к изделиям. Например.
Хлоридсеребряные электроды в отдельных случаях могут быть заполнены растворами хлоридов с другими концентрациями. Например, можно использовать менее концентрированные растворы хлоридов, близкие к концентрации этого иона в исследуемой среде (чтобы снизить вероятность проникновение концентрированного раствора из электрода). Также возможно заполнять электрод раствором HCl вместо KCl — там где критично попадание иона K + в рабочую среду.В этих случаях нужно обеспечить поддержание точного значения этой концентрации в процессе функционирования электрода, а его потенциал рассчитать по Уравнению Нернста с учетом активности (a) выбранного раствора хлорида:
Либо потенциал такого «нестандартного» электрода всегда можно (и нужно) контролировать, составив пару с любым стандартным электродом сравнения, потенциал которого достоверно известен.
Источник: wiki2.org