Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц. У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Физика 9 класс. Состав атомного ядра. Ядерные силы
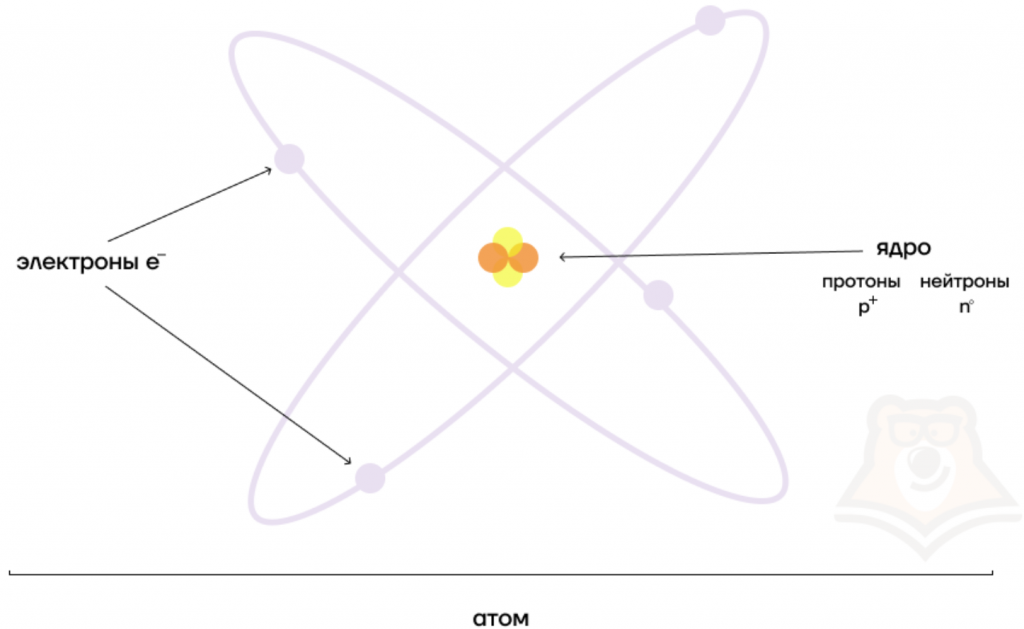
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
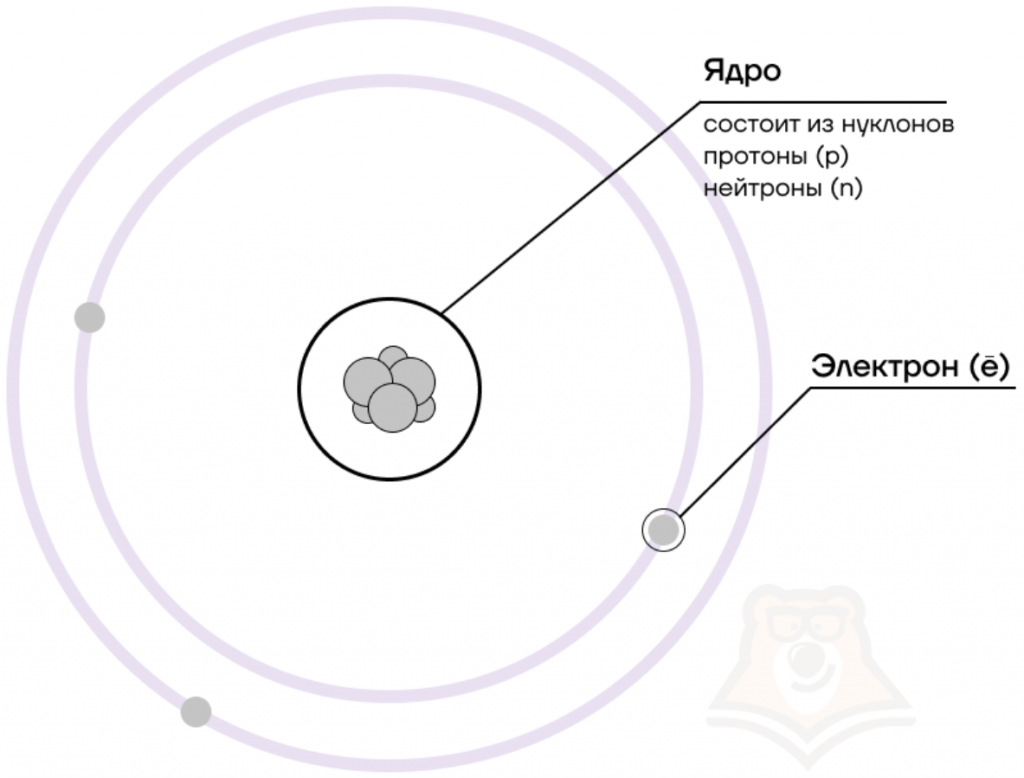
| Чем атом похож на Солнечную систему? Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. |
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:

Характеристика элементарных частиц
Из таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.

Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
(№ элемента = p = Z = ē)
Число нейтронов = массовое число – порядковый номер
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.

На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.

Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
Проскок электрона
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d 9 4s 2 . Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d 10 4s 11

| Итог: иметь конфигурации nd 5 и nd 10 более энергетически выгодно, чем nd 4 и nd 9 . Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
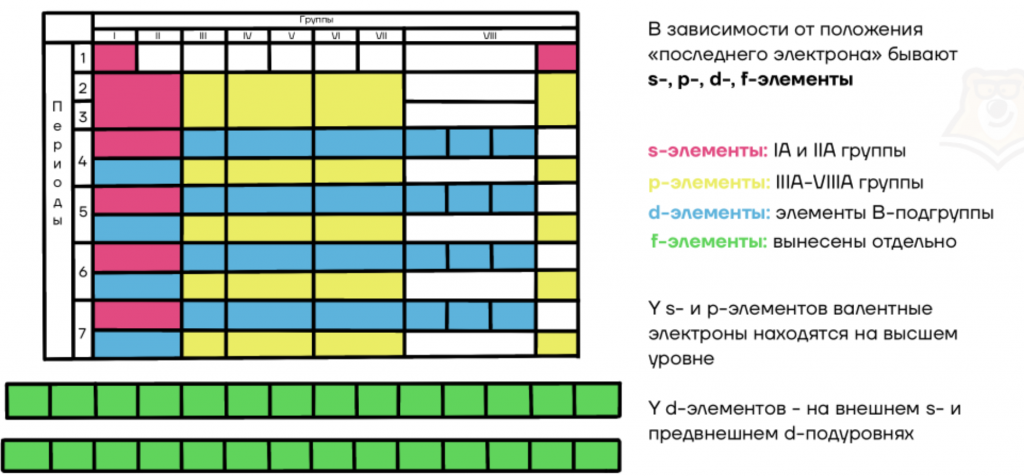
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.
Проверь себя
Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
Источник: umschool.net
64. Строение атома. Состав ядра атома. Изотопы
1640.
Размеры атома превышают размер ядра примерно в 10 -10/10 -15=10 5 раз.1641.
Атом алюминия содержит 13 электронов; меди — 29 электронов; железа — 26 электронов; серебра — 47 электронов.
1642.
Заряд атомного ядра равен номеру элемента в таблице Менделеева.
1) N: 7; 2) Аu: 79; 3) Со: 27; 4) Ge: 32.
1643.
Поглощает.
1644.
При столкновениях электронов с ионами решетки ионы начинают колебаться около своих положений равновесия. При достижении определенной частоты этих колебаний они начинают излучать видимый свет.

1646.
После удаления части электронов число положительно заряженных частиц стало превышать число отрицательно заряженных, и поэтому образовавшийся ион приобрел положительный заряд.
1647.
Заряд однократно ионизированного атома гелия равен -1.

1649.
Может, если атом примет на одну из своих орбиталей электрон.

1651.
Потому что работа выхода А у таких металлов достаточно мала.

1653.
Протон является ядром водорода.



1657.
Нейронов.
1658.
а) азот N; б) аргон Ag; в) мышьяк As; г) полоний Ро.
Источник: kupuk.net
Строение ядра атома серебра
С помощью данного урока вы узнаете, из чего состоит атом, а также познакомитесь с историей появления и развития представлений о сложном строении атома. На уроке рассматриваются результаты некоторых физических опытов, которые позволили установить состав и строение атома.
I. Атом: термин и эволюция понятия
Идея о том, что все вещества состоят из мелких, невидимых частиц возникла у людей еще до нашей эры в Древней Индии и Древней Греции. Известный греческий философ Демокрит, будучи одним из первых материалистов, впервые ввел термин «атом» (от греч.atomos- неделимый). Последователь идей Демокрита, Эпикур (341-270 г. до н.э.) впервые высказал предположение об атомном весе.


Согласно его теории атом — неделимая частица, которая существует вечно. По теории Демокрита:

- все тела состоят из бесчисленного количества сверхмалых, невидимых глазом, неделимых частиц-атомов;
- атомы непрерывно двигаются в пустоте;
- атомы никто не создавал, они были всегда;
- никто не может уничтожить атомы;
- атомы материальны: имеют вес, размеры, форму;
- одни атомы имеют крючочки, другие петельки с помощью которых соединяются друг с другом.
Дальнейшее развитие атомизм, как теория, получил в философии и науке Средних веков и Нового времени. В середине XVII в. французский философ и физик Пьер Гассенди (1592—1655) заново пересказал учение Демокрита и Эпикура, дополнив его новым понятием «молекула» для обозначения различного сочетания атомов друг с другом.

Р. Бойль (1627-1691 г.г.) написал знаменитую книгу «Химик-скептик», в которой доказал нереальность «начал» Аристотеля и ввел представление о химических элементах как о веществах, не поддающихся дальнейшему разложению. Определив задачей химии изучение элементов и их соединений. Р. Бойль поставил ее на научную основу.
Далее атомистическая теория получила свое логическое развитие в работах Ломоносова, Лавуазье, Дальтона и оформилась в атомно-молекулярное учение.
II. Модель Дж. Томсона («сливовый пудинг» или «булочка с изюмом»). Открытие электрона
До 1897 г атом считался мельчайшей неделимой частицей (элементарной). Именно этот год считается датой открытия электрона, первой субатомной частицы. Во второй половине 19 в. многие физики занимались исследованием так называемых «катодных лучей» — лучей, исходящих с поверхности катода при пропускании электрического разряда между катодом и анодом в стеклянной трубке с сильно разреженным газом.

В своих опытах по отклонению катодных лучей в электрических и магнитных полях, Томсон убедительно показал, что эти лучи представляют собой поток заряженных частиц, а самое главное, ему удалось измерить удельный заряд (e/m) этих частиц. (Он оказался примерно в 2000 раз меньше удельного заряда иона водорода, известного из опытов по электролизу.) Томсон сразу же предположил, что электроны входят в состав атомов – откуда еще им было взяться? Дальнейшие работы ученых-физиков подтвердили это предположение. Таким образом, к концу 19 века электрон считался элементарной заряженной частицей, масса которой в 2000 раз меньше массы атома водорода.
После открытия электрона Томпсон предложил модель строения атома, которую обычно называют «сливовый пудинг» (или «пудинг с изюмом») или на русский манер «булочка с изюмом». Согласно Томпсону атом представляет собой положительно заряженную сферу, в которую вкраплены (как изюм в булочке) отрицательно заряженные электроны. Однако, эта модель была опровергнута опытом Резерфорда.

Так появилась одна из первых моделей строения атома, которую предложил английский физик Джозеф Томсон (Рис. 1). В соответствии с этой моделью, атом представляет собой шар, состоящий из положительно заряженного вещества с вкраплениями отрицательно заряженных электронов (наподобие изюма в бисквите).

Рис. 1. Модель строения атома, предложенная Дж. Томсоном
Особенность модели Томсона заключалась в предположении того, что положительный заряд «размыт» внутри атома и не «вылетает» из него, т. к. обладает значительно большей массой по сравнению с электронами.
Следующим удивительным экспериментальным фактом было открытие Беккерелем в 1896 г. явления радиоактивности. Было обнаружено, что атомы некоторых элементов самопроизвольно распадаются с образованием новых атомов, электронов и α-частиц. Также установили, что α-частицы имеют положительный заряд и относительно большую массу.
В 1911 г англ. учёный Э. Резерфорд доказал нa опыте, что в центре атома имеется положительно заряженное ядро.

С помощью α-частиц Эрнест Резерфорд и его ученики провели эксперимент, результаты которого опровергли модель строения атома Дж. Томсона. Англичанин Эрнест Резерфорд и его ученики поставили следующий эксперимент: направляли быстрый поток α-частиц на тонкую золотую фольгу. Оказалось, что большинство α-частиц проходит через фольгу беспрепятственно, небольшая часть отклоняется на различные углы, а примерно 1 на 10 000 частиц отскакивает в обратном направлении (Рис. 2).

Рис. 2. Схема опыта Э. Резерфорда
Результаты опыта противоречили модели Томсона. Частица с большой массой и положительным зарядом может отскочить назад, если только встретит в качестве препятствия большой положительный заряд, сконцентрированный в одном месте.
Положительный заряд, сконцентрированный в центре атома, Резерфорд назвал ядром и предложил свою модель строения атома: в центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны (Рис.3). При этом основная масса атома сосредоточена в ядре, масса электронов очень мала.
Суммарный заряд ядра и электронов должен быть равен нулю, т. к. атом в целом электронейтрален.
Модель Резерфорда напоминает Солнечную систему, поэтому ее назвали «планетарной».

Рис. 3. Планетарная модель атома, предложенная Резерфордом
III. Модель Бора (планетарная модель)
В 1913 Нильсом Бором была предложена модель строения атома, известная как «планетарная модель». По Бору электроны вращаются по орбитам расположены на строго определенном удалении от атомного ядра, точно также как планеты Солнечной системы вращаются вокруг солнца (отсюда и название модели). Эти орбиты (сейчас всем известны как энергетические уровни)- стационарные и вне их электрон существовать не может. К сожалению, объяснить это утверждение Бору на тот момент не удалось. Кроме того, предложенная модель Бора противоречила законам физики:
В начале прошлого века на смену планетарной модели строения атома пришла волновая модель, которая разрешила возникшие противоречия и на сегодняшний момент считается общепринятой.
Современное представление о строении атома было бы невозможно без открытия явления радиоактивности, элементарных частиц (электрона, протона и нейтрона). Решающий вклад в установлении строения атома внесли Дальтон, Дж.Дж. Томпсон (или Томсон), Э. Резерфорд, Н. Бор, Э. Шредингер, М. Планк, Люис, Паули.
История развития представлений о строении атома условно изображена на схеме ниже:

IV. Современное строение атома
Атом — электронейтрален, то есть количество положительно заряженных частиц в нем равно количеству отрицательно заряженных частиц.
Долгое время считалось, что протоны и нейтроны являются элементарными (то есть неделимыми) частицами. Но на сегодняшний момент признано, что они имеют сложное строение и состоят из кварков. Электрон же до сих пор считается элементарной частицей. Положительно и нейтрально заряженные частицы (протоны и нейтроны, соответственно) сосредоточены в ядре, чья масса составляет около 99,97% от массы атома. Радиус атома, как правило, составляет несколько ангстрем (10−10 м), радиус ядра в 10 000 раз меньше радиуса атома.
Ядро — самая тяжелая и самая маленькая часть атома.

Заряд ядра равен порядковому номеру химического элемента
Из курса физики вам известно, что вокруг положительного ядра находятся отрицательно заряженные частицы электроны — е — . В электронейтральном атоме число электронов должно быть равно заряду ядра и, следовательно, порядковому номеру элемента. Масса электрона очень мала и принимается равной нулю, таким образом, масса атома сосредоточена в ядре, в котором расположены протоны – p + и нейтроны – n 0 .

Заряд ядра атома = Порядковому номеру = Числу протонов = Число электронов
Число нейтронов = Атомная масса (Ar) – Порядковый номер
Например, определите состав атома бора?

- Изотопы хлора
- Изотопы природного водорода: Протий 1 1 H, Дейтерий 1 2 Н, Тритий 1 3 Н
- Модели изотопов водорода
Изотопы одного и того же химического элемента имеют разную массу, так как в ядрах содержится разное количество нейтронов.
Какое количество электронов, протонов и нейтронов содержится в изотопах углерода 12 и 13?

Для изотопа углерода 12:
Z→6 A→12 C , порядковый номер N=6, массовое число A=12
N(n 0 ) = A — Z = 12 — 6 = 6
Углерод-12 содержит 6 электронов, 6 протонов и 6 нейтронов
Для изотопа углерода 13:
Z→6 A→13 C, порядковый номер N=6, массовое число A=13
N(n 0 ) = A — Z = 13 — 6 = 7
Углерод-13 содержит 6 электронов, 6 протонов и 7 нейтронов
V. Химический элемент
Химический элемент – это вид атомов с одинаковым зарядом ядра.
В природе химические элементы существуют в виде смесей изотопов. Изотопный состав одного и того же химического элемента выражают в атомных долях (ωат.), которые указывают какую часть составляет число атомов данного изотопа от общего числа атомов всех изотопов данного элемента, принятого за единицу или 100%.
В таблице Менделеева приведены средние значения относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными.
Ar средняя= ωат.(1) ∙ Ar(1) + … + ωат.(n) ∙ Ar(n)
Ar средняя (Cl) = 0,754 ∙ 35 + 0,246 ∙ 37 = 35,453
VI. Задания для закрепления
Задание №1. Определите атомный состав изотопов хлора 35 Cl и 37 Сl. Почему изотопы хлора имеют разное массовое число?
Задание №2. Определите относительную атомную массу элемента кремния, если известно, что он состоит из трёх изотопов: 28 Si (атомная доля 92,3%), 29 Si (4,7%), 30 Si (3%).
Источник: kardaeva.ru