Медь встречается в природе как самородный металл и в виде серных руд: медный колчедан CuFeS2, медный блеск Cu2S или в виде кислородсодержащих соеденений: куприт CuO2, малахит Cu2(OH)2CO3 и др.
| CuSO4 . 5 H2O | Меди сульфат Cupri sulfas |
Описание. Растворимость. Синие кристаллы или синий кристаллический порошок без запаха, металлического вкуса. Выветривается на воздухе. При выветривании или прокаливании он теряет кристаллизационную воду, что приводит к уменьшению интенсивности окраски кристаллов. При полной потере происходит обесцвечивание.
Легко растворим в воде, практически не растворим в спирте, растворы слабокислой реакции.
Получение
Металлическую медь растворяют в кислотах, проявляющих окислительные свойства, в присутствии окислителей (О2 воздуха или HNO3): Cu + H2SO4 + [O] → CuSO4 + H2O
Подлинность
Проводят реакции на ион меди и сульфат-ион.
Cu 2+ :
1) Медь легко восстанавливается из соединений металлами. В качестве восстановителя берут металлическое Fe,Zn или Al. Железо при соприкосновении с раствором CuSO4 покрывается красным налетом металлической меди:
СУЛЬФАТ МЕДИ
2) Соли меди окрашивают пламя в зеленый цвет в присутствии HCl.
3) Ион меди с раствором щелочи образует осадок меди гидроксида голубого цвета, который при нагревании образует осадок меди оксида (II) черного цвета:
4) Меди гидроксид растворяется в избытке NH4OH с образованием растворимого комплекса тетрааминмеди сульфата синего цвета:
голубой синее окрашивание
5) Меди гидроксид, растворяясь в глицерине или других многоатомных спиртах, образует синее окрашивание:
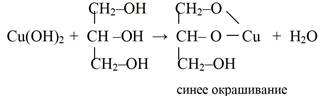
6) Соли меди с сульфид-ионом образуют осадок меди сульфида черного цвета:
Осадок меди сульфида растворим в HNO3 с образованием мутного раствора желтого цвета:
желтый
7) Соли меди с калия гексацианоферратом образуют красно-бурый осадок комплексной соли, растворимый в растворе аммиака с образованием иона тетрааминмеди синего цвета:
красно-бурый синее окрашивание
8) Соли меди с калия йодидом образуют меди (II) йодид, который разлагается с выделением свободного йода и осадка меди (I) йодида белого цвета: CuSO4 + 2 KI → CuI2↓ + K2 SO4
йодид закиси меди
9) Соли меди с бромидами образуют черный осадок меди бромида:
SO4 2- : с раствором BaCl2 в среде HCl образуется белый осадок BaSO4.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Соединения меди
1. Из металлической меди действием кислоты серной в присутствии окислителей – кислорода воздуха или азотной кислоты:
Раствор выпаривают для удаления избытка кислот, затем остаток после упаривания растворяют в воде и при стоянии выкристаллизовывается сульфат меди – CuSO4·5H2O.
Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)
2. Растворением меди (II) оксида в кислоте серной:
Раствор упаривают до кристаллизации CuSO4 • 5Н2O.
Синие кристаллы или синий кристаллический порошок без запаха. Медленно выветривается на воздухе. Водные растворы имеют слабокислую реакцию.
Водные растворы имеют слабо-кислую реакцию среды, т.к. в водных растворах меди (II) сульфат подвергается гидролизу с выделением кислоты серной:
На воздухе медленно выветривается. При нагревании до 120 0 теряются 4 молекулы воды и CuSO4 • H2O – порошок слегка голубоватого цвета, жадно притягивающий влагу. Безводный CuSO4 – это белый порошок.
Растворимость
Легко растворим в воде, очень легко — в кипящей воде, практически нерастворим в 95% спирте.
Подлинность
1. ФC Реакция осаждения раствором аммиака. Образуется голубой осадок основной соли, который легко растворяется в избытке раствора аммиака с образованием комплексного соединения тёмно – синего цвета:
эквив. голубой осадок
При подкислении комплексный катион меди разрушается, и окраска раствора из ярко-синей переходит в голубую в результате образования аквакомплекса меди (II):
2. ФC Реакция восстановления меди(II) до металлической меди. Железная пластинка или гвоздь или металлическая скрепка в растворе ЛВ покрывается красным налетом металлической меди.
Реакция основана на способности Cu 2+ легко восстанавливаться до Cu 0 :
3. Фc Реакция на so42- — ион ( офс гфхii). Неофициальные реакции на ион меди
4. Реакция осаждения раствором натрия гидроксида:
Эквив. Синий осадок
Образуется синий осадок, растворимый в избытке реактива (при рН > 15), а в минеральных кислотах (меди (II) гидроксид проявляет слабые амфотерные свойства):
Избыток Синий раствор
5. Реакция осаждения натрия сульфидом.Черный осадок меди (II) сульфида нерастворим в кислоте хлороводородной разведенной.
6.Реакция осаждения калия гексацианоферратом (II). Красно-коричневый (красно-бурый) осадок меди (II) гексацианоферрат (II) нерастворим в разведенных кислотах, растворим в растворе аммиака.
Очень чувствительная реакция
7.Реакция комплексообразования с многоатомными спиртами (глицерином) в щелочной среде. Образуется окрашенный в интенсивный синий цвет комплекс — растворимое хелатное соединение:
Источник: studfile.net
Подборка простых опытов с медным купоросом в домашних условиях
В прошлой статье я рассказывала про медный купорос, что это такое, где применяется и даже как некоторые им лечатся (вот только не знаю, вылечиваются ли?), а сегодня предлагаю поделать опыты с медным купоросом в домашних условиях.
Обо всех этих экспериментах я уже рассказывала в рубрике «Похимичим», так что сейчас, по сути, просто собираю их все вместе, так как они раскиданы по разным статьям.
В начале, как обычно предупреждаю о соблюдении правил техники безопасности!
Напоминаю, что практически все опыты (кроме одного) мы будем делать с раствором медного купороса. Чтобы его получить, растворите половину чайной ложки в стакане воды – этого вполне хватит на все сегодняшние эксперименты. Предлагаю начать с самого простого и похимичить гвоздем.
Опыт с медным купоросом и железным гвоздем
Все очень просто – в раствор купороса опускаете чистый (имеется ввиду без ржавчины и масла) железный гвоздь и ждете. Химическая реакция пройдет сама, без вашего дальнейшего участия. Первые результаты будут видны уже через несколько минут. Ну а самым терпеливым советую «забыть» про происходящее на пару недель. Будет очень интересно.
Подробнее читайте вот в этой статье.

Взаимодействие с аммиаком
В светло-голубой раствор капаем немного аммиака. Вуаля! Готов ярко-фиолетовый раствор аммиаката меди. Не забивайте голову названием, просто наслаждайтесь красивым зрелищем.

Взаимодействие с гидроксидом натрия
Добавляем немного гидроксида натрия. Получается красивый голубой осадок гидроксида меди. Не выливайте его, он нам пригодится в следующем опыте.

Красивые превращения глюкозы
Вам понадобится аптечный раствор чистой глюкозы. Приливаем ее к осадку, полученному в предыдущем опыте, и аккуратно нагреваем. Ярко-голубой осадок постепенно превратится сначала в желтый раствор, затем – в красный.
Делать все нужно достаточно внимательно и аккуратно, поэтому посмотрите, как я делала.

Опыты с яйцом
Денатурация (разрушение) белка
Берем сырое яйцо и отделяем белок от желтка. Белок помещаем в стакан, добавляем немного воды,перемешиваем и делим на две части, то есть на два эксперимента. К первой части приливаем немного медного купороса. После перемешивания получаем вот такую невразумительную массу:

Биуретовая реакция
Ко второй части белка добавляем немного гидроксида натрия, а потом – несколько капель купороса. Получаем ярко-фиолетовую окраску раствора.

Подробно об этих реакциях можно прочитать вот здесь.
Взаимодействие с поваренной солью
Разводим в стакане с водой немного обычной поваренной соли и смешиваем с раствором медного купороса. Любуемся изумрудно-зеленой окраской получившегося раствора.

Желающих продолжить этот опыт дальше отсылаю к статье «Цветные реакции». В ней вы найдете много интересного.
Забавный химический фокус
Он потребует от вас некоторых приготовлений (минут на пять), но оно того стоит. Нужна всего лишь старая сковородка и кристаллический (не раствор!) медный купорос. Будем с помощью воды превращать белое вещество в синее. Подробная инструкция здесь.
Морозные узоры на стекле
Хоть сейчас и лето, но вы легко можете создать на стекле самые настоящие морозные узоры.

Выращиваем химический сад
Еще один очень простой опыт. Единственное, что от вас потребуется, это, как и в случае с гвоздем, терпение. Ну и немного обычного канцелярского силикатного клея. Подробности в статье «Химические водоросли».

Непослушная пена
Ну и под занавес, эффектный опыт по получению пены. Его можно делать в двух вариантах – с медным купоросом либо с марганцовкой. По сути, процессы идут одинаковые и результат также практически одинаковый. Правда, придется побегать по аптекам в поисках гидроперита. Если вам улыбнется удача и вы его купите, то внимательно читайте вот эту статью и химичьте в свое удовольствие!

Вот и все на сегодня. Надеюсь, эта подборка домашних опытов с медным купоросом вам пригодится. Может, у вас есть какие-то идеи, что еще можно сделать? Пишите в комментариях, делитесь опытом.
Всем хорошего настроения!
![]()
P.S. Я совсем забыла про самый распространенный опыт — выращивание красивых синих кристаллов. Обещаю исправиться и в ближайшее время показать вам его
KidsChemistry теперь есть и в социальных сетях. Присоединяйтесь прямо сейчас! Google+ , В контакте , Одноклассники , Facebook , Twitter
Источник: kidschemistry.ru