Презентация на тему: » Задание 1. Напишите уравнение реакции, укажите ее тип. Сульфат меди (II) вступает в реакцию с железом. Хлорид калия реагирует с нитратом серебра. Карбонат.» — Транскрипт:
2 Задание 1. Напишите уравнение реакции, укажите ее тип. Сульфат меди (II) вступает в реакцию с железом. Хлорид калия реагирует с нитратом серебра. Карбонат кальция реагирует с соляной кислотой. « Химическая разминка»
3 CuSO4 +Fe=FeSO4 + Cu (замещения) KCl + AgNO3=KNO3+AgCl (обмена) CaCO3+2HCl=CaCl2+H2CO3 (обмена)
5 Цель урока: Дать определения понятия раствор, изучить типы растворов, изучить факторы, влияющие на растворимость веществ в воде.
6 К какому физическому или химическому процессу относится процесс растворения?
7 1. Теории растворов Физическая Я. Х. Вант-Гофф, С. Аррениус, В. Оствальд Растворение – процесс диффузии Химическая Д.И. Менделеев, И.А. Каблуков Растворение – химическое взаимодействие растворенного вещества с молекулами воды
Определение хлорид-ионов
8 Гидраты – непрочные соединения веществ с водой, существующие в растворе Кристаллогидраты – соли и другие твердые вещества, в состав которых входит вода. (кристаллизационная)
9 CuSO 4. 5H 2 O – медный купорос CuSO 4 Раствор CuSO 4 в воде
10 Современная теория растворов Растворение – физико-химический процесс. Раствор – однородная система переменного состава, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
11 Почему у различных веществ разная растворимость? От чего она зависит?
12 2. Факторы, от которых зависит растворимость веществ Природа вещества Вещества Хорошо Практически растворимые нерастворимые ( более 1 г.) (меньше 0,01 г.) Малорастворимые (менее 1 г.) Р Н М
13 Температура С повышением температуры растворимость твердых веществ увеличивается, газообразных — уменьшается
14 Задание 1: Определите растворимость ВаCl2 при t° по графику : 10 ° 30 ° 80 ° Задание 2: Определить растворимость NaCl при t° по графику: 10 ° 30 ° 80 °
16 3. Типы растворов по содержанию растворенного вещества Насыщенный раствор – раствор, в котором при данной температуре вещество больше не растворяется. Ненасыщенный раствор – раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе Пересыщенный раствор – раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.
17 ω= m в-ва m р-ра. 100 % 4. Концентрация растворов Массовая доля растворенного вещества в растворе Задача. Для консервирования огурцов приготовили рассол: на 2 л воды взяли 100 г соли, а для консервирования томатов – рассол из 100 г соли и 3 л воды. Какой рассол получится более концентрированным?
18 . Какова растворимость хлорида калия при 30 0 С? 2. Какова растворимость сульфата калия при 80 0 С? 3. При какой температуре в 100 г воды может раствориться 60 г хлорида бария? 4. Растворимость какого вещества при 55 0 С составляет 60 г на 100 г воды? Закрепление
Реакция НИТРАТА СЕРЕБРА и ДИХРОМАТА АММОНИЯ.Химические опыты дома. Chemical experiment with silver.
19 (40 г) (20 г) (при 90 0 С) (сульфата магния)
Источник: www.myshared.ru
AgNO3 + FeSO4 = Ag2(SO4) + Fe(NO3)2 — Калькулятор химических реакций
Для уравнивания химической реакции, введите уравнение реакции и нажмите кнопку Уравнять. Решенное уравнение появится сверху.
- Используйте заглавные символы для начального знака элемента и строчные символы для второго знака. Примеры: Fe, Au, Co, Br, C, O, N, F.
- Ионные заряды пока не поддерживаются и не будут приняты в расчет.
- Переместите неизменные группы в соединениях, чтобы не допустить неопределенность. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + H2O не уравняется, но XC2H5 + O2 = XOH + CO2 + H2O уравняется.
- Промежуточные расстояния [такие, как (s) (aq) или (g)] не требуются.
- Вы можете использовать круглые () и квадратные скобки [].
Примеры
- AgNO3 + FeSO4 + H2SO4 = Fe2(SO4)3 + Ag2SO4 + H2O + NO
- AgNO3 + FeSO4 + H2SO4 = Fe2(SO4)3 + NO + Ag2SO4 + H2O
- AgNO3 + FeSO4 + H2SO4 = Fe2(SO4)3 + NO + AgSO4 + H2O
- AgNO3 + FeSO4 + H2SO4 = NO + Fe2(SO4)3 + Ag2SO4 + H2O
- AgNO3 + FeSO4 + HCl = FeCl3 + AgCl + Fe2(SO4)3 + NO + H2O
- AgNO3 + FeSO4 + HNO3 = Fe(NO3)3 + NO + AgSO4 + H2O
- AgNO3 + FeSO4 = (SO4)3 + Fe(NO3)3 + Ag
- AgNO3 + FeSO4 = Ag + Fe(NO3)2 + Fe2(SO4)3
- NiO + CO2 = NiO2 + CO
- PB(CH3COO)2 + CuSO4 = PBSO4 + Cu(CH3COO)2
- NIS + O2 = NIO + SO2
- Cu(No3)2 + NaCl = CuCl2 + NaNo3
Калькуляторы
Химическое уравнение
- Программа решения химических уравнений
- Калькулятор стехиометрических реакций
- Калькулятор Лимитирующего реагента
- Ionic Equation Calculator
- окислительно-восстановительные реакции
Источник: www.chemicalaid.com
Готовимся к углубленному изучению химии
Железо – химический элемент четвертого периода и побочной подгруппы VIII группы периодической системы. Атом железа содержит восемь валентных электронов, однако в соединениях железо обычно проявляет степени окисления (+2) и (+3), редко – (+6). Имеются сообщения о получении соединений восьмивалентного железа.

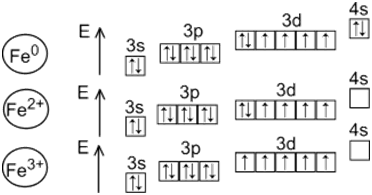
Степень окисления +3 для железа является наиболее устойчивой. Соединения железа(III) могут быть восстановлены только под действием сильных восстановителей, таких как водород в момент выделения, сероводород. Эти реакции проводят в кислой среде :
Fe2(SO4)3+H2S=2FeSO4+S+H2SO4
Железо широко распространено в природе – это самый распространенный металл, после алюминия. Существует гипотеза о том, что внутреннее ядро Земли – целиком состоит из железа с примесью никеля и серы, а возможно и других элементов.
В природе железо встречается в виде руд — оксидов Fe2O3 (гематит, красный железняк) и Fe3O4 (магнетит, магнитный железняк), гидратированного оксида Fe2O3 ⋅ H2O (лимонит, бурый железняк), карбоната FeCO3 (сидерит), дисульфида FeS2 (пирит), редко встречается в виде самородков, попадающих на землю с метеоритами. Такое метеоритное железо было известно людям издревле. Освоение получения железа из железной руды послужило началом железного века.

ПОЛУЧЕНИЕ ЖЕЛЕЗА
В настоящее время железную руду восстанавливают коксом в доменных печах, при этом расплавленное железо частично реагирует с углеродом, образуя карбид железа Fe3C (цементит), а частично растворяет его. При затвердевании расплава образуется чугун. Чугун, используемый для получения стали, называют передельным.
Запомнить! Сталь, в отличие от чугуна, содержит меньшее количество углерода.
При получении стали, лишний углерод, содержащийся в чугуне, необходимо выжечь. Этого добиваются, пропуская над расплавленным чугуном воздух, обогащенный кислородом. Существует и прямой метод получения железа, основанный на восстановлении окатышей магнитного железняка природным газом:
Fe3O4 + CH4 = 3Fe + CO2 + 2H2O
ФИЗИЧЕСКИЕ СВОЙСТВА
Железо – серебристо-белый, ковкий и пластичный тугоплавкий (т. пл. 1535°C, т. кип. 2870°C) металл, при температурах ниже 769°C притягивается магнитом, то есть обладает ферромагнетизмом. Ферромагнитные свойства вызваны наличием в структуре металла отдельных зон – доменов, магнитные моменты которых под действием внешнего магнитного поля ориентируются в одну и ту же сторону.
Железо существует в форме нескольких полиморфных (аллотропных) модификаций. При температурах ниже 9100C устойчиво железо с объемно-центрированной кристаллической решеткой (αα-Fe, немагнитное α-железо существующее при 769–9100C называют β-Fe), в интервале температур 910–14000C – более плотная модификация с кубической гранецентрированной (γγ-Fe), а выше этой температуры и вплоть до температуры плавления вновь становится устойчивой структура с объемно-центрированной ячейкой (δ-Fe).
ХИМИЧЕСКИЕ СВОЙСТВА ЖЕЛЕЗА
Запомнить!
· Степень окисления +2 железо проявляет при взаимодействии со слабыми окислителями: серой, йодом, соляной кислотой, растворами солей.
· Степень окисления +3 железо проявляет при взаимодействии с сильными окислителями: хлором, бромом.
· Смешанную степень окисления железо проявляет при взаимодействии с кислородом, водяным паром.

1) с кислотами. На влажном воздухе окисляется, покрываясь коричневой коркой гидратированного оксида Fe2O3 ⋅ H2O, ржавчины. Железо легко растворяется в разбавленных кислотах:
Fe + 2HCl = FeCl2 + H2
но пассивируется в холодных концентрированных растворах кислот-окислителях – серной и азотной.
2) с солями. Будучи металлом средней химической активности, железо вытесняет другие, менее активные металлы из растворов их солей:
Fe + CuSO4= FeSO4 + Cu
При этом, как и при растворении в кислотах, образуются соли двухвалентного железа.
3) с парами воды. При температуре белого каления железо реагирует с водой. Пропуская перегретый водяной пар через раскаленный на жаровне чугунный пушечный ствол, Лавуазье получил водород:
3Fe + 4H2O = Fe3O4 + 4H2.
4) с кислородом. В кислороде железо сгорает с образованием черyого порошка железной окалины – оксида железа(II, III) Fe3O4,имеющей тот же состав, что и природный минерал магнитный железняк:
3Fe + 2O2 = Fe3O4
Искры, вырывающиеся при заточке стальных ножей или при резке стальных листов ацетилено-кислородным пламенем, также представляют собой раскаленные куски железной окалины.
5) с неметаллами. Степень окисления железа в образующихся соединениях зависит от силы окислителя — неметалла. Так, при взаимодействии с хлором образуется хлорид FeCl3:
2Fe + 3Cl2 = 2FeCl3,
с серой – сульфид FeS:
Fe + S = FeS.
Соединения железа(II)
Запомнить! Оксид и гидроксид железа(II) обладают основными свойствами.
Соединения железа(II) являются сильными восстановителями и на воздухе легко окисляются до соединений трехвалентного железа:
4FeSO4 + O2 + 2H2O = 4Fe(OH)SO4.
Белый осадок гидроксида железа(II) Fe(OH)2, образующийся при действии на соли железа(II) растворов щелочей, на воздухе мгновенно зеленеет, образуя «зеленую ржавчину» – смешанный гидроксид железа(II) и железа(III), который лишь через некоторое время приобретает характерный для Fe2O3 ⋅ H2O ржавый цвет.
Соединения железа(III)
Гидроксид железа(III) выпадает в виде коричневого осадка при действии растворов щелочей, сульфидов, карбонатов на соли железа(III):
2FeCl3 + 3Na2CO3 + 6H2O = 2Fe(OH)3 +3CO2+ 6NaCl
Запомнить! Оксид и гидроксид железа(III) являются слабо амфотерными, с преобладанием основных свойств.
Так, при растворении гидроксида железа(III) в кислотах образуются соли железа(III), а при сплавлении оксида с оксидами активных металлов – ферриты (ферраты(+3)):
2Fe(OH)3 + 2H2SO4 = Fe2(SO4)3 + 3H2O,
Fe2O3 + CaO = CaFe2O4.
В концентрированных щелочах Fe(OH)3 медленно растворяется, образуя гидроксоферраты, например, Na3[Fe(OH)6]:
Fe(OH)3+3NaOHводн.=Na3[Fe(OH)6]
При действии недостатка кислот они разлагаются в образованием осадка гидроксида железа(III):
Na3[Fe(OH)6]+3HClнед.=3NaCl+Fe(OH)3↓+3H2O Na3[Fe(OH)6]+6HClизб.=3NaCl+FeCl3+6H2O
При пропускании углекислого газа они разлагаются на гидроксид железа(III) и карбонат натрия:
2Na3[Fe(OH)6]+3CO2↑=3Na2CO3+2Fe(OH)3↓+3H2O
Запомнить! Соли железа(III) и некоторых слабых кислот, например, сернистой и угольной не могут быть выделены из водных растворов по причине полного необратимого гидролиза:
2FeCl3+3Na2S+6H2O=2Fe(OH)3+3H2S↑+6NaCl
О протекании реакции судят по выделению газа и образованию коричневого осадка гидроксида железа(III).
Окисление Fe(OH)3 бромом в щелочной среде приводит к образованию вишневых растворов ферратов (+6):
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O.
Запомнить! Ферраты содержат железо в степени окисления (+6), и являются сильными окислителями.
Применение железа
В виде чугуна и стали железо находит широкое применение в народном хозяйстве. Хлорид железа(III) используется при травлении медных плат, а сульфат железа(III) – в качестве хлопьеобразователя (коагулянта) при очистке воды. Ферриты двухвалентных металлов (магния, цинка, кобальта, никеля) со структурой шпинели применяют в радиоэлектронике, вычислительной технике.
Соли железа(III) образуют желто-коричневые растворы, цвет которых объясняется гидролизом, приводящим к образованию коллоидного раствора гидроксида железа(III). Многие из них, например, хлорид FeCl3×6H2O («хлорное железо») сильно гигроскопичны, и при хранении в неплотно закрытых склянках, отсыревают.
Качественные реакции на катионы железа
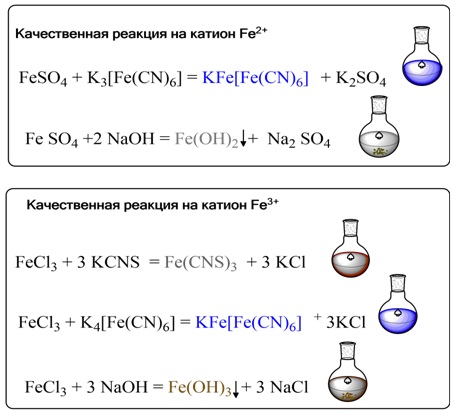
На ионы железа существуют удобные качественные реакции. Если к раствору соли железа(III) прибавить разбавленный раствор роданида калия KCNS, то образуется интенсивно-красное окрашивание, вызванное образованием роданида железа(III):
FeCl3+3KSCN=Fe(SCN)3+3KCl
Другим реагентом на ионы железа(III) служит комплексное соединение гексацианоферрат(II) калия K4[Fe(CN)6], часто называемый также «желтая кровяная соль». Такое странное на первый взгляд название связано с тем, что раньше эту соль получали нагреванием крови с поташом и железными опилками. С солями железа(III) она дает синий коллоидный раствор «берлинской лазури» или «турнбуллева синь»:
K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓+3KCl
Аналогичное синие окрашивание осадка того же состава можно получить при взаимодействии ионов железа(II) с раствором «красной кровяной соли» — гексацианоферрат(III) калия K3[Fe(CN)6]:
K3[Fe(CN)6]+FeCl2=KFe[Fe(CN)6]↓+2KCl
Таким образом, красная кровяная соль служит реактивом на соли двухвалентного железа. При более высоких концентрациях растворов выделяется нерастворимая в воде форма «берлинской лазури» состава Fe4[Fe(CN)6]3.
SHAPE * MERGEFORMAT

УПРАЖНЕНИЯ
1. Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
Напишите уравнения описанных реакций.
Решение:
Написаны четыре уравнения описанных реакций :
1) 2Fe + 6H2SO4 → Fe2 (SO4)3 + 3SO2↑ +6H2O
2) Fe2 (SO4)3 + 6NaOH → 2Fe(OH)3 ↓ + 3Na2SO4
3) 2Fe(OH)3 → Fe2O3 + 3H2O
4) Fe 2 O 3 + Fe → 3 FeO
_________________________________________________________________
2. Смесь алюминия и железа обработали избытком соляной кислоты, при этом выделилось 8,96 л газа (н.у.). Это же количество смеси обработали избытком раствора гидроксида натрия, выделилось 6,72 л газа (н.у.). Найти массовую долю железа в исходной смеси.
Источник: himiy88.blogspot.com