Оборудование: планшетка, фоновый экран, пробирка (2 шт.), стеклянная палочка, фильтровальная бумага, воронка, спиртовка, зажим пробирочный, спички.
Реактивы: 10% раствор сульфата железа(II) FeSO4, 1% раствор нитрата серебра (I), раствор гексацианоферрата(III) калия K3[Fe(CN)6], раствор роданида калия KSCN (или роданида аммония NH4SCN).
В опыте используют свежеприготовленные растворы сульфата железа(II) и нитрата серебра (I). Причем раствор сульфата железа не желательно подкислять серной кислотой, т.к. в противном случае реакция гидролиза не идет до конца и бурый осадок не образуется, раствор просто приобретает слегка бурую окраску.
Данный опыт можно использовать для создания проблемных ситуаций: первая — протекание окислительно-восстановительной реакции вместо реакции ионного обмена, а вторая — образование бесцветного раствора соли железа (III), который только в результате гидролиза будет приобретать бурую окраску.
Ход работы
1. Устанавливают планшетку на белую сторону фонового экрана.
Как принимать препараты железа? Лечение железодефицитной анемии

2. В две ячейки планшетки вносят по 5-6 капель сульфата железа(II).

3. В одну ячейку добавляют 5-6 капель гексацианоферрата(III) калия. Образуется темно-синий осадок (турнбулева синь). В другую ячейку планшетки добавляют 5-6 капель роданида калия, может появиться небольшое кирпичное окрашивание из-за следов ионов железа(III), если при приготовлении раствора использовали старый реактив.

4. В пробирку наливают 25 капель сульфата железа(II) и приливают к нему раствор нитрата серебра(I) до образования и осаждения мелкодисперстного серебристо-серого осадка серебра.
3FeSO4 + 3AgNO3=Fe2(SO4)3 + 3Ag↓ + Fe(NO3)3
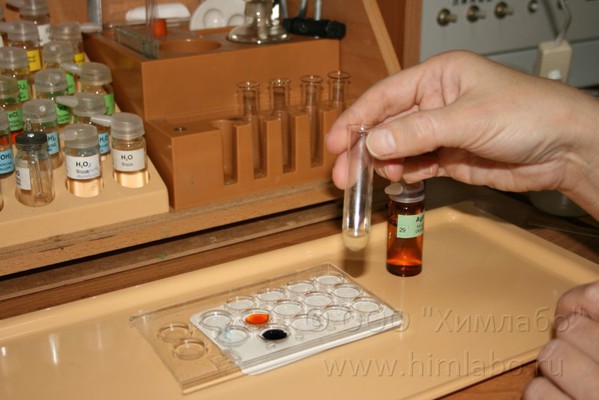
5. Стеклянной палочкой переносят несколько капель получившегося раствора в планшетку

6. Добавляют 1 каплю раствор роданида калия KSCN. Наблюдают ярко-красное окрашивание вследствие образования роданида железа (III).Если реакция пройдет до конца, то при проведении аналогичной реакции с гексацианоферратом(III) калия, качественной реакции не наблюдают.
Дефицит железа: симптомы и причины ☝️

7. Полученный раствор соли железа (III) отфильтровывают от осадка серебра в пробирку.

8. Пробирку вставляют в пробирочный зажим и нагревают на спиртовке.

9. При нагревании раствор приобретает коричневую окраску, затем она усиливается, а потом выпадает бурый осадок.

После проведения данного опыта создаются сразу две проблемные ситуации. Первая заключается в том, что наблюдается реакция, которая, по представлениям учеников, протекать не должна. Ведь учащимся известно, что реакция между растворами солей возможна, если в результате взаимодействия образуется новая малорастворимая соль, выпадающая в осадок. В этом опыте в осадок выпадает не соль, а металл. Составляют уравнения окислительно-восстановительных реакций.
Далее обращают внимание на цвет раствора, образовавшегося в результате реакции. По представлениям учащихся, растворы солей железа (III) имеют желто-коричневую окраску, но полученный раствор окраски не имеет. Учащиеся должны сделать вывод о том, что свежеприготовленный раствор соли железа (III) окраски не имеет, цвет обычных растворов обусловлен гидролизом. Опираясь на уравнения реакций гидролиза по отдельным ступеням, учащиеся должны определить, что при нагревании гидролиз значительно усиливается и даже сопровождается выпадением осадка Fe3O3•nH2O.
Мы также производим:
Оказываем содействие в подготовке технических требований для тендерной документации.
Внимание! Изображение товара может отличаться от полученного Вами товара. Производитель оставляет за собой право изменять комплектацию и технические характеристики товара без предварительного уведомления без ухудшения функциональных и качественных показателей. Информация о товаре носит справочный характер и не является публичной офертой, определяемой Статьей 437 ГК РФ.
Убедительная просьба, при покупке учебного оборудования согласовывать с менеджером важные для Вас характеристики, комплектацию и цену учебного оборудования.
Источник: www.himlabo.ru
Сульфат железа реагирует с серебром
Напишите реакцию взаимодействия сульфата железа(2) с нитратом серебра. Рассчитайте массу серебра которая выделится, если в реакции участвует 10л раствора сульфата железа(2)(p=1,078 кг/л) с массовой долей 8%
4 (4 оценки)

Poliakova 9 лет назад
Светило науки — 1134 ответа — 8379 раз оказано помощи
ρ = m/V ⇒
m (раствора FeSO₄) = ρ*V = 1,078*10 = 10,78 кг = 10780 г
W (раствора FeSO₄) = m (чист.FeSO₄) / m (раствора FeSO₄) ⇒
m (чист.FeSO₄) = W*m (раствора FeSO₄) = 0,08*10780 = 862,3 г
862,3 г Х г
3FeSO₄ + 3AgNO₃ ⇒ Fe₂(SO₄)₃ + Fe(NO₃)₃ + 3Ag
3*152 г/моль 3*108 г/моль
составляем пропорцию: 862,3/3*152 = Х/3*108
Х = 862,3*3*108/3*152 = 612,7 г
ответ: m (Ag) = 612,7 г
Источник: vashurok.com
Сульфат железа и железный купорос, характеристика, свойства и получение, химические реакции

Сульфат железа и железный купорос, характеристика, свойства и получение, химические реакции.
Поделиться в:




Сульфат железа – неорганическое вещество, имеет химическую формулу FeSO4.
Краткая характеристика сульфата железа:
Сульфат железа – неорганическое вещество белого или бесцветного цвета.
Химическая формула сульфата железа FeSO4.
Сульфат железа – неорганическое химическое соединение, соль серной кислоты и железа .
Хорошо растворяется в воде, глицерине и этиленгликоле. Растворение сульфата железа проходит со значительным выделением тепла . Сульфат железа гидролизуется и даёт кислую среду.
С водой сульфат железа образует кристаллогидраты: гептагидрат сульфата железа FeSO4·7H2O, именуемый также железный купорос (прозрачные кристаллы светлого голубовато-зелёного цвета), тетрагидрат сульфата железа FeSO4·4H2O (прозрачные кристаллы зелёного цвета), моногидрат сульфата железа FeSO4·H2O.
Сульфат железа негорюч, пожаро- и взрывобезопасен.
В природе сульфат железа встречается в виде минерала мелантерита (FeSO4·7H2O).
Краткая характеристика железного купороса:
Железный купорос – неорганическое вещество светлого голубовато-зелёного цвета.
Химическая формула железного купороса FeSO4·7H2O.
Железный купорос – гептагидрат сульфата железа.
Хорошо растворяется в воде.
На воздухе постепенно выветривается (теряет кристаллизационную воду).
Железный купорос негорюч, пожаро- и взрывобезопасен.
Железный купорос относится к веществам 3-го класса опасности в соответствии с ГОСТ 12.1.007.
Физические свойства сульфата железа:
| Наименование параметра: | Значение: |
| Химическая формула | FeSO4 |
| Синонимы и названия иностранном языке | iron (II) sulfate (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м 3 | 1898 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см 3 | 1,898 |
| Температура кипения, °C | — |
| Температура плавления, °C | — |
| Температура разложения, °C | 680 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 151,932 |
| Растворимость в воде (20 o С), г/100 г | 26,3 |
Физические свойства железного купороса:
| Наименование параметра: | Значение: |
| Химическая формула | FeSO4·7H2O |
| Синонимы и названия иностранном языке | гептагидрат сульфата железа (II) |
iron (II) sulfate heptahydrate (англ.)
Получение сульфата железа:
В промышленности сульфат железа получают как побочный продукт при травлении железных листов, проволоки, удалении окалины и пр., а также как побочный продукт производства оксида титана из ильменита.
Сульфат железа в промышленности может быть получен путем окислительного обжига пирита (FeS2).
В лаборатории сульфат железа получают в результате следующих химических реакций:
- 3. взаимодействия сульфата меди и железа:
Химические свойства сульфата железа. Химические реакции сульфата железа и кристаллогидратов меди:
Химические свойства сульфата железа аналогичны свойствам сульфатов других металлов . Поэтому для него характерны следующие химические реакции:
1. реакция сульфата железа и цинка :
В результате реакции образуются сульфат цинка и железо.
2. реакция сульфата железа и алюминия :
В результате реакции образуются сульфат алюминия и железо.
3. реакция сульфата железа и магния :
В результате реакции образуются сульфат алюминия и железо.
4. реакция сульфата железа и кальция :
В результате реакции образуются сульфат кальция и железо.
5. реакция взаимодействия сульфата железа и кислорода:
В результате реакции образуются сульфат железа (III) и оксид железа (III).
6. реакция взаимодействия сульфата железа, кислорода и воды:
В результате реакции образуется гидроксосульфат железа (III). Реакция протекает медленно.
7. реакция взаимодействия сульфата железа и гидроксида натрия:
В результате реакции образуются сульфат натрия и гидроксид железа . Реакция протекает в атмосфере азота .
реакция взаимодействия сульфата железа и сульфида натрия:
В результате реакции образуются сульфат натрия и сульфид железа .
реакция взаимодействия сульфата железа и нитрата свинца:
В результате реакции образуются нитрат железа и сульфат свинца. Реакция протекает в атмосфере азота.
реакция взаимодействия сульфата железа и карбоната натрия :
В результате реакции образуются сульфат натрия и карбонат железа.
реакция взаимодействия сульфата железа и фосфата натрия :
В результате реакции образуются фосфат железа и сульфат натрия. В ходе реакции используется разбавленный раствор фосфата натрия.
реакция взаимодействия сульфата железа (II) и сульфата меди:
В результате реакции образуются медь и сульфат железа (III). В ходе реакции используется концентрированный раствор фосфата железа.
реакция термического разложения сульфата железа:
В результате реакции образуются в первом случае – оксид железа (III), оксид серы (IV) и оксид серы (VI), во втором – оксид железа (III), оксид серы (IV) и кислород. В ходе второй реакции также образуется примесь SO3.
реакция термического разложения гептагидрата сульфата железа:
Гептагидрат сульфата железа FeSO4•7H2O разлагается на сульфат железа и воду. Реакция протекает в атмосфере водорода .
Применение и использование сульфата железа и железного купороса:
Сульфат железа и железный купорос используется во множестве отраслей промышленности и для бытовых нужд:
– в медицине в качестве лекарственного средства;
– в красильном деле железный купорос применятся для окраски шерсти в чёрный цвет;
– в сельском хозяйстве применяется как антисептик, фунгицид для опрыскивания садовых деревьев .
сульфат железа реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфата железа
реакции
Коэффициент востребованности 7 196
- ← Гидроксид цинка, характеристика, свойства и получение, химические реакции
- Сульфат алюминия, характеристика, свойства и получение, химические реакции →
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (107 925)
- Экономика Второй индустриализации России (105 128)
- Этилен (этен), получение, свойства, химические реакции (41 575)
- Крахмал, свойства, получение и применение (36 275)
- Целлюлоза, свойства, получение и применение (34 485)
- Природный газ, свойства, химический состав, добыча и применение (33 302)
- Программа искусственного интеллекта ЭЛИС (32 523)
- Прямоугольный треугольник, свойства, признаки и формулы (32 107)
- Метан, получение, свойства, химические реакции (31 832)
- Плазма, свойства, виды, получение и применение (30 615)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.