По названиям солей (см. перечень ниже) составьте их молекулярные формулы. Солями каких кислот они являются? Результаты выполнения этого упражнения представьте в виде таблицы.
Перечень солей:
а) сульфат натрия, сульфат алюминия, карбонат калия, нитрат серебра, сульфид серебра, фосфат бария, силикат магния, хлорид меди (II);
б) нитрат железа (III), сульфат свинца (II), хлорид хрома (III), сульфид калия, сульфит калия, сульфат калия, фосфат алюминия, фосфат кальция, хлорид титана (IV);
в) сульфид железа (II), сульфат железа (II), сульфит железа (II), сульфат железа (III), сульфид серебра, сульфат меди (II), сульфит калия, сульфат магния, сульфид цинка;
г) карбонат железа (II), нитрат железа (III), ацетат магния, хлорид бария, бромид калия, иодид натрия, ацетат свинца (II), фосфат калия;
д) ацетат цезия, нитрит бария, карбонат аммония, хлорат калия, перхлорат калия, селенат натрия, метафосфат натрия.
Химический опыт «Десять сульфидов»
| сульфат натрия | Na2SO4 | H2SO4 | серная кислота |
| сульфат алюминия | Al2(SO4)3 | H2SO4 | серная кислота |
| карбонат калия | K2CO3 | H2CO3 | угольная кислота |
| нитрат серебра | AgNO3 | HNO3 | азотная кислота |
| сульфид серебра | Ag2S | H2S | сероводородная кислота |
| фосфат бария | Ba3(PO4)2 | H3PO4 | фосфорная кислота |
| силикат магния | MgSiO3 | H2SiO3 | кремниевая кислота |
| хлорид меди (II) | CuCl2 | HCl | соляная кислота |
| нитрат железа (III) | Fe(NO3)3 | HNO3 | азотная кислота |
| сульфат свинца (II) | PbSO4 | H2SO4 | серная кислота |
| хлорид хрома (III) | CrCl3 | HCl | соляная кислота |
| сульфид калия | K2S | H2S | сероводородная кислота |
| сульфит калия | K2SO3 | H2SO3 | сернистая кислота |
| сульфат калия | K2SO4 | H2SO4 | серная кислота |
| фосфат алюминия | AlPO4 | H3PO4 | фосфорная кислота |
| хлорид титана (IV) | TiCl4 | HCl | соляная кислота |
| фосфат кальция | Ca3(PO4)2 | H3PO4 | фосфорная кислота |
| сульфид железа (II) | FeS | H2S | сероводородная кислота |
| сульфат железа (II) | FeSO4 | H2SO4 | серная кислота |
| сульфит железа (II) | FeSO3 | H2SO3 | сернистая кислота |
| сульфат железа (III) | Fe2(SO4)3 | H2SO4 | серная кислота |
| сульфид серебра | Ag2S | H2S | сероводородная кислота |
| сульфат меди (II) | CuSO4 | H2SO4 | серная кислота |
| сульфит калия | K2SO3 | H2SO3 | сернистая кислота |
| сульфат магния | MgSO4 | H2SO4 | серная кислота |
| сульфид цинка | ZnS | H2S | сероводородная кислота |
| карбонат железа (II) | FeCO3 | H2CO3 | угольная кислота |
| нитрат железа (III) | Fe(NO3)3 | HNO3 | азотная кислота |
| ацетат магния | (CH3COO)2Mg | CH3COOH | уксусная кислота |
| хлорид бария | BaCl2 | HCl | соляная кислота |
| бромид калия | KBr | HBr | бромоводородная кислота |
| иодид натрия | NaI | HI | иодоводородная кислота |
| ацетат свинца (II) | (CH3COO)2Pb | CH3COOH | уксусная кислота |
| фосфат калия | K3PO4 | H3PO4 | фосфорная кислота |
| ацетат цезия | CH3COOCs | CH3COOH | уксусная кислота |
| нитрит бария | Ba(NO2)2 | HNO2 | азотистая кислота |
| карбонат аммония | (NH4)2CO3 | H2CO3 | угольная кислота |
| хлорат калия | KClO3 | HClO3 | хлорноватая кислота |
| перхлорат калия | KClO4 | HClO4 | хлорная кислота |
| селенат натрия | Na2SeO4 | H2SeO4 | селеновая кислота |
| метафосфат натрия | NaPO3 | HPO3 | метафосфорная кислота |
Источник: gomolog.ru
Серебро, переосаждение
Хлорид серебра и сульфид натрия ионное уравнение
Хлорид серебра это химическое вещество состоящее из серебра и хлора, сложное вещество, в природе встречается в виде минералов хлораргирит (chlorargyrit) фото, синоним — роговая серебряная обманка.
Основное применение хлорида серебра в производстве некоторых органических веществ, лекарственных препаратов, светочувствительных компонентов и т.д.

Что такое хлорид серебра (AgCl)
Это белый порошок который на свету темнеет становясь серым , при нагревании плавится становясь жёлто — коричневым , при дальнейшем нагревании кипит без разложения.
Не растворим в воде и не образует кристаллогидратов. С концентрированными гидратом аммиака , образуя комплексное соединение.

Температура плавления — 455°C
Температура кипения — 1554°C
Состояние — Твёрдое
Молярная масса — 143,32г/моль
Плотность -5,56
Твёрдость -2,5
Получение в лабораторных условиях
Реакцией всех растворимых солей серебра с соляной кислотой :
Реакцией растворимых солей с солями хлоридов :
Нагреванием сульфида серебра с хлоридом натрия в кислороде при нагревании 600°C :
Хлорид серебра обладает слабыми свойствами фотолиза и медленно разлагается на свету на простые вещества серебро и хлор :
При температуре выше 450°C в присутствии щелочей разлагается получением простого вещества серебра , хлорида щелочного металла и кислорода :
4AgCl + 4КОН = 4КСl + 4Ag + O2 + 2Н2O
Нагревание до температуры свыше 850°C приводит к получению свободного вещества серебра , хлорида натрия , углекислого газа и кислорода :

Нагревание хлорида натрия с оксидом бария при температуре выше 330°C приводит к свободному серебру хлориду бария и кислороду :
4AgCl + 2BaO = 2BaCl2 + 4Ag + O2
Реакция с перекисью водорода , гидроксида калия ( разб . ) даёт свободное вещество серебро , хлорид калия и кислород :
С сульфидом натрия натрия при нагревании , получается сульфид серебра и хлорид натрия :
Фтор будучи более сильным галогеном чем хлор вытесняет его , образуя фторид серебра и хлор :

C концентрированным водным раствором аммиака образует комплексное соединение хлорид аммиакат серебра :
Соединение аммиакат серебра с ацетиленом дает стабильный ацетиленид серебра, который считается инициирующим взрывчатым веществом и работа с ним очень опасна так как ацетиленид легко детонирует от трения, удара и нагрева:
Единственный способ утилизации его реакция с серной кислотой.
Подобно ( нашатырному спирту ) реагирует с карбонатом аммония образуя комплексного соединения и углекислого газа :
Реакция с тиосульфатом натрия ( конц .) даёт комплексное соединение бис(тиосульфато)аргентат(I) и хлорид натрия :
Хлорид серебра реагирует солями цианидов ( конц .) образуя комплексные соединения и хлорид калия :
AgCl + 2KCN = K[Ag(CN)2] + KCl
Реакция с (тиоцианидом, роданидом, сульфоцианидом) калия даёт сложное комплексное соединение при комнатной температуре и хлорид калия :
Минерал хлорид серебра
Это минерал хлораргирит химический состав: Ag — 75,3%, Сl — 24,7%. В качестве примесей иногда присутствует Hg (Br, Cl).
В свежих образцах бесцветный, прибывание на свету окрашивает его вначале фиолетово-серый, а потом даже черный цвет.
Образуется в зоне окисления серебросодержащих месторождений, где ассоциирует с минералами серебра, меди, кальцитом, баритом и др.
Используется как руда в получении серебра и иногда как сопутствующие с ним вещества ртуть и бром.
Применение хлорида серебра
- В фотографической промышленности для получения светочувствительных компонентов.
- В производстве некоторых косметических средств на основе ионов серебра , борющихся с проблемной кожей в основном у молодёжи.
- Хлорид серебра используется в производстве лекарственных препараторов .
- В гомеопатии используется как материал с антибактериальными свойствами .
- Использование в производстве материала для линз в ИК — спектроскопии .
- Как промежуточный продукт в производстве серебра из руд содержащих сульфид серебра Ag2S .
- Применяется в производстве серебро органических соединений, например ацетиленид серебра и т.д.
Что мы узнали о хлориде серебра?
- Что такое хлорид серебра
Это химическое соединение в состав которого входит серебро и хлор.
Какого цвета осадок хлорида серебра
Хлорид серебра (I) в расплавленном виде, имеет желто–коричневый цвет. Расплав хлорида серебра (I) после остывания, образует полупрозрачную массу, которая в обиходной речи, иногда называется как — «роговое серебро».
Как из AgCl получить серебро
Для этого нужно прореагировать его с перекисью водорода в присутствии гидроксида калия.
Есть минерал в состав которого входит хлорид серебра
Это минерал называется хлораргирит, в его химическую формулу могут входить и другие химические элементы такие как ртуть и бром
Статья на тему хлорид серебра
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Реакция взаимодействия хлорида серебра (I) и сульфида натрия
Реакция взаимодействия хлорида серебра (I) и сульфида натрия
Уравнение реакции взаимодействия хлорида серебра (I) и сульфида натрия:
Реакция взаимодействия хлорида серебра (I) и сульфида натрия.
В результате реакции образуются сульфид серебра (I) и хлорид натрия.
Реакция протекает при нормальных условиях.
Формула поиска по сайту: 2AgCl + Na2S → Ag2S + 2NaCl.
Реакция взаимодействия оксида железа (III) и водорода
Реакция взаимодействия железа, воды, кислорода и оксида углерода (IV)
Реакция взаимодействия нитрата серебра (I) и сероводорода
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Каковы свойства комплексных солей серебра
(аммиакат серебра, дицианоаргентат(I) калия)
Задача 990.
Почему аммиакат серебра неустойчив в кислых средах?
Решение:
Аммиакат серебра или гидроксид диамминсеребра(I) имеет формулу: [Ag(NH3)2]OH. В водном растворе соли содержатся ионы Ag + и OH¯. В присутствии кислоты появляется избыток ионов Н+, которые связываясь с ионами ОН ¯ , образуют воду (Н + + ОН ¯ = Н2О), а ионы Ag + , связываясь с ионами кислотного остатка, образуют малорастворимое вещество (или AgГ или Аg2SO4), которые будут выпадать в осадок. Уравнение реакции аммиаката серебра с соляной кислотой:
Задача 991.
Чем объяснить, что при действии хлорида натрия на раствор соли К[Аg(СN)2] не получается осадка хлорида серебра, тогда как сульфид натрия с тем же раствором дает осадок Аg2S?
Решение:
Соль К[Аg(СN)2] имеет константу нестойкости иона [Аg(СN)2] ¯ (КН) равную 1,4 . 10 -20 , поэтому диссоциация соли протекает пол схеме:
Таким образом, при вливании раствора хлорида натрия раствор соли К[Аg(СN)2] в смеси будут находиться ионы К + , Ag + , Na+, CN ¯ , Cl ¯ , [Аg(СN)2] — , которые не связываются друг с другом с образованием осадка хлорида серебра. Объясняется это тем, что КН([Аg(СN)2]-) намного меньше, чем ПР(AgCl) (1,4 . 10 -20 . 10 -10 ), поэтому в растворе смеси будут присутствовать несвязывающиеся К + , Ag + , Na + , CN ¯ , Cl ¯ , [Аg(СN)2] ¯ ионы.
При вливании раствора сульфида натрия в раствор соли К[Аg(СN)2] в смеси будут присутствовать ионы К+, Ag+, Na+, CN ¯ , S 2- , [Аg(СN)2] ¯ . Так как ПР(Ag2S) ¯ ), то ионы Ag + и S 2- будут связываться друг с другом с образованием осадка Ag2S:
Задача 992.
Объяснить, почему АgС1, АgВг и АgI хорошо растворяются в растворе КCN, а в растворе аммиака растворимы только АgС1 и АgВг.
Решение:
Если к осадкам АgС1, АgВг и АgI прилить раствор КCN, то наблюдается их растворение. Объясняется это тем, что концентрация ионов галогенида (Г ¯ ) определяется величиной произведения растворимости. Как только для одного из них она почему-то уменьшится, соответствующая часть осадка перейдёт в раствор.
Поэтому, вводя в жидкость над осадком те или иные вещества, образующие с одним из ионов малорастворимого соединения комплексный ион, можно во многих случаях достичь растворения осадка за счёт комплексообразования. Добиться этого тем легче, чем больше отвечающая данному осадку величина произведения растворимости. Например, осадки АgС1 (ПР = 1,8 . 10 -10 ), АgВг (ПР = 5,3 .
10 -13 ), АgI(ПР = 1,5 . 10 -16 ) легко растворяются в избытке KCN, так как в данном случае концентрация ионов Ag+ будет достаточной для образования устойчивого комплексного иона [Ag(CN)2]+, константа нестойкости которого равна 8 . 10 -22 , что значительно меньше, чем произведения растворимости всех трёх галогенидов серебра.
Однако, если заменить раствор KCN раствором NH3, то AgI не растворится в отличие от AgCl и AgBr. Объясняется это тем, что комплексный ион [Ag(NН3)2] + (КН = 9,31 . 10 -8 ) менее устойчив, чем комплексный ион [Ag(CN)2] + (КН = 8 . 10-22), так как концентрация ионов Ag + будет недостаточной для образования комплексного иона (ПР(AgI) + ).
Источник: all-equa.ru
Сульфид серебра
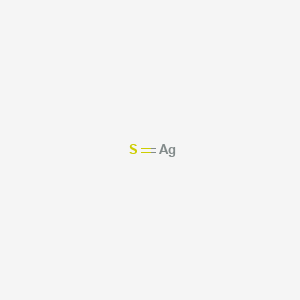
Сульфид серебра (Ag2S) – неорганическое химическое бинарное соединение, представляющее собой соль серебра и сероводородной кислоты. В природе встречается в виде минералов акантита, аргентита и маккинстриита, имеет физическую форму твердого вещества, окрашенного в серо-черный цвет, хорошо растворяется в воде, в очень тонких пленках придает металлическому серебру едва розовую окраску. Соединение полностью нерастворимо в этаноле. Руды, которые содержат сульфид серебра являются одним из видом сырья для промышленного получения металлического серебра, сульфид серебра в чистом виде является компонентом твердых электролитов и полупроводниковых материалов.
CAS: 21548-73-2
Синонимы: Моносульфид серебра, SILVER SULFIDE, CID197905, LS-145406, 12249-63-7
| Химическая формула: | Ag2S | Молярная масса: | 247.80100 [g/mol] |
Источник: 25region.com