Сульфи́д серебра́(I) — химическое вещество с химической формулой A g 2 S S> > , принадлежащее классу бинарных соединений, также может рассматриваться как соль серебра и сероводородной кислоты.
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Переведение в раствор
- 3.2 Восстановление серебра
Нахождение в природе
Сульфид серебра в природе встречается в виде минералов акантита, аргентита и маккинстриита. Основные свойства этих минералов представлены в таблице.
| Ag2S | Ag2S | Ag1,2Cu0,8S |
| серо-чёрный | темно-серый | чёрный |
| моноклинная | ромбическая | ромбическая |
| 7,326 | 7,317 | 6,61 |
| 2 — 2,5 | 2 — 2,5 | 1,5 — 2,5 |
Физические свойства
Сульфид серебра — твердое вещество серо-чёрного цвета, является наименее растворимым в воде соединением серебра. Нерастворим в этаноле [4] .
Ag2S существует в трёх кристаллических модификациях:
- α-Ag2S, моноклинная сингония, пространственная группаP 21/c, a = 0,4231 нм, b = 0,6930 нм, c = 0,9526 нм, β = 125,48°, Z = 8, d = 7.317 г/см³;
- β-Ag2S, кубическая сингония, пространственная группаI m3m, a = 0,4884 нм, Z = 2, d = 7.2 г/см³;
- γ-Ag2S, кубическая сингония, пространственная группаP n3, a = 0,634 нм, Z = 4, d = 6.42 г/см³.
Температуры фазовых переходов α→β 176,3 °C, β→γ 592 °C. Сульфид серебра склонен к образованию нестехиометрических соединений Ag2Sx, где x=~1, свойства которых могут сильно отличаться от стехиометрических.
Химические свойства
Переведение в раствор
Сульфид серебра не реагирует с кислотами при комнатной температуре.
При нагревании растворяется в концентрированной азотной кислоте:
A g 2 S + 10 H N O 3 ⟶ 2 A g N O 3 + H 2 S O 4 + 8 N O 2 ↑ + 4 H 2 O S+10 HNO_longrightarrow 2 AgNO_+ H_SO_+8 NO_uparrow +4 H_O> >
За счет комплексообразования растворяется при комнатной температуре в концентрированных растворах цианидов:
A g 2 S + 4 K C N ⇄ 2 K [ A g ( C N ) 2 ] + K 2 S S+4 KCNrightleftarrows 2 K[Ag(CN)_]+ K_S> > 2 A g 2 S + 8 K C N + 2 O 2 + H 2 O ⟶ 4 K [ A g ( C N ) 2 ] + K 2 S O 3 S + 2 K O H <displaystyle mathrm <2 Ag_S+8 KCN+2 O_+ H_Olongrightarrow 4 K[Ag(CN)_]+ K_SO_S+2 KOH> >
Восстановление серебра
Следующие реакции сульфида серебра приводят к восстановлению металлического серебра:
Нагревание в токе кислорода до 500—600 °C:
A g 2 S + O 2 ⟶ 2 A g + S O 2 S+ O_longrightarrow 2 Ag+ SO_> >
Нагревание с сульфатом серебра выше 300 °C:
A g 2 S + A g 2 S O 4 ⟶ 4 A g + 2 S O 2 S+ Ag_SO_longrightarrow 4 Ag+2 SO_> >
Восстановление с помощью алюминия в концентрированном горячем растворе щёлочи:
алюминий растворяется в щёлочи с образованием атомарного водорода:
A l + N a O H + 3 H 2 O ⟶ N a [ A l ( O H ) 4 ] + 3 H 0 Olongrightarrow Na[Al(OH)_]+3 H^> >
атомарный водород восстанавливает серебро из сульфида:
A g 2 S + 2 H 0 + 2 N a O H ⟶ 2 A g ↓ + 2 H 2 O + N a 2 S S+2 H^+2 NaOHlongrightarrow 2 Agdownarrow +2 H_O+ Na_S> >
Сульфид серебра может быть получен следующими способами.
Прямым синтезом из простых веществ при температуре выше 200 °C:
Окислением металлического серебра сероводородом в присутствии влаги или кислорода воздуха:
2 A g + H 2 S ⟶ A g 2 S + H 2 Slongrightarrow Ag_S+ H_> > 4 A g + 2 H 2 S + 2 O 2 ⟶ 2 A g 2 S + 2 H 2 O <displaystyle mathrm <4 Ag+2 H_S+2 O_longrightarrow 2 Ag_S+2 H_O> >
Осаждением из растворов с помощью реакций ионного обмена, например:
2 A g N O 3 + N a 2 S ⟶ 2 N a N O 3 + A g 2 S ↓ + Na_Slongrightarrow 2 NaNO_+ Ag_Sdownarrow > >
Применение
Руды, содержащие сульфид серебра, являются одним из видов сырья для промышленного получения металлического серебра. Чистый сульфид серебра применяется как компонент твёрдых электролитов, полупроводниковых материалов [5] .
Сульфид серебра используется в качестве катализатора в некоторых реакциях [6] .
Токсичность
При попадании в глаза вызывает раздражение. При длительном контакте с кожей может вызывать аргирию.
Токсично для рыб: LC50 для Pimephales promelas составляет 13 мг/л в течение 96 ч.
Примечания
Это статья-заготовка о неорганическом веществе. Помогите Википедии, дополнив эту статью, как и любую другую.
Источник: wi-ki.ru
Сульфид серебра — Silver sulfide
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа).
Сульфид серебра является неорганическое соединение с формулой Ag
2 S . Плотное черное твердое вещество, единственное сульфид из Серебряный. Это полезно как фотосенсибилизатор в фотография. Он составляет тускнеть который со временем образуется на серебряных изделиях и других серебряных предметах. Сульфид серебра нерастворимый в большинстве растворителей, но разлагается сильными кислотами. Сульфид серебра представляет собой сетчатое твердое тело, состоящее из серебра (электроотрицательность 1,98) и серы (электроотрицательность 2,58), где связи имеют низкоионный характер (примерно 10%).
- 1 Формирование
- 2 Структура и свойства
- 3 История
- 4 использованная литература
- 5 внешние ссылки
Формирование
Сульфид серебра естественным образом образует потускнение на серебряных изделиях. В сочетании с серебром, сероводород образует слой черного сульфида серебра. патина на серебре, защищая внутреннее серебро от дальнейшего превращения в сульфид серебра. [8] Серебряный усы может образовываться, когда сульфид серебра образуется на поверхности серебряных электрических контактов, работающих в атмосфере, богатой сероводородом и высокой влажностью. [9] Такая атмосфера может существовать на очистных сооружениях и на бумажных фабриках. [10] [11]
Структура и свойства
Три формы известны: моноклинические акантит (β-форма), стабильная ниже 179 ° C, объемно-центрированная кубическая так называемая аргентит (α-форма), стабильная при температуре выше 180 ° C и высокотемпературная гранецентрированная кубическая (γ-форма), стабильная при температуре выше 586 ° C. [5] Формы с более высокой температурой являются электрическими проводниками. Встречается в природе как минерал с относительно низкой температурой. акантит. Акантит — важная руда серебра. Моноклинная форма акантита включает два типа центров серебра: один с двумя, а другой с тремя ближайшими соседними атомами серы. [12] Аргентит относится к кубической форме, которая, из-за нестабильности при «нормальных» температурах, находится в форме псевдоморфоз акантита после аргентита.
История
В 1833 г. Майкл Фарадей заметил, что сопротивление сульфида серебра резко снижается при повышении температуры. Это был первый отчет о полупроводниковом материале. [13]
Сульфид серебра входит в состав классических качественный неорганический анализ. [14]
использованная литература
- ^ аб Лиде, Дэвид Р., изд. (2009). CRC Справочник по химии и физике (90-е изд.). Бока-Ратон, Флорида: CRC Press. ISBN978-1-4200-9084-0 .
- ^ абcdСигма-Олдрич Ко., Сульфид серебра. Проверено 13 июля 2014.
- ^ абcd Тонков, Е.Ю. (1992). Фазовые превращения под высоким давлением: Справочник. 1. Издательство Gordon and Breach Science. п. 13. ISBN978-2-88124-761-3 .
- ^ Коми, Артур Мессинджер; Хан, Дороти А. (февраль 1921 г.). Словарь химической растворимости: неорганические вещества (2-е изд.). Нью-Йорк: Компания MacMillan. п.835.
- ^ абcdе«Кристаллическая структура сульфида серебра (Ag2S)». Элементы с нететраэдрической связью и бинарные соединения I. Ландольт-Бёрнштейн — Конденсированное вещество III группы. 41C. Springer Berlin Heidelberg. 1998. С. 1–4. Дои:10.1007/10681727_86. ISBN978-3-540-31360-1 .
- ^ абcd Прадёт, Патнаик (2003). Справочник неорганических химикатов. Компании McGraw-Hill, Inc. стр. 845. ISBN978-0-07-049439-8 .
- ^«Паспорт безопасности сульфида серебра». saltlakemetals.com. Юта, США: Солт-Лейк-Металс . Получено 2014-07-13 .
- ^ Zumdahl, Steven S .; ДеКост, Дональд Дж. (2013). Химические принципы (7-е изд.). п. 505. ISBN978-1-111-58065-0 .
- ^«Деградация силовых контактов в промышленной атмосфере: коррозия серебра и усы» (PDF) . 2002.
- ^ Dutta, Paritam K .; Рабай, Корнил; Юань, Чжиго; Розендаль, Рене А .; Келлер, Юрг (2010). «Электрохимическое удаление и восстановление сульфидов из стоков анаэробной очистки бумажной фабрики». Водные исследования. 44 (8): 2563–2571. Дои:10.1016 / j.watres.2010.01.008. ISSN0043-1354. PMID20163816.
- ^«Контроль образования сероводорода | Сбор воды и отходов». www.wwdmag.com . Получено 2018-07-05 .
- ^ Фру, А. Дж. (1958). Кристаллография сульфида серебра Ag2S. Zeitschrift für Kristallographie-Crystalline Materials, 110 (1-6), 136-144.
- ^«1833 — зарегистрирован первый полупроводниковый эффект». Музей истории компьютеров . Получено 24 июн 2014 .
- ^Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN978-0-08-037941-8 .
внешние ссылки
- Потускнение серебра: краткий обзор Журнал сохранения Виктории и Альберта
- Изображения серебряных усов НАСА
Источник: wikiaro.ru
Серебра сульфид
СЕРЕБРА СУЛЬФИД Ag2 S, серо-черные кристаллы; существует в трех модификациях (см. табл.)-фазах переменного состава; область гомогенности для b -Ag2 S ~ 33,31 — 33,33 ат. % S (177 °С), для g -Ag2 S — 32,36 — 37,04 ат.% S (727 °С). Практически не раств. в воде, орг. р-рителях, водном аммиаке, разлагается водным р-ром KCN или царской водкой. При нагр. в вакууме диссоциирует на Agтв и пары S, ур-ние температурной зависимости давления пара S lgp (мм рт. ст.) = — 13082/Т + 9,24. При нагр. на воздухе окисляется, a -Ag2 S-полупроводник; фоточувствителен; подвижность электронов 63,5 см 2 /(В·с), дырок 19,0 см 2 /(В·с); r 1000 Ом·см; коэф. термоэдс —1000 мкВ/К; теплопроводность 7,52 Вт/(см·К). b -Ag2 S имеет r 10 -3 Ом·см; коэф. термоэдс — 60 мкВ/K.
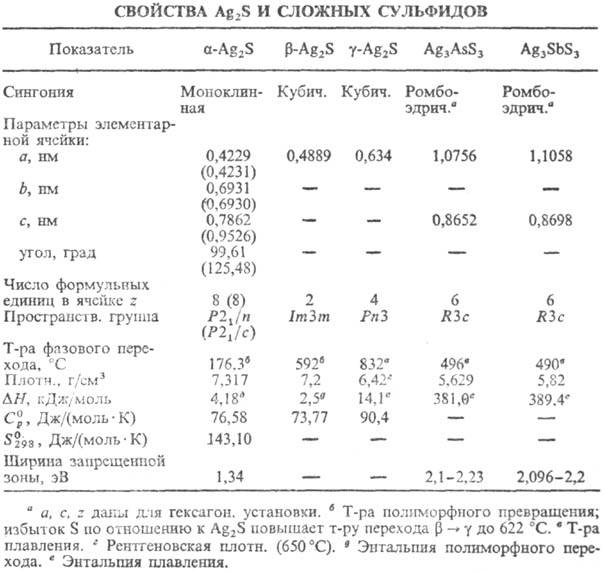
С. с. встречается в природе в виде минералов акантита a -Ag2 S и аргентита b -Ag2 S.
С. с. получают взаимод. Ag с S либо в вакуумир. кварцевых ампулах, либо р-цией расплавл. или твердого Ag с парами S или с парами S в потоке Аr, N2 , а также осаждением сероводородом из водного р-ра AgNO3 .
Сложные С.с.-соед. Ag2 S.c сульфидами As, Sb, Bi, Si, Ge, Ga, In и др. Наиб. важны из них тритиоантимонат Ag3 SbS3 (темно-малиновые кристаллы) и тритиоарсе-нат Ag3 AsS3 (красные кристаллы); не раств. в воде и орг. р-рителях; получают сплавлением Ag2 S с Sb2 S3 (или As2 S3 ) либо Ag с S и Sb (As). Встречаются в природе в виде минералов пираргирита Ag3 SbS3 и прустита Ag3 AsS3 .
Применяют Ag2 S как компонент твердых электролитов, полупроводниковых материалов, для осаждения Ag + из р-ров; Ag3 SbS3 и Ag3 AsS3 — материалы для электрооптич. и электроакустич. устройств. Руды, содержащие акантит, аргентит, прустит, пираргирит,-сырье для получения Ag.
Лит.: Самсонов Г. В., Дроздова С. В., Сульфиды, М., 1972, с. 38-41; Полупроводниковые халькогениды и сплавы на их основе, М., 1975; Вапю-ков А. В., Исакова Р. А., Быстрое В. П., Термическая диссоциация сульфидов металлов, А.-А., 1978. И. Н. Один.
Источник: www.medpulse.ru