СУРЬМА (от тур. surme; лат. stibium) Sb, хим. элемент V гр. периодич. системы, ат. н. 51, ат. м. 121,75. Природная сурьма-смесь двух изотопов: 121 Sb (57,25%) и 123 Sb (42,75%). Поперечное сечение захвата тепловых нейтронов 5,7 x 10 -28 м 2 . Конфигурация внеш. электронной оболочки атома 5s 2 5p 3 ; степени окисления +3 и +5, редко — 3; энергии ионизации при последоват. переходе от Sb 0 к Sb 5+ 8,64, 16,5, 25,3, 44,1, 60 эВ; сродство к электрону 0,94 эВ; электроотрицательность по Полингу 1,9; атомный радиус 0,161 нм, ионные радиусы, нм (в скобках указаны коорди-нац. числа): Sb 3+ 0,090 (4), 0,94 (5), 0,090 (6), Sb 5+ 0,074 (6).
Содержание сурьмы в земной коре 5·10 -5 % по массе, в морской воде менее 5·10 -4 мг/л. Известно ок. 120 сурьмяных минералов, из них важнейшие-антимонит Sb 2 S 3 , самородная сурьма, тетраэдрит Cu 12 Sb 4 S 13 , джемсонит Pb 4 FeSb 6 S 14 , бертьерит FeSb 2 S 4 , валентинит и сенармонтит Sb 2 O 3 , сер-вантит Sb 2 O 4 , кермезит Sb 2 S 2 O. Наряду с собств. рудами (антимонитовыми или с самородной сурьмой) используют сурь-мяно-ртутные, медно-сурьмяные (тетраэдритовые), золото-сурьмяные, сурьмяно-вольфрамовые руды. Попутно сурьму извлекают из свинцовых концентратов, полученных из по-лиметаллич. руд.
Сурьма: древнейшая подводка для глаз
Свойства. Сурьма-серебристо-белый металл с синеватым оттенком, грубозернистого строения. При обычном давлении существует SbI, кристаллич. решетка тригональная (ром-боэдрич.) слоистая, а — 0,45064 нм, a = 57,1°, z = 2, пространств. группа R3m. При давлении ~5,5 ГПа SbI превращ. в кубич. модификацию SbII, при 8,5 ГПа-в гексагональную SbIII, при давлениях выше 28 ГПа-в SbIV.
Известны три аморфные модификации сурьмы. Желтая сурьма образуется при действии О 2 на жидкий SbH 3 ; содержит химически связанный Н. При нагр., а также при освещении видимым светом переходит в черную сурьму с плотн. 5,3 г/см 3 , к-рая м. б. получена при конденсации паров сурьмы; черная сурьма обладает полупроводниковыми св-вами.
Взрывчатая сурьма-серебристо-белая, с металлич. блеском; плотн. 5,64-5,97 г/см 3 ; образуется при электролизе SbCl 3 при малой плотности тока; содержит связанный Сl; взрывается при ударе и трении. Черная сурьма при нагр. до ~400°С без доступа воздуха, а взрывчатая сурьма при растирании или ударе со взрывом превращ. в металлическую сурьму.
Для металлической сурьмы: т. пл. 630,5 °С, т. кип. 1634 °С; плотн.
6,69 г/см 3 , для жидкой сурьмы (при т-ре плавления) 6,65 г/см 3 ;  25,2 Дж/(моль·К);
25,2 Дж/(моль·К); 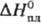 20,1 кДж/моль,
20,1 кДж/моль, 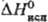 124,4 кДж/моль;
124,4 кДж/моль;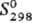 45,7 Дж/(моль · К); ур-ния температур ной зависимости давления пара: для кристаллической сурьмы lgp(мм pт.cт.)=40,916-13570/T+8,592lgT + 1,521T (298-904 К), для жидкой сурьмы lgр(мм рт.ст.) = 3,442-6007/T— 0,789lgT(904-1907 К), в парах в осн. присутствуют молекулы Sb, и Sb 4 ; температурный коэф. линейного расширения 9,2·10 -6 K -1 (273 К); теплопроводность 18,8 Вт/(м·К) при 298 К; r 0,39 мкОм·м (273 К), температурный коэф. r 4,73·10 -3 K -1 (273-373 К); т-ра перехода в сверхпроводящее состояние 2,7 К; диамагнитна, магн. восприимчивость —0,81·10 -9 . Твердость по Моосу 3, по Бринеллю 260 МПа; модуль упругости 55,98 ГПа; d раст 5 МПа, s ж 84 МПа. Хрупка, но выше 310 °С становится пластичной. Монокристаллы высокой чистоты пластичны.
45,7 Дж/(моль · К); ур-ния температур ной зависимости давления пара: для кристаллической сурьмы lgp(мм pт.cт.)=40,916-13570/T+8,592lgT + 1,521T (298-904 К), для жидкой сурьмы lgр(мм рт.ст.) = 3,442-6007/T— 0,789lgT(904-1907 К), в парах в осн. присутствуют молекулы Sb, и Sb 4 ; температурный коэф. линейного расширения 9,2·10 -6 K -1 (273 К); теплопроводность 18,8 Вт/(м·К) при 298 К; r 0,39 мкОм·м (273 К), температурный коэф. r 4,73·10 -3 K -1 (273-373 К); т-ра перехода в сверхпроводящее состояние 2,7 К; диамагнитна, магн. восприимчивость —0,81·10 -9 . Твердость по Моосу 3, по Бринеллю 260 МПа; модуль упругости 55,98 ГПа; d раст 5 МПа, s ж 84 МПа. Хрупка, но выше 310 °С становится пластичной. Монокристаллы высокой чистоты пластичны.
Сурьма устойчива на воздухе, выше ~600°С окисляется с образованием Sb 2 O 3 (см. Сурьмы оксиды). Не реагирует с N 2 , С, Si, В. Активно реагирует с галогенами, кроме F 2 , измельченная горит в атмосфере Сl 2 (см. Сурьмы галогениды). При сплавлении соединяется с S, Sе, Те (см.
Сурьмы халько-гениды), Р. При сплавлении с большинством металлов образует антимониды. Не реагирует с соляной и фтористоводородной к-тами, разб. H 2 SO 4 . Раств. в конц. Н 2 SО 4 с образованием Sb 2 (SО 4 ) 3 , конц. HNO 3 окисляется до сурьмяной к-ты H[Sb(OH) 6 ]. Легко раств. в царской водке, в смеси азотной и винной к-т.
Р-ры щелочей и NH 3 на сурьму не действуют, расплавл. щелочи ее растворяют с образованием антимонатов.
Соли сурьмы легко гидролизуются. Осаждение гидроксисолей начинается при рН 0,5-0,8 для Sb(III) и рН 0,1 для Sb(V), полное осаждение достигается соотв. при рН 2,2 и 1. Соед., образующиеся при гидролизе Sb(III), содержат катион анти-монил SbO + .
Оксидам, галогенидам, халькогенидам сурьмы, а также анти-монидам посвящены отдельные статьи. Из прочих соединений сурьмы наиб. важны следующие. Гидрид (стибин) SbН 3 -бесцв. газ; т. пл. -92,4°С, т. кип. — 18,3°С; получают действием НС1 на антимониды Mg или Zn или солянокислого р-ра SbCl 3 на NaBH 4 ; медленно разлагается при комнатной т-ре, быстро при 150 °С; легко окисляется, горит на воздухе; мало раств. в воде; используют для получения сурьмы высокой чистоты; высокотоксичен.
Сульфат Sb 2 (SО 4 ) 3 -бесцв. кристаллы с шелковистым блеском; плотн. 3,62 г/см 3 ; очень гигроскопичен, расплывается на воздухе, водой гидролизуется до сульфата анти-монила (SbO) 2 SO 4 и др. основных сульфатов; при 500 °С полностью разлагается; компонент пиротехн. составов. Ниобат SbМbО 4 -бесцв. кристаллы с ромбич. решеткой (а = 0,5561 нм, b = 0,4939 нм, с=1,1810 нм, z = 4, пространств. группа Pna2 1 ); плотн. 5,68 г/см 3 ; получают спеканием оксидов Sb и Nb или гидротермальным путем; сег-нетоэлектрик, т-ра Кюри 410 °C.
Гидроксооксалат Sb(С 2 О 4 )ОН-бесцв. кристаллы; выше 275 °С разлагается с получением мелкодисперсной Sb 2 О 3 ; не раств. в воде и орг. р-рителях; получают действием щавелевой к-ты на р-р SbС1 3 ; протрава при крашении.
Лактат Sb(СН 3 СНОНСОО) 3 -бесцв. кристаллы, не раств. в воде; получают. взаимод. Sb(ОН) 3 с молочной к-той; фиксатор в ситцепечатании, протрава при гравировании.
Антимонилтартрат калия К(SbО)(С 4 Н 4 О 6 )-0,5Н 2 О («рвотный камень»)-бесцв. кристаллы; плотн. 2,7 г/см 3 ; хорошо раств. в воде; получают кипячением Sb 2 О 3 с р-ром гидротартрата К; протрава при крашении.
При спекании Sb 2 О 3 с оксидами или карбонатами металлов без доступа воздуха образуются антимонаты(III) (или антимониты). Антимонаты щелочных металлов, в особенности К, раств. в воде, их р-ры-сильные восстановители. Все остальные антимонаты в воде не растворяются. При нагр. на воздухе окисляются до антимонатов(V). Известны метаантимонаты(III), напр.
КSbО 2 , ортоантимонаты(III), как Na 3 SbO 3 , и полиантимонаты, напр. NaSb 5 O 8 , Na 2 Sb 4 O 7 . Для РЗЭ характерно образование ортоантимонатов LnSbO 3 , а также Ln 3 Sb 5 O 12 . Антимонаты N i, Мn и др.-катализа-торы в орг. синтезе (р-ции окисления и поликонденсации), антимонаты РЗЭ-люминофоры.
Гексагидроксоантимонаты(V)—соли гексагидроксо-сурьмяной к-ты НSb(ОН) 6 . Из них соли щелочных металлов мало раств. в воде, все остальные-не растворяются. Получены для щелочных, мн. двухвалентных, редкоземельных металлов. При нагр. они обезвоживаются с образованием метаантимонатов(V), напр. М 1 SbО 3 . Гексагидроксоанти-монат калия КSb(ОН) 6 -кристаллич. или аморфное в-во; раств. в воде (2,7% по массе при 20 °С), не раств. в этаноле и ацетоне; получают взаимод. Sb 2 S 3 с КОН и СиО в присут. воды; применяют для получения антимонатов(V), как реагент для обнаружейия ионов Na + . Гексагидроксоанти-монат натрия NaSb(OH) 6 в воде почти не раств. (0,1% по массе при 20 °С); получают при выщелачивании щелочных сплавов рафинирования свинца с послед. очисткой; используют как компонент шихты для эмалей, окислитель в орг. синтезе.
При действии р-ра КSb(ОН) 6 на р-ры солей Al, Cr, Zr, Th, Sn и др. металлов, а также при совместном гидролизе SbСl 5 с хлоридами Ti, Nb и др. образуются рентгеноаморфные полимерные антимонаты переменного состава. Их используют как химически- и радиационно-стойкие селективные катионообменники. К этим соед. близки гетерополикисло-ты-сурьмяно-фосфорная, сурьмяно-кремниевая и др. Это тоже полимерные в-ва переменного состава, используемые как ионообменники.
Безводные антимонаты(V) получают обычно спеканием оксидов или карбонатов металлов с оксидами сурьмы на воздухе. Для одновалентных металлов характерно образование мета-МSbО 3 и ортоантимонатов М 3 SbО 4 , для двухвалентных-мета- и пироантимонатов М 2 Sb 2 О 7 , для трехвалентных-ортоантимонатов, напр. InSbO 4 .
Пироантимонат свинца Рb 2 Sb 2 О 7 -оранжево-желтые кристаллы; разлагается выше 600 °С; не раств. в воде, неорг. к-тах и р-рах щелочей, раств. в царской водке; получают сплавлением Pb(NO 3 ) 2 с антимонилтартратом К и NaCl; используют как пигмент (неаполитанский желтый) для керамики.
Известны антимонаты, в к-рых одновременно присутствует как Sb(III), так и Sb(V). Их примером Служит серия соед. Na 2 Sb 2 O 5 , NaSb 3 O 7 и NaSb 5 O 9 со структурой типа пиро-хлора. См. также Сурьмаорганические соединения.
Получение. Сурьмяные руды обогащают с использованием гравитационных и флотационных методов. Для получения сурьмы чаще используют пирометаллургич. процессы — осадить плавку с железом или (для частично окисленных руд или руд, содержащих драгоценные металлы) окислить обжиг с возгонкой Sb 2 О 3 , к-рый далее подвергают восстановить плавке.
В обоих случаях в качестве флюсов применяют Na 2 CO 3 , Na 2 SO 4 или NaCl. Известны также реакц. плавка, основанная на р-ции Sb 2 S 3 + 2Sb 2 O 3 : 6Sb + 3SO 2 , содовая плавка 2Sb 2 S 3 + 6Na 2 CO 3 + 3С : 4Sb + 6Na 2 S + 6CO 2 , a также щелочная плавка. Гидрометаллургич. способ—выщелачивание р-ром Na 2 S с NaOH с послед. электролизом. Этот процесс применяют, в частности, к медно-сурьмяным тетра-эдритовым концентратам.
Рафинирование сурьмы огневым способом включает удаление Fe и Сu действием Sb 2 S 3 или S, щелочное рафинирование-от As и S, очистку от Na действием SiO 2 и разлив под слой расплава буры или NaSbO 2 («звездчатый шлак»). Для удаления Аu, Ag и Рb проводится электролитич. рафинирование с использованием сульфатно-фторидных калиево-щелочных р-ров. Сурьму высокой чистоты получают через про-межут. соед.-SbСl 3 или SbН 3 , очищаемые, напр., ректификацией. Применяют также электролитич. рафинирование с использованием глицериново-щелочного или ксилитово-щелочного электролита. Окончат. очистку сурьму осуществляют кристаллизац. методами, в частности зонной плавкой.
Определение. Для качеств. определения сурьмы используют эмиссионный спектральный анализ (характеристич. линии: 252,852; 259,806; 287,792; 323,252 нм), а также р-ции с Na 2 S 2 O 3 (образуется красно-оранжевый осадок Sb 2 OS 2 ), с родамином С или с метиловым фиолетовым (фиолетовое окрашивание).
Для количественного определения преимущественно используют титриметрические методы-броматометричес-кий, перманганатометрический и др., основанные на окислении Sb(III) до Sb(V), а также фотометрические с образованием желтого комплекса [SbI 4 ] — или с образованием соед. комплекса [SbCl 6 ]- с основными красителями (бриллиантовый зеленый, кристаллический фиолетовый, родамин С, метиленовый голубой и др.) и их экстракцией из р-ров.
Из гравиметрических методов применяют осаждение в виде Sb 2 S 3 из солянокислого р-ра, осаждение пирогаллолом и др. Используют также люминесцентный, поля-рографич., амперометрич., атомно-абсорбционный и др. методы.
Применение. Сурьма-компонент сплавов на основе Рb и Sn (для аккумуляторных пластин, типографских шрифтов, подшипников и др.), на основе Си и Zn, Sn (для художеств. литья). Чистую сурьму используют для получения антимонидов с полупроводниковыми св-вами. Из сурьмы получают оксид, сульфид и др. ее соединения.
Пыль и пары сурьмы вызывают носовые кровотечения, сурьмяную «литейную лихорадку», пневмосклероз, поражают кожу, нарушают половую функцию. Для пыли ПДК в воздухе рабочей зоны 0,5 мг/м 3 , в атм. воздухе 0,01 мг/м 3 , в почве 4,5 мг/кг, в воде 0,05 мг/л.
Мировое производство сурьмы (без СНГ) в концентратах 70000 т. Осн. страны-производители-Боливия, ЮАР, КНР, Мексика.
Сурьма известна с глубокой древности, в странах Востока ее применяли примерно за 3000 лет до н.э. Описание св-в и способов получения сурьмы, а также ее соед. впервые дано Василием Валентином в 1604.
Лит.: Сурьма, под ред. С. М. Мельникова, М., 1977; Немодрук А. А., Аналитическая химия сурьмы, М., 1978; Большаков К. А., Федоров П. И., Химия и технология малых металлов, М., 1984; Ищанходжаев С., Химия сурьмы и свинца, Таш., 1984; Полывянный И. Р., Лата В. А., Металлургия сурьмы, А.-А., 1991. П. И. Федоров.
Источник: xumuk.ru
Сурьма металл. Свойства сурьмы. Применение сурьмы
Впервые человечество начало использовать сурьму еще задолго до нашей эры. Ведь до сих пор археологи находят фрагменты или изделия из металлической сурьмы на местах древнего Вавилона, что соответствует началу ІІІ столетия до нашей эры. Как самостоятельный металл, сурьму редко применяют в производстве, а в основном в соединениях с другими элементами. Самое популярное применение, которое дошло и до наших времен – это использование минерала «сурьмяный блеск» в косметологии в качестве карандаша для век или краски для ресниц и бровей.

В периодической системе Д. И. Менделеева сурьма – химический элемент, который относится к V группе, его символ – Sb. Атомный номер 51, атомная масса 121,75, плотность составляет 6620 кг/м3. Свойства сурьмы – окрас серебристо-белый с синеватым оттенком. По своему строению, металл крупнозернистый и очень хрупкий, его легко можно вручную измельчить до состояния порошка в фарфоровой ступке и не поддается ковки . Температура плавления металла составляет 630,5 ⁰С, температура кипения — 1634 °C.
Кроме стандартной кристаллической формы, в природе существуют еще три аморфных состояния сурьмы:
- Взрывчатая сурьма – образуется при электролизе соединения SbCI3 в соляно кислой среде и при ударе или прикосновении взрывается, тем самым переходит в обычное состояние.
- Желтая сурьма – получается при воздействии молекул кислорода О2 на соединение водорода с сурьмой SbH3.
- Черная сурьма – образовывается при резком охлаждении паров желтой сурьмы.
В обычных условиях сурьма свойства свои не меняет, в воде не растворяется. Хорошо взаимодействует в виде сплава сурьмы с другими металлами, так как основное ее достоинство – это увеличение твердости металлов, например, соединение свинец — сурьма (от 5–15%) известно как гарбтлей. Даже если добавить к свинцу 1% сурьмы его прочность уже значительно увеличится.
Месторождение и добыча сурьмы
Содержание сурьмы в земной коре приблизительно оценивается в 6 млн тонн. Основным месторождением является Китай, на его территорию приходится до 52% мирового запаса этого элемента, остальные 48% распределены между странами, такими как Россия, Чехия, Словакия, Боливия, Мексика, Япония.

— Очень богатые, Sb – в пределах 50%.
— Богатые, Sb – не более 12%.
— Обыкновенные, Sb – от 2 до 6%.
— Бедные, Sb – максимум 2%.

К пирометаллургическим методам относятся осадительный и восстановительный плавильный процесс. В осадительном процессе плавки, главным сырьем служит сульфидные руды. Принцип плавки таков, при температуре 1300–1400 °С из сульфида сурьмы с помощью железа извлекается чистая сурьма, формула этого процесса –Sb2S3+3Fe=>2Sb+3FeS. Восстановительная плавка заключается в восстановлении из оксидов сурьмы до металла с помощью древесного угля или коксовой пылью. Гидрометаллургический метод извлечения сурьмы состоит из двух стадий – обработка руды с переводом ее в состояние раствора и извлечение металла из раствора.
Применение сурьмы
В чистом виде сурьма считается одним из самых хрупких металлов, но при сплаве с другими металлами она увеличивает их твердость и не происходит процесс окисления при обычных условиях. Эти достоинства заслуженно оценили в промышленной сфере, и теперь сурьма добавляется во многие сплавы, более 200.
Сплавы для подшипникового производства. В эту группу входят такие соединения, как олово – сурьма, свинец – сурьма, сурьма – медь, так как эти сплавы легко плавятся и очень удобно выливать в формы для вкладышей подшипников. Содержание сурьмы обычно составляет от 4 до 15%, но ни в коем случае, нельзя превышать эту норму, потому что избыток сурьмы придет к разламыванию металла. Свое применение такие сплавы нашли в танкостроении, авто и железнодорожном транспорте.

Одно из самых важных особенностей сурьмы является способность расширяться при затвердении. На основе этой характеристики и был создан сплав – свинец (82%), сурьма (15%), олово (3%), еще его называют «типографский сплав», ведь он прекрасно наполняет формы для разных видов шрифтов и делает четкие оттиски. В этом случае, сурьма добавила металлу ударную стойкость и износостойкость.
Свинец легированный сурьмой, используется в машиностроении, с него делают пластины для аккумуляторов также используется при производстве труб, желобов по которым будет происходить транспортировка агрессивных жидкостей. Сплав цинк – сурьма (антимонид цинка) считается неорганическим соединением. Благодаря своему свойству полупроводника, используется при изготовлении транзисторов, тепловизоров и инфракрасных детекторах.
Помимо промышленного использования сурьма нашла свое широкое применение в косметологии и медицине. С древних времен и по сегодняшний день используется сурьма для глаз, в качестве лечебного средства и краски для бровей и ресниц. Многие знают лечебные свойства сурьмы и при конъюнктивитах и прочих инфекциях глаз сразу применяют сурьму.
По своему виду и способу нанесения различают разные виды сурьмы – порошок, с помощью деревянной палочки он легко наносится на область века, но прежде необходимо смокнуть в любом масле; карандаш – идеально четко рисует стрелки на веке, карандаш эта тот же порошок сурьмы, только спрессованный в форму.

Если в древние времена краска из сурьмы была экологической чистой и приносила действительно лечебный эффект, то в наше время нужно быть предельно осторожным и внимательно читать состав перед покупкой. Все связано с тем, что сейчас недобросовестные производители некачественно извлекают чистую сурьму из руды и остаются примеси тяжелых металлов, таких как мышьяк. Трудно представить принесенный вред, организму человека от соединения мышьяк-сурьма.
Цена сурьмы
В связи, с нестабильной ситуацией на мировом рынке, нет однозначной стоимости на металл сурьма. Цена его колеблется в пределах от 6300$ до 8300$/тонну, за последние два месяца наблюдается отрицательная динамика роста цены, это напрямую связано с основным производителем – Китаем и его внешнеэкономическими отношениями.
А вот политические и экономические перипетии никак не повлияли на сурьму для глаз. Сейчас в моде восточная культура и прочие принадлежности, в том числе и сурьма. Купить ее труда не составит, так как есть огромный выбор в восточных лавках или же можно оформить заказ в интернет-магазине.
Источник: tvoi-uvelirr.ru
СУРЬМА — от красоты глаз до аккумуляторов
Сурьмяные подводки для г лаз с допотопных времен применяли в Египте. Причем делали это и женщины, и мужчины, и дети.
Абу-л-Фазл Тифлиси в труде «Описание ремесел» писал:
«Если будут постоянно смазывать веки сурьмой, то глаза будут здоровыми, приобретут блеск и пройдут всякие язвочки на веках».
Он же рекомендовал применять сурьмяные мази при ожогах, язвах матки, «горячих опухолях».

Металл или нет?
История элемента связана с алхимией. Именно она занимала место нынешней химии, пусть в усеченном виде. Алхимики насчитывали семь металлов, каждый был приписан к определенной планете. Сурьме не повезло — ей планеты не досталось. Поэтому этот элемент назвали полуметаллом (она и ковалась хуже, чем золото, например).
Нынешние химики в этом согласны с алхимией. Сурьму нельзя назвать полноценным металлом, зная ее свойства. Отличить этот «металл-неметалл» от полноценных металлов сложно.
Свойства

Химический элемент сурьма (Stibium, в русском произношении стибиум) — полуметалл, номер 51 в таблице Менделеева.
Выглядит сурьма, как металл — блеск, цвет, но… металл может быть хрупким. Стибиум вы растолчете в порошок в обычной ступке пестиком.
| Сурьма́ / Stibium (Sb), 51 |
| 121,760(1)[1] а. е. м. (г/моль) |
| [Kr] 4d10 5s2 5p3 |
| 159 пм |
| 140 пм |
| (+5e)62 (−3e)245 пм |
| 2,05 [2] (шкала Полинга) |
| 5, 3, −3 |
| 833,3 (8,64) кДж/моль (эВ) |
| 6,691 г/см³ |
| 903,9 K |
| 1908 K |
| 20,08 кДж/моль |
| 195,2 кДж/моль |
| 25,2[3] Дж/(K·моль) |
| 18,4 см³/моль |
| тригональная |
| ahex=4,307; chex=11,27[4] |
| 2,62 |
| 200 K |
| (300 K) 24,43 Вт/(м·К) |
| 7440-36-0 |
Рекомендуем: МЕЛЬХИОР — потерянный и обретенный
Интересные свойства этот химический элемент проявляет в своих аллотропных модификациях. Металлических модификаций 4, существуют при разных давлениях.
Кристаллическая модификация самая устойчивая, похожа на синеватый, белый, серебристый металл.
| Модификация элемента | Свойства |
| Жёлтая | При нагреве превращается в черную |
| Чёрная | Неустойчива; при понижении температуры переходит в кристаллическую |
| Взрывчатая | При ударе и трении взрывается |
У сурьмы в отличие от других металлов низкие тепло- и электропроводность. Расширяется при застывании (это неметаллическое свойство).
В природе состоит из двух изотопов.
Добыча
Существует самородная сурьма, но промышленного интереса она не представляет.
Сурьмяных руд в природе более сотни, но самая богатая антимонит (более 60% рудообразующего элемента).

Страны-обладатели крупнейших сурьмоносных месторождений:
- Китай;
- Таджикистан;
- ЮАР;
- Боливия;
- Мексика.
У России второе место в мире по добыче и производству сурьмяных концентратов.
Производство

В производстве бедные руды вначале обогащаются. Затем извлекают черновую сурьму пиро- или гидрометаллургическим способом. Для дальнейшего использования извлеченный полуметалл подвергают огневому рафинированию.
Сурьмяные сплавы
Их известно около 200.
С XV века до нынешних дней в типографии используют сплав гарт (свинец+сурьма+олово). Он же применяется в производстве труб для агрессивных (кислоты, щелочи) жидкостей.
Из сплавов AlSb, GaSb, InSb делают полупроводники.

Широко применяются баббиты — подшипниковые антифрикционные сплавы.
Сурьмяные сульфиды идут на вулканизацию каучука, для производства спичек, для изготовления особо прочной (эластичной и термостойкой) красной медицинской резины.
Применение
Большая часть производимой в мире сурьмы идет на производство сплавов для аккумуляторных батарей.
Сурьмовые соединения (оксиды, сульфиды) применяют в:
- Пиротехнике (производство трассирующих пуль).
- Химической промышленности (оргсинтез, производство неводного растворителя).
- Текстильной промышленности.
- Производстве жаропрочных эмалей, тканей, стекол, керамики.
Рекомендуем: МАГНИЙ — огненный металл
Стибиум используют в изготовлении пигментов и красок.
Для художников: краска «железная чернь» содержит большое количество чистой сурьмы.
Стибнит, или антимонит (Sb2S3) как издавна, так и сейчас в странах третьего мира применяют в медицине. Соединения сурьмы применяют для лечения лейшманиозов, сонной болезни.
Для женщин: сурьмовую подводку для глаз можно купить в аюрведических лавочках. На Востоке ее используют даже девочки: считается, что подводка приносит пользу при глазных болезнях, стимулирует рост бровей и ресниц.
Однако медики считают, что полуметалл ядовитый, и относят его ко II классу опасности.
Стоимость
Цена килограмма сурьмы в зависимости от ее чистоты колеблется от 2800 до 20000 рублей за килограмм (на 23.07.2020).
Похожие публикации





Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Источник: themineral.ru