Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Свинец обычно имеет грязно-серый цвет, хотя свежий его разрез имеет синеватый отлив и блестит. Однако блестящий металл быстро покрывается тускло-серой защитной пленкой оксида. Плотность свинца (11,34 г/см3) в полтора раза больше, чем у железа, вчетверо больше, чем у алюминия; даже серебро легче свинца.
Свинец очень легко плавится – при 327,5° С, кипит при 1751° С и заметно летуч уже при 700° С. Этот факт очень важен для работающих на комбинатах по добыче и переработке свинца. Свинец – один из самых мягких металлов. Он легко царапается ногтем и прокатывается в очень тонкие листы. Свинец сплавляется со многими металлами. С ртутью он дает амальгаму, которая при небольшом содержании свинца жидкая.
Свинец. Химические и физические свойства. Часть 1
Свинец диамагнитен, его магнитная восприимчивость – 0,12·10 -6 . При 7,18 К становится сверхпроводником.
Относительная атомная масса (Ar = 207,2) является усредненной из масс нескольких изотопов: 204 Pb (1,4%), 206 Pb (24,1%), 207 Pb (22,1%) и 208 Pb (52,4%). Последние три нуклида – конечные продукты естественных радиоактивных превращений урана, актиния и тория. Известно также более 20 радиоактивных изотопов свинца, из которых наиболее долгоживущие – 202 Pb и 205 Pb (с периодами полураспада 300 тысяч и 15 млн. лет). В природе образуются также и короткоживущие изотопы свинца с массовыми числами 209, 210, 212 и 214 с периодами полураспада соответственно 3,25 ч, 27,1 года, 10,64 ч и 26,8 мин. Соотношение различных изотопов в разных образцах свинцовых руд может несколько различаться, что не дает возможности определить для свинца значение Ar с большей точностью.
По химическим свойствам свинец – малоактивный металл: в электрохимическом ряду напряжений он стоит непосредственно перед водородом. Поэтому свинец легко вытесняется другими металлами из растворов его солей. Наиболее типична для свинца степень окисления +2; соединения свинца(IV) значительно менее устойчивы.
С кислородом образует ряд соединений Pb2О, PbO, Pb2О3, Pb3О4, PbO2. Без кислорода вода при комнатной температуре не реагирует со свинцом, но при большой температуре при взаимодействии свинца и горячего водяного пара получаются оксиды свинца и водород. Вода не взаимодействует со свинцом, но в присутствии воздуха разрушает его.
2Pb + О2 + 2Н2О = 2Pb (ОН)2 При соприкосновении с жесткой водой покрывается защитной пленкой нерастворимых солей и не разрушается дальше.
В разбавленных соляной и серной кислотах свинец практически не растворяется, в том числе из-за образования на поверхности нерастворимой пленки хлорида или сульфата. С крепкой серной кислотой (при концентрации более 80%) свинец реагирует с образованием растворимого гидросульфата Pb(HSO4)2, а в горячей концентрированной соляной кислоте растворение сопровождается образованием комплексного хлорида H4PbCl6. Разбавленной азотной кислотой свинец легко окисляется:
Свинец — металл, из которого делают пули.
Разложение нитрата свинца(II) при нагревании – удобный лабораторный метод получения диоксида азота:
В присутствии кислорода свинец растворяется также в ряде органических кислот. При действии уксусной кислоты образуется легкорастворимый ацетат Pb(CH3COO)2 (старинное название – «свинцовый сахар»). Свинец растворим также в муравьиной, лимонной и винной кислотах. Растворимость свинца в органических кислотах могло раньше приводить к отравлениям, если пищу готовили в посуде, луженной или паянной свинцовым припоем. Растворимые соли свинца (нитрат и ацетат) в воде гидролизуются:
Взвесь основного ацетата свинца («свинцовая примочка») имеет ограниченное медицинское применение в качестве наружного вяжущего средства. Свинец медленно растворяется и в концентрированных щелочах с выделением водорода:
что указывает на амфотерные свойства соединений свинца. Белый гидроксид свинца(II), легко осаждаемый из растворов его солей, также растворяется как в кислотах, так и в сильных щелочах:
При стоянии или нагревании Pb(OH)2 разлагается с выделением PbO. При сплавлении PbO со щелочью образуется плюмбит состава Na2PbO2. Из щелочного раствора тетрагидроксоплюмбата натрия Na2Pb(OH)4 тоже можно вытеснить свинец более активным металлом.
Если в такой нагретый раствор положить маленькую гранулу алюминия, быстро образуется серый пушистый шарик, который насыщен мелкими пузырьками выделяющегося водорода и потому всплывает. Если алюминий взять в виде проволоки, выделяющийся на ней свинец превращает ее в серую «змею». При нагревании свинец реагирует с кислородом, серой и галогенами.
Так, в реакции с хлором образуется тетрахлорид PbCl4 – желтая жидкость, дымящая на воздухе из-за гидролиза, а при нагревании разлагающаяся на PbCl2 и Cl2. (Галогениды PbBr4 и PbI4 не существуют, так как Pb(IV) – сильный окислитель, который окислил бы бромид- и иодид-анионы.) Тонкоизмельченный свинец обладает пирофорными свойствами – вспыхивает на воздухе. При продолжительном нагревании расплавленного свинца он постепенно переходит сначала в желтый оксид PbO (свинцовый глет), а затем (при хорошем доступе воздуха) – в красный сурик Pb3O4 или 2PbO·PbO2. Это соединение можно рассматривать также как свинцовую соль ортосвинцовой кислоты Pb2[PbO4]. С помощью сильных окислителей, например, хлорной извести, соединения свинца(II) можно окислить до диоксида:
Диоксид образуется также при обработке сурика азотной кислотой:
Если сильно нагревать коричневый диоксид, то при температуре около 300° С он превратится в оранжевый Pb2O3 (PbO·PbO2), при 400° С – в красный Pb3O4, а выше 530° С – в желтый PbO (разложение сопровождается выделением кислорода). В смеси с безводным глицерином свинцовый глет медленно, в течение 30–40 минут реагирует с образованием водоупорной и термостойкой твердой замазки, которой можно склеивать металл, стекло и камень. Диоксид свинца – сильный окислитель. Струя сероводорода, направленная на сухой диоксид, загорается; концентрированная соляная кислота окисляется им до хлора:
сернистый газ – до сульфата:
а соли Mn 2+ – до перманганат-ионов:
Диоксид свинца образуется, а затем расходуется при зарядке и последующем разряде самых распространенных кислотных аккумуляторов. Соединения свинца(IV) обладают еще более типичными амфотерными свойствами. Так, нерастворимый гидроксид Pb(OH)4 бурого цвета легко растворяется в кислотах и щелочах:
Диоксид свинца, реагируя со щелочью, также образует комплексный плюмбат(IV):
Если же PbO2 сплавить с твердой щелочью, образуется плюмбат состава Na2PbO3. Из соединений, в которых свинец(IV) входит в состав катиона, наиболее важен тетраацетат. Его можно получить кипячением сурика с безводной уксусной кислотой:
При охлаждении из раствора выделяются бесцветные кристаллы тетраацетата свинца. Другой способ – окисление ацетата свинца(II) хлором:
Водой тетраацетат мгновенно гидролизуется до PbO2 и CH3COOH. Тетраацетат свинца находит применение в органической химии в качестве селективного окислителя. Например, он весьма избирательно окисляет только некоторые гидроксильные группы в молекулах целлюлозы, а 5-фенил-1-пентанол под действием тетраацетата свинца окисляется с одновременной циклизацией и образованием 2-бензилфурана. Органические производные свинца – бесцветные очень ядовитые жидкости. Один из методов их синтеза – действие алкилгалогенидов на сплав свинца с натрием:
Действием газообразного HCl можно отщеплять от тетразамещенных свинца один алкильный радикал за другим, заменяя их на хлор. Соединения R4Pb разлагаются при нагревании с образованием тонкой пленки чистого металла. Такое разложение тетраметилсвинца было использовано для определения времени жизни свободных радикалов. Тетраэтилсвинец – антидетонатор моторного топлива.
Сам по себе свинец интересен как основообразующий элемент различных смесей, которые способны радикально менять первоначальные химические и физические свойства этого металла. Наличие натрия или магния укрепляет кристаллическую решётку свинца, придавая этому элементу достаточно высокую прочность. При добавлении в свинец меди получается сплав, который успешно противостоит воздействию серной кислоты, а олово или кадмий могут на порядок повысить противодействие свинца так называемой «усталости» металла.
Летучесть свинца используется для отделения его при температуре 1400 в графитовой печи с индукционным обогревом.
Технология изготовления свинецсодержащих сегнетоэлектриков вследствие летучести свинца чрезвычайно сложна. Титанат свинца образует непрерывный ряд твердых растворов не только с титанатом бария, но и с титанатом стронция и титанатом кальция, которые также являются сегпетоэлектриками. Получение плотно спеченного керамического черепка этих составов возможно только при проведении процесса обжига в определенной газовой среде.
Синтез образцов твердых растворов осуществляется по известной керамической технологии с двукратным иди многократным обжигом и подбором соответствующих температур и времени выдержки. В частности, из-за летучести свинца температура обжига не превышала 900 — 940 и обжиг проводили в закрытых тиглях с засыпкой шихты[9].
Источник: studfile.net
Свинец химический элемент свойства и применение

Свинец — это один из редких самородных металлов, имеющий бело-серебристый цвет. Он мягкий, легкоплавкий, пластичный.
Этот металл был известен уже в древние времена. В данной статье мы поговорим об использовании, производстве, физических и химических свойствах плюмбума Pb химического элемента таблицы Менделеева.
Что такое свинец
Это элемент в химической таблице под атомным номером 82, он же Pb (Plumbum).

В классическом виде он обычно имеет серебряный цвет. Удельный вес 11,35 г/см3.
История открытия химического элемента Pb
На ближнем Востоке свинец стал известен ещё с 3 тысячелетия до нашей эры, где он участвовал в создании кирпичей, статуй и разных бытовых предметов. Его сопоставляли Сатурну.

Археологические раскопки, которые проводились на территории Древнего царства Египта, помогли найти свинцовые изделия. Подобные открытия сделаны и на территории бывшей Месопотамии и Армении.
Его использовали не только в качестве самостоятельного металла для изделия, но также для очищения серебра и золота. Затем металлу нашли новую задачу – им обшивали корпуса кораблей и применяли в медицинских целях.

В конце 17 века появилось хрустальное стекло за счет добавления в стекло свинца. После, из него стали изготавливать пули.
Характеристика свинца
Если вас интересует, какого цвета свинец, то ответ следующий — плюмбум имеет голубовато-серый оттенок. Он плотный и тяжелый. Достаточно несложно добывается.

Как и любой из существующих металлов, свинец отличается своими физическими и химическими особенностями, которые и отличают его от других металлов.
Физические свойства
Металл не отличает высокая твердость. Это довольно мягкий металл, легко режущийся лезвием. Плавится при невысокой температуре плавления (327 градусов).

Температура кристаллизации 327 градусов, а температура кипения 2022 К. Плюмбум подлежит достаточно быстрому окислению на открытом воздухе.
Полезно знать: неприятным критерием свинца является его токсичность: в хроническом течении он собирается во внутренних органах и костной ткани, чем вызывает нарушения в организме живых существ.
Теплопроводность в два раза меньше железа.
Молярная масса 207,2 а. е. м. ± 0,1 а. е. м.
Формула простых оксидов — оксид свинца (II) PbO и оксид свинца (IV) PbO2 и смешанный Pb3O4 (свинцовый сурик).
Химические свойства
Является металлом малоактивным, стоящим в электрохимическом ряду перед водородом, что делает его легко вытесняемым иными металлами из растворов его солей. Степень окисления +2.

Заметно растворим в лимонной, уксусной и винной кислотах. Бесцветные ядовитые жидкости производные свинца. Его пары ядовиты.
Некоторые школьники и студенты спрашивают свинец магнитится или нет? Нет, такие качества отсутствуют.
Помимо токсичности, хочется знать, свинец радиоактивен или нет? Искусственные изотопы металла радиоактивны.
Основные соединения свинца
Галогениды образуются, взаимодействуя с фтором, хлором, бромом, йодом, и астатом. Халькогениды с кислородом, серой, селеном, теллуром, и полонием. Пниктиды с азотом и фосфором.
Области применения
Элемент получил широкое применение:
- В электротехнической системе, благодаря своей сопротивляемости коррозии, применяется в целях защиты кабелей, сверхпроводников, применяются свинцовые аккумуляторы.
- В военной промышленности делают пули и снаряды, взрывчатки и детонаторы.
- В медицине является защитником от радиации (пример: обследование рентгеном).
- В производстве — свинец входит в состав цемента, используется для защитных барьеров керамики и стекла.

Люди, боящиеся отравления свинцом, спрашивают где можно найти свинец? В домашних условиях его можно обнаружить в аккумуляторах, в кабелях.
Производство свинца
Около половины металла производится из руд. Годовая добыча составляет 5 млн. тонн. Переработка крайне выгодна в плане экономии.
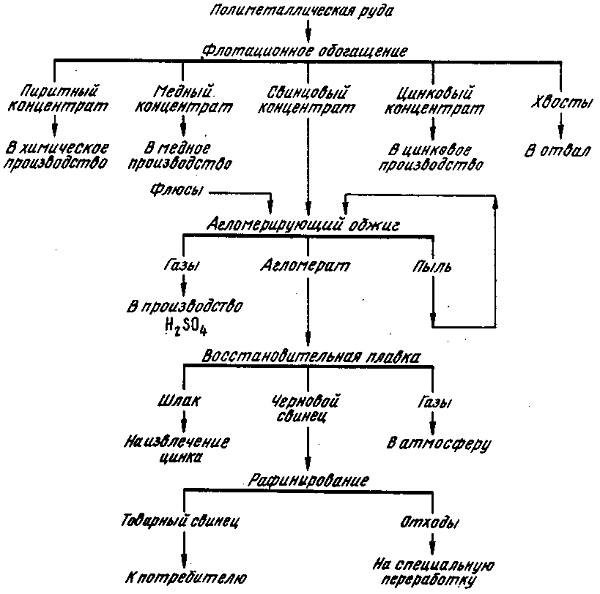
Приемы получения свинца это:
- пирометаллургический,
- гидрометаллургический.
В пирометаллургическом способе имеющиеся компоненты переплавляются, а во втором наблюдается разложение существующих концентратов.

Наибольшими объёмами добычи свинцовой руды могут быть отмечены такие страны, как:
Добыча свинца в России
Седьмое место по производству этого металла занимает Россия. Доля РФ в запасах этого метала чуть более 2% из-за его низкой концентрации в местных месторождениях. Причем свинец отправляется на экспорт.

Было высчитано, что на территории России находится около 70 месторождений свинца, производящих 93% процента этого металла в таких регионах, как: Красноярский край, Республика Бурятия, Читинская область, Алтайский край и Приморский край.
Можно это выявить в процентном соотношении:
- Сибирь – приблизительно 75%,
- Урал – около 15%,
- Дальний Восток – немногим меньше 10%.
Нахождение в природе
Обычно металл перемешан с каким-либо другим металлом, например, с оловом, а не встречается в чистом виде.

Свинец – является стадией распада урана, поэтому может находиться в урановых рудах. Свинец получается из такого сырья, как галенит.
Заключение
Свинец — это металл, который уже известен людям многие тысячи лет. Такая наука, как химия, сейчас помогает разобраться в его свойствах, чтобы правильно и экономно употребить. Его месторождения располагаются во многих частях Земли.
На мировом рынке его цена достаточно стабильна. Благодаря уникальности своих физико-химических свойств, Pb применяется во многих сферах и отраслях, подлежит импорту и экспорту.
Источник: tvercult.ru
Оксид свинца: формула, свойства, метод получения
В этой статье мы разберемся с тем, что собой представляет оксид свинца, покажем его формулу, рассмотрим химические и физические характеристики, а также не забудем рассказать о способах его получения. В общем, эта статья понравится тем, кто хочет или уже разбирается в химии. Ведь свинец встречается повсеместно. Если вы до сих пор не знаете область его применения, то прочитайте статью, чтобы понять весь потенциал этого химического элемента таблицы Менделеева.
Способы его получения
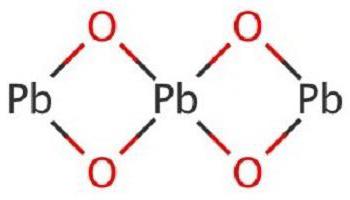
Изначально разберемся, как называется оксид свинца. Он традиционно именуется окисью свинца и представляют собой группу бинарных веществ, образованных элементами металла свинца и неметалла кислорода. Существует шесть основных форм PbO: PbO2, PbO, Pb12O19, Pb12O17, Pb3O4. Каждая из них имеет свои особенности строения молекулы, способы получения и область применения. Самые распространенные формы — это оксид свинца (II) и (IV).
Физические характеристики
Оксид свинца, формула которого PbO, может находиться в двухвидовых модификациях: высоко- и низкотемпературных. Переходы от высокотемпературной формы к низкотемпературной происходят медленнее, чем в обратном порядке. Вследствие этого элемент может пребывать в метастабильности при комнатной температуре, а в процессе растирания изменять модификационную форму.

Испарение протекает конгруэнтно, чаще всего в формах Pb2O2 и Pb4O4. Также данная группа оксидов является полупроводником. По типу проводимости, в зависимости от состава, но не превышая пределы гомогенности, оксиды бывают дырочными и электронными. По цвету они обычно бывают желтыми, красными и черными.
Химические особенности и свойства
Растворение хорошо протекает в азотной и кислородной кислотах, ухудшается растворимость в серной и соляной кислоте, так как образуются PbC12 и PbSO4, которые слаборастворимы. При растворении в щелочной среде образуются гексагидроксоплюмбаты (Na2[Pb(OH)4]). Они являются сильными окислителями, некоторые из них могут проявлять свойства амфотеров — окисляться и поглощать другие вещества. Все они способны окисляться до различных состояний, например, на открытом воздухе PbO при температуре 370 градусов перейдет в состояние молекулы Pb12O17, при 540 градусах образуется Pb3O4, а в водородной (H2) и монооксид углеродной (СО) среде вновь образуется металл путем восстановления.
Оксид свинца II
PbO является неорганическим соединением, которое в воде растворяется плохо. Это бинарное вещество в виде кристаллов красного или желтого цвета. В данном соединении свинец проявляет вторую валентность, соответствуя постоянной валентности кислорода. Встречается в природе с примесями, например, в массикоте или свинцовом глёте.
Как получить оксид свинца в промышленности? Его получают путем пропускания кислорода через свинец, нагретый до температуры 600 градусов (2Pb+O2—2PbO), путем нагревания гидроксида свинца при температурах около 100-145 градусов (Pb(OH)2—PbO+CO2), разложением нитратов (2Pb(NO3)2—2Pb+4NO2+O2), прогреванием карбоната свинца (PbCO3—PbO+CO2), разложением диоксидов свинца (2PbO2—PbO+O2) и окислением сульфидов свинца (2PbS+3O2—2PbO+2SO2).
По своим свойствам PbO (II) способен образовать кристаллы в двух модификационных вариантах, которые устойчивы при 489 градусах и выше.

Альфа модификация (свинцовый углет) представляет собой кристаллы красного цвета тетрагональной сингонии, имеют пространственную группу P 4/nmm. Показатель растворимости в воде — α 0,279 22 . Бета модификация (массикот) проявляет метастабильность при комнатных температурах, имеет желтый цвет, кристаллическую форму, ромбическую сингонию, пространственную группу P bcm. Показатель растворимости в воде — β 0,513 22 г/100 мл.
Оксид свинца может проявлять свойства амфотеров при взаимодействии с кислотами (PbO+2HCl—PbCl2+H2O), щелочами (PbO+2NaOH—(400градусов)Na2PbO2+H2O). Способен окисляться, взаимодействуя с кислородом до Pb3O4, а в водной суспензии бромом окисляется до диоксида свинца PbO2. Восстановление до металла происходит при участии оксида углерода, водорода и алюминия. В состоянии влажности поглощает диоксид углерода, образуя при этом основные соли.
Оксид свинца IV
Оксид свинца 4, он же диоксид свинца, имеет формулу PbO2. Является оксидом высших степеней. Как и другие соединения свинца с кислородом является бинарным веществом. Это порошок тёмно-коричневого цвета, довольно тяжелый, которому присущ запах озона. Раньше его можно было встретить под названием пероксид, или перекись свинца.

Добывают PbO2 в промышленности при помощи обработки азотной кислотой сурика свинца, после чего проводится промывка, помещение в вакуум и сушка: Pb3O4+4HNO3—PbO2+2Pb(NO3)2+2H2O.
Температура плавления данного соединения равна 290 градусов, плотность составляет 9.38г/ см³, молярная масса — 239,1988г/моль. Диоксид свинца 4 является очень сильным окислителем, способен вытеснять из концентрированной соляной кислоты хлор в результате нагревания (PbO2+4HCl—PbCl2+Cl2+2H2O). Соли марганца (II) также поддаются окислению до перманганата (5PbO2+2MnSO4+3H2SO4—5PbSO4+2HMnO4+2H2O). Является весьма токсичным веществом.
Применение
Области применения диоксидов свинца самые разнообразные. Оксид свинца 4 находит свое применение, выполняя функцию сиккативов (маслянистых веществ, необходимых для ускорения процесса засыхания красок), катализатора (вещества, необходимого для ускорения протекания химических реакций между соединениями, которые при этом не входят в конечный состав продуктов любых протекающих реакций) и окислителя (вещества, в состав которого входят атомы, способные присоединять к себе свободные электроны в процессе химической реакции, окислитель также можно назвать акцептором).

PbO2 широко используется в свинцово-сернокислотных аккумуляторах, в роли положительных электронных масс в гальванических элементах. Часто, но в малых количествах может применяться как покрытие для электродов, чтобы улучшить электролизный процесс. Диоксид свинца 2 используют при изготовлении суриков, PbO2 можно встретить в аккумуляторах.
Оксид свинца широко используется в области изготовления свинцовых стёкол и глазурей. Pb3O4 можно встретить в свинцовых аккумуляторах в качестве замазки и как пигмент для красок против коррозии. Большинство оксидов свинца используют при изготовлении радиотехники, резинотехнической продукции. Также незаменимы они в процессе добычи свинцовых солей при химическом синтезе.
Источник: www.syl.ru