Также по теме:
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Впервые торий выделен И.Берцелиусом в 1828 из минерала, позже получившим название торит (содержит сульфат тория), торий был назван его первооткрывателем по имени бога грома Тора в скандинавской мифологии. См. также СКАНДИНАВСКАЯ МИФОЛОГИЯ.
Также по теме:
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ
Одновременно с этим была разработана своеобразная технология, позволяющая помещать соединения тория в горелку: из легкой ткани изготавливали тонкие колпачки, которые пропитывали солями тория, затем волокна ткани осторожно выжигали и получали легкую скорлупку, которую помещали в пламя газовой горелки. Такие колпачки по имени их создателя стали называть ауэровскими.
Тусклое газовое освещение городов Европы изменилось коренным образом, вместо желтоватого неровного пламени газового рожка появился источник яркого белого света. Ауэровские колпачки почти в 20 раз увеличили яркость газового освещения и втрое снизили его стоимость. Производство таких колпачков в отдельные годы достигало 300 миллионов штук (в 1910-ые газовое освещение стало вытесняться электрическим). Фактически торий был первым радиоактивным элементом, появившимся почти в каждом доме, но из-за слабой радиоактивности угрозы для здоровья он не представлял.
Vitas — The 7th Element
Физические свойства.
Серебристо-белый пластичный металл, образует сплавы со многими металлами. Температура плавления – 1750° С, температура кипения – 4200° С, плотность – 7,24 г/см 3 , при температуре ниже 1,4 К становится сверхпроводником.
Химические свойства.
Торий весьма реакционноспособен – быстро тускнеет на воздухе, в кипящей воде покрывается пленкой ThO2. Мелкодисперсный металлический торий вспыхивает на воздухе из-за энергичного окисления. Торий растворим в разбавленных минеральных кислотах: соляной, азотной, серной; концентрированной азотной кислотой он пассивируется, не реагирует со щелочами. Наиболее устойчивая степень окисления у Th(IV), есть и соединения с более низкой степенью окисления: Th (II) I2 и Th (III) I3. При участии ионов щелочных металлов соединения тория легко образуют двойные соли K2[Th(NO3)6], Na2[Th(SO4)3], а также смешанные оксиды К2ТhO3. В водных растворах ионы тория образуют гидроксо-ионы [Th(OH)3] + , [Th2(OH)2] 6+ , [Th4(OH)12] 4+
Получение.
Содержащие торий минералы, например, монацитовый песок, подвергают сернокислотному расщеплению, полученную пасту нейтрализуют и затем обрабатывают соляной кислотой. Отделение сопутствующих элементов основано на различной растворимости полученных хлоридов. Иногда используют экстракцию трибутилфосфатом, позволяющую более тонко отделить примеси. Металлический торий получают из ThCl4 восстановлением с помощью Na, Са или Mg при 900–1000° С.
Соединения тория.
При нагревании тория в атмосфере водорода при 400–600 °С образуется гидрид ThH2 Темно-серые кристаллы, быстро разлагающиеся при действии влаги воздуха с образованием диоксида.
Диоксид ТhO2 образуется при сгорании металла на воздухе, при прокаливании гидроксида, а также некоторых солей – нитрата, карбоната. Это исключительно высокоплавкое соединение – т. пл. 3350° С, т. кип. 4400° С; реагирует с оксидами металлов при 600–800° С, образуя двойные оксиды (тораты), например, К2ТhO3, BaThO3, ThTi2O6. ТhO2устойчив к действию кислот и восстановителей;
Гидроксид Th(ОН)4 получают взаимодействием солей тория с растворами щелочей. Аморфное вещество; устойчиво при 260–450° С, выше 470° С превращается в ThO2.
Монокарбид ThC получают взаимодействием металлического тория со стехиометрическим количеством углерода, его т. пл. 2625° С. Дикарбид ThC2 получают взаимодействием металлического тория с избытком углерода или восстановлением ТhО2 углеродом при 1500° С. Его т. пл. 2655° С, т. кип. 5000° С, разлагается водой и разбавленными кислотами с образованием углеводородов, на воздухе окисляется при 600–700° С до ThO2.
Тетрагалогениды ТhНа14 (Hal = F, Cl, Br, I) получают при нагревании металлического тория или ThO2 при 300–400° С с соответствующим галогенидами или галогенводородами. Тетрафторид ThF4 имеет т. пл. 1100° С, т. кип. 1650° С, растворим в воде, образует кристаллогидраты. Тетрахлорид ThCl4 имеет т. пл.
770° С, т. кип. 921° С, растворим в воде, низших спиртах, эфирах, ацетоне, бензоле. Образует гидраты с 2, 4, 7 и 12 молекулами воды.
Тетрабромид ThBr4 имеет т. пл. 679° С, т. кип. 857° С, образует гидраты с 7, 8, 10 и 12 молекулами воды, а также сольваты с аммиаком и аминами. Тетраиодид ThI4 имеет т. пл. 566° С, т. кип.
837° С, хорошо растворим в воде с образованием гидратов, при нагревании и действии света разлагается с выделением I2.
Применение.
Торий используется в качестве легирующей добавки, упрочняющей магниевые сплавы, введение тория в состав вольфрамовых нитей для электроламп накаливания увеличивает срок их службы.
Оксид тория применяется как огнеупорный материал, в качестве компонента катализаторов, его также добавляют в состав дуговых углей для увеличения яркости электрической дуги, используемой в прожекторах. Фактически, это продолжение идеи «ауэровских колпачков».
В последние годы Ауэровские колпачки вновь «вернулись к жизни». Для тех, кто длительно работает в полевых условиях, в экспедициях, а также для туристов выпускают газовые баллончики с прикрепленной горелкой, поверх которой располагают Ауэровский колпачок, прикрытый стеклянным плафоном.
Подобные источники света намного экономичнее электрических светильников такой же яркости, использующих батареи или аккумуляторы. В настоящее время торий рассматривают как перспективное ядерное топливо. При облучении нейтронами в уран-ториевых реакторах изотоп 232Тh превращается в делящийся изотоп урана 233U, пригодный для использования в ядерных реакторах. Запасы тория в земной коре (3,3 × 106 т) соизмеримы с запасами урана (3,5 × 106 т).
Источник: www.krugosvet.ru
Торий Th
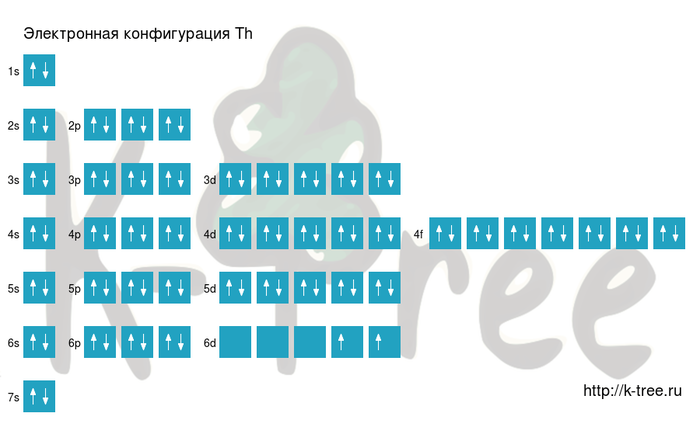
Порядок заполнения оболочек атома тория (Th) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Торий имеет 90 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
6 электронов на 5p-подуровне
2 электрона на 6s-подуровне
14 электронов на 4f-подуровне
10 электронов на 5d-подуровне
6 электронов на 6p-подуровне
2 электрона на 7s-подуровне
2 электрона на 6d-подуровне
Степень окисления тория
Атомы тория в соединениях имеют степени окисления 4, 3, 2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы тория
Валентность Th
Атомы тория в соединениях проявляют валентность IV, III, II.
Валентность тория характеризует способность атома Th к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Th
Квантовые числа определяются последним электроном в конфигурации, для атома Th эти числа имеют значение N = 6, L = 2, Ml = -1, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Энергия ионизации Th:
Eo = 587 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Th в таблице менделеева? найти
Источник: k-tree.ru
Торий — топливо третьего тысячелетия
Этот химический элемент признан альтернативой урану как ядерному топливу. У него много плюсов, поэтому именно на торий делают ставку стратеги, курирующие сферу энергобезопасности.

Что представляет собой
Торий как элемент представлен в таблице Менделеева под номером 90. Открывает группу актиноидов. Радиоактивен незначительно.
Это серебристо-белый мягкий блестящий металл.

По составу – три десятка изотопов. Только у одного (232) период полураспада – 13,9 млрд. лет – втрое превышает возраст Земли. Время распада остальных – часы или годы.
Почти 100% тория природного происхождения – мононуклид-232.
Международное обозначение элемента – Th, Thorium.
Как был открыт
К получению тория причастны ученые нескольких стран:

Большой выбор украшений из натуральных камней и минералов со скидкой -50%
- Первые крупицы вещества получил гуру европейских химиков Йенс Берцелиус (первая треть 19 века). Образцом стал минерал с сульфатом тория в составе.
- Торий как металл выделил через полвека его коллега и соотечественник швед Ларс Нильсон.
- Радиоактивность элемента обнаружили (1898 год) полька Мария Склодовска-Кюри и немец Герберт Шмидт.
Первооткрыватель назвал вещество торием в честь верховного бога скандинавского пантеона Тора. Минерал стал торитом.
Анналы науки хранят имя человека, далекого от химии. 17-летний американец, житель Детройта, соорудил в пристройке к дому ядерный реактор. Ему удалось добыть радиоактивный элемент из сеток накаливания газовых светильников. Пресса окрестила его «радиоактивным бойскаутом», феномен – «случаем с Дэвидом Ханом».
Как представлен в природе
Торий содержат магматические породы, пегматиты, редкоземельные и другие минералы (12 наименований). Главные источники вещества – редкоземельные элементы и минерал монацит. Но отдельно не добывается, только с другими элементами.

Вместе с ураном входит примесью в граниты.

Тонна земной коры содержит 10,5 г тория, литр морской воды – 0,05 мкг.
Месторождения ториевых минералов есть на всех континентах.
Богатые залежи у Норвегии и Индии.
Российские ресурсы сосредоточены в основном за Уралом: Омская, Томская, Новосибирская, Мурманская области, Республика Тыва, Красноярский край, Саха-Якутия.
Физико-химические характеристики

Химический элемент торий – типичный актиноид:
- С трудом растворяется в кислотах. Легко – в царской водке (азотно-соляном кислотном концентрате).
- Устойчив к агрессивным щелочам.
- Реакция с газами, галогенами, серой, кремнием, другими элементами запускается при нагреве.
Оксид вещества не окисляется, самый тугоплавкий среди оксидов.
Металл более уязвим:
- На воздухе тускнеет, темнеет (постепенно).
- Коррозия определяется температурой: на влажном холоде замедленна, в горячей воде – молниеносна.
- Нагревшись, горит ярким белым пламенем.
Порошок легко воспламеняется, поэтому хранится притопленным в керосине.
- При минус 272°С элемент становится сверхпроводником.
Структура кристаллической решетки элемента меняется с кубической на центрированную по граням. Порог перехода – 1400°С.
| Торий / Thorium (Th), 90 |
| 232,03806(2) а. е. м. (г/моль) |
| [Rn] 6d2 7s2 |
| 180 пм |
| 165 пм |
| (+4e) 102 пм |
| 1,3 (шкала Полинга) |
| 4 |
| 670,4 (6,95) кДж/моль (эВ) |
| 11,78 г/см³ |
| 2028 K |
| 5060 K |
| 16,11 кДж/моль |
| 513,7 кДж/моль |
| 26,23 Дж/(K·моль) |
| 19,8 см³/моль |
| кубическая, гранецентрированая |
| 5,080 Å |
| 100,00 K |
| (300 K) (54,0) Вт/(м·К) |
| 7440-29-1 |
Торий причислен к тяжелым металлам: кубик с ребром 1 см весит 11,7 грамма.
Технология получения
Процесс получения вещества несложен:

Более 8000 видов товара из 500 разновидностей натурального камня. Ежедневное обновление!
- Монацитовую руду обогащают.
- На продукт воздействуют кислотами либо щелочами.
- Извлекают «редкие земли» – экстрагируя, затем сорбируя.
- Из конгломерата металлических соединений выделяют фторид, хлорид либо диоксид тория.
Металлическую форму вещества получают методом металлотермии. Процесс проходит с участием магния, кальция или натрия при 910-990°С.
Преимущества перед ураном
Торий рассматривают как альтернативу урана.

У элемента ряд преимуществ:
- Запасы втрое – вчетверо больше.
- Процесс безопаснее. Реактор, работающий на тории, лишен избыточной реактивности. Аварии типа Чернобыля или Фукусимы исключены.
- Новые порции топлива загружаются каждые 10 лет (а не полтора года, как у урана).
Нуклид-232 не делится. Но, прихватив нейтрон, превращается в уран-233 с делимым ядром. То есть в реакторе торий «оборачивается» топливом, пригодным для получения энергии. Реально отладить цикличность, при которой урана-233 на выходе получится больше, чем на входе.
Этим плотно занимаются США, Китай, Норвегия, Индия. Для России значение ториевой энергетики возрастает в связи с освоением Арктики.
Стоимость металла не превышает $100 за кг.
Где используется
Металл легко обрабатывать: он мягкий, ковкий, вязкий.

Несмотря на слабую радиоактивность, нашел применение как мирный атом и компонент продуктов других сфер.
Атомная промышленность
Главная сфера применения вещества – атомный сектор.
Облученный в реакторе ториевый изотоп-232, через цепочку реакций, превращается в уран-233. Он легче традиционных урана-235 и плутония, но работает не хуже.
Глобальные запасы тория втрое — вчетверо превышают урановый «резерв». Энергетика на его основе решит проблему безопасного использования атома.
Другие сферы
Металлический торий приносит пользу другим отраслям промышленности:
- Металлургия. Это лигатура, улучшающая параметры сплавов (повышение порога на разрыв, жаропрочность). Оксид вещества – печной элемент-резистор. Емкости из окиси тория применяются для работ при 2550-3150°C.
- Авиастроение. Окись тория – упрочняющий элемент композитов.
- Гидроэлектростанции. Оксид вещества используется для узлов и конструкций, функционирующих в экстремальных условиях. Им выкладывают изнутри камеры сгорания и газодинамические каналы.
- Синтез. Соединения, чистое вешество – составляющая катализаторов.
Катодами с веществом, оксидом снабжены источники света: магнетроны, электронные, ксеноновые дуговые, генераторные.
Один процент оксида тория «обездвиживает» структуру вольфрамовых нитей ламп накаливания.
Влияние на живые организмы
Малотоксичный торий присутствует в растениях, организме человека и животных.
Им богаты морская флора и фауна.
Человек получает ежесуточно 3 мкг вещества с пищей и водой. Они выводятся естественным путем.
«Накопители» вещества – селезенка, печень, лимфоузлы, костный мозг, надпочечники.
Негативное влияние на человека возможно при контакте с веществом.
Ограничения
Радиоактивность элемента незначительна, однако при долгом воздействии срабатывает «накопительный» эффект. Что представляет опасность для человека.
Поэтому гранит, используемый как строительный либо декоративный материал, проверяют. Материал с некоторых месторождений использовать запрещено.
Источник: jgems.ru