Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность.
Взаимодействие с гидроксидом меди (II).
Для реакции используют свежеприготовленный Cu(OH)2 со щелочью – появление кирпично-красного осадка говорит о восстановлении двухвалентной меди до одновалентной за счет окисления альдегидной группы.
Линейная полимеризация.
При испарении или длительном стоянии раствора формальдегида происходит образование полимера – параформальдегида: n(H2C=O) + nH2O → [CH2O]n (параформальдегид, параформ)
Полимеризация безводного формальдегида в присутствии катализатора – пентакарбонила железа Fe(CO)5 – приводит к образованию высокомолекулярного соединения с n=1000 – полиформальдегида.
Циклическая полимеризация (тримеризация, тетраметризация).
В кислой или щелочной среде при нагревании формальдегид образует с фенолом высокомолекулярные продукты – фенолформальдегидные смолы различного строения. Вначале в присутствии катализатора происходит взаимодействие между молекулой формальдегида и молекулой фенола с образованием фенолоспирта. При нагревании фенолоспирты конденсируются с образованием фенолформальдегидных полимеров.
РАЗБИРАЕМ ВСЕ ТИПЫ ЗАДАЧ 26-28 🔥🔥🔥 ЕГЭ по ХИМИИ 2023
Фенолформальдегидные смолы используются для получения пластических масс.
Способы получения:
1. окислением первичных спиртов:
а) каталитическое (кат. Cu, t);
б) под действием окислителей (K2Cr2O7, KMnO4 в кислой среде).
2. каталитическое дегидрирование первичных спиртов (кат. Cu, 300 o C);
3. гидролиз дигалогеналканов, содержащих 2 атома галогена у первого углеродного атома;
4. формальдегид можно получить при каталитическом окислении метана:
CH4 + O2 → H2C=O + H2O (кат. Mn 2+ или Cu 2+ , 500 о С)
5. ацетальдегид получают реакцией Кучерова из ацетилена и воды в присутствии солей ртути (II).
ФМ
Практическое занятие №5.
Тема: «Карбоновые кислоты».
Тип занятия: комбинированный (изучение нового материала, повторение и систематизация пройденного).
Вид занятия: практическое занятие.
Время проведения: 270 минут.
Место проведения: кабинет практических работ по химии (№222).
Цели занятия:
Учебная:
1. добиваться понимания взаимной связи между строением веществ и их химическими свойствами;
2. закрепить знания о химических свойствах карбоновых кислот;
3. научиться составлять уравнения реакций, характеризующие химические свойства этих гомологических рядов;
4. закрепить знания о качественных реакциях на функциональные группы органических веществ и умение подтверждать эти свойства записями уравнений реакций.
Воспитательная– воспитывать у студентов умение логически мыслить, видеть причинно-следственные связи, качества, необходимые в работе фармацевта.
После занятия студент должен знать:
1. классификацию, изомерию, номенклатуру карбоновых кислот;
2. основные химические свойства и способы получения карбоновых кислот;
серебряное зеркало (с помощью нитрата серебра и формальдегида из сухого горючего)
3. качественные реакции на карбоновые кислоты.
После занятия студент должен уметь:
1. писать уравнения химических реакций, характеризующие свойства карбоновых кислот.
План-структура занятия
| № п/п | Этапы занятия | Время (прибл.) |
| Организационный момент, выявление отсутствующих. | 2 минуты | |
| Сообщение темы, мотивация темы, постановка целей и задач. | 3 минуты | |
| Контроль исходного уровня знаний. | 20 минут | |
| Изучение нового материала. | 170 минут | |
| Закрепление изученной темы. | 70 минут | |
| Подведение итогов. Домашнее задание. | 5 минут |
Источник: allrefrs.ru
Окислительно- восстановительные реакции
Альдегиды легко окисляются до кислот и их солей (если реакции протекают в щелочной среде). Если в качестве окислителей используются комплексные соли тяжелых металлов (Ag, Cu, Hg), то в результате реакции выпадает осадок металла (серебра, ртути) или оксида металла (оксид меди (I)):
а) реакция с аммиачным раствором серебра нитрата
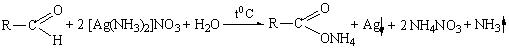
Методика: К 2 мл раствора серебра нитрата прибавляют 10-12 капель раствора аммиака и 2-3 капли раствора вещества (раствор формальдегида, хлоралгидрата, метенамина (гексаметилентетрамина),глюкозы),нагревают на водяной бане с температурой 50 -60°С; выделяется металлическое серебро в виде зеркала или серого осадка.
б) реакция с реактивом Фелинга
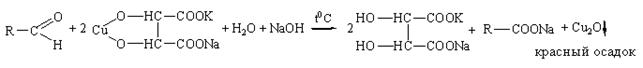
Методика: К 1 мл раствора альдегида (раствор формальдегида, метенамин, глюкоза), содержащего 0,01-0,02 г вещества, прибавляют 2 мл реактива Фелинга, нагревают до кипения. Выделяется кирпично-красный осадок оксида меди (I).
в) реакция с реактивом Несслера
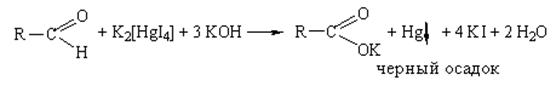
Методика: К 2-3 каплям раствора альдегида (раствор формальдегида, 3% раствора метенамина, 10% раствора глюкозы) прибавляют 2-3 капли реактива Несслера и нагревают. Выделяется серовато-черный осадок металлической ртути.
Альдегиды в среде кислоты серной концентрированной конденсируются с фенолами (см. методику 2.3), образуя окрашенные хиноны. Ниже приводится уравнение химической реакции с салициловой кислотой. Появляется красное окрашивание (арилметановый краситель):
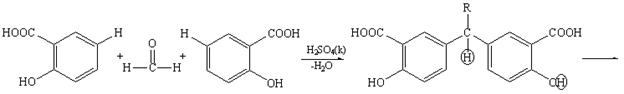
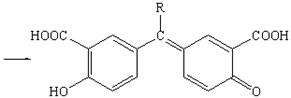
Кроме фенолов с альдегидами конденсируются первичные ароматические амины (образуются основания Шиффа) и гидразины (в виде осадка или окрашенного продукта). Тип реакции — нуклеофильное присоединение:
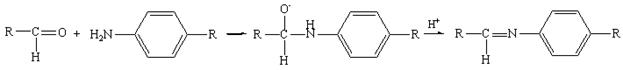
Методика: см. раздел 9.3.
Методика:К 1 мл раствора альдегида прибавляют 1 мл щелочного раствора гидроксиламина гидрохлорида. Постепенно выпадает осадок оксима.
4. ИДЕНТИФИКАЦИЯ КЕТО-ГРУППЫ
Кетоны — это органические вещества, содержащие кето-группу. Им свойственны реакции конденсации по механизму нуклеофильного присоединения — отщепления воды с образованием иминов (оснований Шиффа), оксимов и гидразонов.
Лекарственные вещества, содержащие кето- группу:
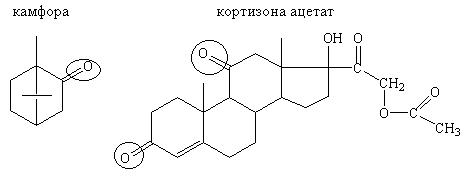
Кетоны менее реакционноспособны по сравнению с альдегидами ввиду отсутствия подвижного атома водорода. Поэтому окисление проходит в жестких условиях. Кетоны легко вступают в реакцию конденсации с гидроксиламина гидрохлоридом и гидразинами. Образуются оксимы или гидразоны (осадки или окрашенные соединения).
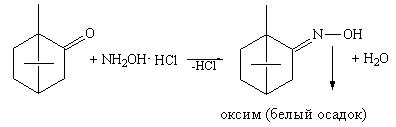
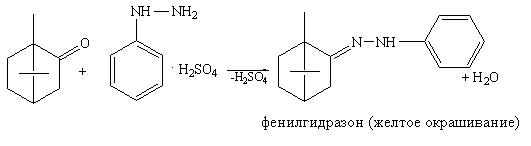
Методика: 0,1 г лекарственного вещества (камфора, тестостерон и др.) растворяют в 3 мл спирта этилового 95%, прибавляют 1 мл раствора 2,4-динитрофенилгидразина или щелочного раствора гидроксиламина. Наблюдается появление осадка или окрашенного раствора.
5. ИДЕНТИФИКАЦИЯ ГИДРОКСИАЦЕТИЛЬНОЙ ГРУППЫ (α-кетольная группа)
Лекарственные вещества, содержащие гидроксиацетильную группу:
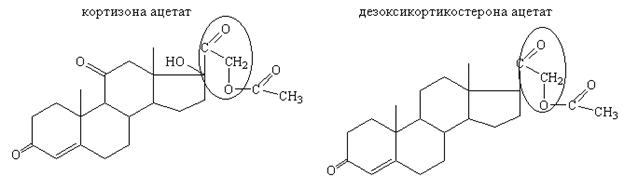
Лекарственные вещества, содержащие гидроксиацетильную группу (R-CO-CH2OH), дают реакции окисленияс комплексными солями тяжелых металлов. В щелочной среде оксиацетильная группа изомеризуется с образованием вторичного спирта и альдегида. Затем идет реакция окисления альдегида (реакция серебряного зеркала):

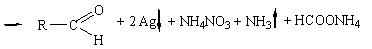
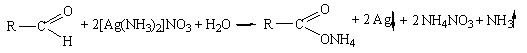
Методика: К 1 мл 1% спиртового раствора лекарственного вещества (преднизолон, дезоксикортикостерона ацетат, кортизон, гидрокортизон) прибавляют 2 мл аммиачного раствора серебра нитрата, нагревают на кипящей водяной бане в течение 4-5 минут. Образуется металлическое серебро в виде зеркала или серого осадка.
Аналогично идет реакция с реактивом Фелинга(см. методику 3.1б).
6. ИДЕНТИФИКАЦИЯ КАРБОКСИЛЬНОЙ ГРУППЫ
Органические кислоты — это вещества, содержащие карбоксильную группу.
Лекарственные вещества, содержащие карбоксильную группу:
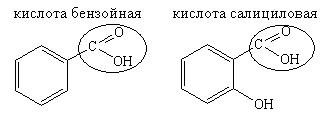
Для обнаружения карбоксильной группы используют два типа реакций:
а) образование сложных эфиров со спиртами (см. раздел 4.1);
б)образование комплексных солей с ионами тяжелых металлов(Fe, Ag, Сu, Со, Hg и др.) (см. раздел 22). При этом образуются:
— серебряные соли белого цвета;
— соли ртути серого цвета;
— соли железа (III) розовато-желтого цвета и др.;
— соли меди (II) голубого или синего цвета;
— соли кобальта сиреневого или розового цвета.
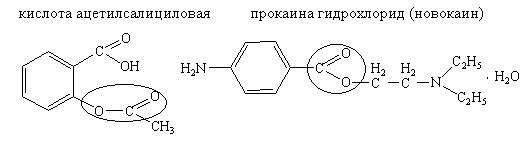
7. ИДЕНТИФИКАЦИЯ СЛОЖНОЭФИРНОЙ ГРУППЫ
Сложные эфиры — это производные карбоновых кислот, у которых —ОН группа замещена на —OR группу. Они образуются в результате взаимодействия карбоновых кислот со спиртами.
Лекарственные вещества, содержащие сложноэфирную группу:
Дата добавления: 2018-02-28 ; просмотров: 1865 ; Мы поможем в написании вашей работы!
Поделиться с друзьями:
Источник: studopedia.net
Методы анализа альдегидов
· Присоединение бисульфита натрия. Альдегиды и многие кетоны образуют с 40% раствором бисульфита натрия труднорастворимые соединения, которые при кипячении с разбавленными кислотами или щелочами снова разлагаются на исходные соединения.

Реакция альдегидов и кетонов с указанными соединениями в условиях кислотного катализа протекает по типу присоединения-отщепления с образованием оксимов, 2,4-динитрофенилгидразонов и семикарбазонов соответственно.

· Каждая из реакций имеет свои особенности, например, получаемые
взаимодействием с гидроксиламином оксимы очень неустойчивы и склонны к
саморазложению, а реакция с 2,4-динитрофенилгидразоном для многих
альдегидов и кетонов протекает очень медленно, однако образование желтого осадка 2,4-динитрофенилгидразона делает ее более подходящей для качественного анализа, чем получение оксимов.

· Реакция с нитропруссидом натрия. Альдегиды и кетоны, способные к образованию енолов, реагируют с нитропруссидом натрия, давая красное окрашивание. В случае альдегидов при продолжительном стоянии или после добавления уксусной кислоты окраска бледнеет и затем полностью исчезает.
· Кетоны дают более интенсивное окрашивание, которое после подкисления уксусной кислотой изменяет свой цвет.
· Формальдегид, глиоксаль, бензальдегид, ванилин, бензофенон и некоторые другие соединения, а также кетоны с длинной углеродной цепью не дают этой реакции.

Описанные ранее тесты позволяют установить наличие карбонильной группы в соединении, однако не позволяют сказать альдегиду или кетону она принадлежит.
Соотнесение можно сделать на основании качественных реакций, характерных только для альдегидов.
· Проба с фуксинсернистой килотой. Фуксинсернистая кислота, получаемая из фуксина пропусканием SO2, в присутствии альдегидов окрашивается в фиолетово-пурпурный цвет.

Некоторые соединения способны регенерировать розово-красную окраску фуксина, поэтому положительной пробой считается лишь та, где появляется фиолетово-пурпурная окраска.
Реакция не идет с ванилином, хлоральгидратом, пара-аминобензальдегидом.
Вместо фуксина может быть использован обесцвеченный сернистой кислотой раствор малахитового зеленого. В этом случае в присутствии альдегида появляется зеленое окрашивание, однако эта реакция менее чувствительна.
· Реакция с реагентом Толленса. Взаимодействие альдегидов с реактивом Толленса (аммиачным раствором оксида серебра) сопровождается либо образованием серо — черного осадка

Положительная реакция наблюдается с некоторыми ароматическими аминами, многоатомными фенолами, аминофенолами и б-дикетонами.
Взаимодействие с реагентом Фелинга. Прибавление альдегида к раствору реактива Фелинга и последующее нагревание вызывает появление красного осадка оксида меди (I).

· Обнаружение по каталитическому ускорению реакции окисления пара-фенилендиамина пероксидом водорода. пара-Фенилендиамин окисляется в кислом или нейтральном растворе в черные хиноидные соединения.

Окисление значительно ускоряется в присутствии альдегидов. В нейтральных растворах все альдегиды дают черное окрашивание или черный осадок, образованию которого предшествует появление ряда промежуточных окрасок. В кислой среде алифатические альдегиды ведут себя так же, тогда как большинство ароматических альдегидов образуют вначале сохраняющуюся в течение некоторого времени желтое окрашивание или желтый осадок. Эта особенность позволяет различать ароматические и алифатические альдегиды.
Токсичны. Способны накапливаться в организме. Кроме общетоксического, обладают раздражающим и нейротоксическим действием. Эффект зависит от молекулярной массы: чем она больше, тем слабее раздражающее, но сильнее наркотическое действие, причём ненасыщенные альдегиды токсичнее насыщенных. Некоторые обладают канцерогенными свойствами [1] .
С другой стороны — альдегиды входят в состав пищевых продуктов и эссенций (например, ананасовой [2] ). Любое вещество, даже самое необходимое, может вызывать токсические эффекты. Действие вещества определяется дозой. В силу сходства химического строения все альдегиды обладают указанными у Лойта [1] свойствами, только чтобы они проявились, нужно принять дозу вещества много бомльшую, чем содержится в пачке миндального печенья. Среднесмертельная доза ароматизатора бензальдегида (для крыс при пероральном введении) составляет 1300 мг на килограмм массы тела (для сравнения: у хлорида натрия среднесмертельная доза — 3000 мг/кг). У «настоящего яда» формальдегида LD50=100 мг/кг.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему. С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные.
· реакция с аммиачным раствором нитрата серебра (образование серебряного зеркала); при добавлении к аммиачному раствору нитрата серебра раствора альдегида при нагревании
Раствор формальдегида. Формалин Solutio Formaldehydi М. м 30,03

Формальдегид получают в промышленности путем окисления метилового спирта.
Для этого через нагретый до 50°С метиловый спирт пропускают ток воздуха, который насыщается парами метилового спирта и поступает в трубку с раскаленной медной спиралью (медь играет роль катализатора).

40% раствор формальдегида в воде Solutio Formaldehydi является фармацевтическим препаратом и описан в фармакопее.
Он представляет собой прозрачную бесцветную жидкость с острым своеобразным запахом.
Для подтверждения идентификации препарата можно’ применить все те общие реакции, которые характерны для альдегидов (см. выше), однако для формальдегида существуют и частные, специфические реакции, отличающие его от других альдегидов.
Источник: studbooks.net