1. Вещество с ковалентной неполярной связью имеет формулу:
1) HF
2) F2
3) NaF
4) Ca
Ответ: простым веществом-неметаллом является фтор F2, значит в молекуле фтора связь ковалентная неполярная.
2. Вещество с ковалентной полярной связью имеет формулу:
1) PF5
2) S8
3) KCl
4) Mg
Ответ: сложным веществом, состоящим из атомов неметаллов является фторид фосфора (V), значит в этом веществе ковалентная полярная связь
3. Вещество с ионной связью имеет формулу:
1) H2S
2) P4
3) Ag
4) BaF2
Ответ: сложным веществом, состоящим из ионов металла бария и неметалла фтора, является фторид бария, значит в этом веществе ионная связь.
4. Веществом с металлической связью является:
1) аммиак
2) цинк
3) хлорид магния
4) озон
Ответ: Цинк является простым веществом — металлом, значит связь в цинке металлическая
Павел Дедищев про родственников
5. Гидроксид натрия образован
1) металлической и ковалентной связями
2) только ионной связью
3) ионной и ковалентной связями
4) только ковалентной связью
Ответ: Связь между ионом натрия и гидроксид-ионом ионная, а между атомом кислорода и атомом водорода ковалентная полярная
6. Ковалентная полярная связь присутствует в веществе
1) железо
2) серная кислота
3) кислород
4) бромид калия
Ответ: ковалентная полярная связь присутствует в серной кислоте, так как это вещество сложное и образовано атомами водорода, кислорода и серы (неметаллами)
7. Химическая связь соответственно: ионная, ковалентная полярная, металлическая, ковалентная неполярная
Решение задач по химии — любой сложности. Готовые и на заказ.
1) NaCl, SO2, Ca, H2
2) HCl, Al, Cl2, CuCl2
3) K, CO2, FeBr3, O2
4) F2, Zn, H2O, BaS
Ответ: хлорид натрия — вещество с ионной связью, оксид серы (IV) — вещество с ковалентной связью, кальций — простое вещество — металл, связь металлическая, в молекуле водорода — связь ковалентная неполярная
- Главная
- Заказать работу
- Онлайн калькулятор стоимости работы
Источник: dx-dy.ru
II. Химическая связь и строение молекул. Межмолекулярные связи.
1. Определить тип связи в следующих молекулах: KCl и AgCl. Oбъ-яснить механизм образования этих связей.
Решение.
1). Природа атомов элементов:
К – щелочной (активный) металл, s-семейство; Ag – металл, d-семейство;
Cl – неметалл, р-семейство.
2). Величина относительной электроотрицательности (ОЭО):
ОЭО (К) = 0,91, ОЭО (Ag) = 1,42, ОЭО (Сl) = 2,83. Определяем разницу ОЭО связи К – Сl: 2,83 – 0,91 = 1,92. Следовательно, связь – ионная.
Виды химических связей | ХИМИЯ ЕГЭ | Лия Менделеева
Разница ОЭО связи Ag – Cl = 2,83 – 1,42 = 1,41. Следовательно, связь – ковалентная полярная.
Механизм образования ионной связи:
19К 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
19К + 1s 2 2s 2 2p 6 3s 2 3p 6 4s о ,
следовательно, у иона калия формируется устойчивая электронная оболочка, подобная атому инертного газа аргона [Ar].
17Сl 1s 2 2s 2 2p 6 3s 2 3p 5
17Cl – 1s 2 2s 2 2p 6 3s 2 3p 6 ,
следовательно, у иона хлора также формируется устойчивая электронная оболочка, подобная атому инертного газа аргона [Ar].
Механизм ионной связи – перераспределение валентных электронов. Свойства – ненасыщаемость и ненаправленность. Вещество имеет кристаллическую решетку ионного типа:
Механизм образования ковалентной связи.
47Ag 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 .
Атом серебра имеет «провал» электрона с 5s- на 4d-подуровень.
17Сl 1s 2 2s 2 2p 6 3s 2 3p 5 .
Валентный (неспаренный) электрон находится на p-подуровне:
Ковалентная связь образуется посредством обобществления неспаренных электронов, принадлежащих разным атомам, в общую электронную пару, которая смещена к хлору, т.к. ОЭОСl больше ОЭОAg:
где – неспаренный электрон атома серебра; – электроны атома хлора.
Свойства ковалентной связи – насыщаемость и направленность.
2. Определить тип связи в молекуле AlBr3. Объяснить механизм образования связи и ее свойства. Какой тип гибридизации предшествует образованию молекулы AlBr3?
Решение.
1). Природа атомов элементов:
Al – металл, p-семейство; Br – неметалл, р-семейство.
2). Величина относительной электроотрицательности (ОЭО):
ОЭО (Al) = 1,47, ОЭО (Br) = 2,74. Определяем разницу ОЭО связи Al – Br: ∆ОЭО = 2,74 – 1,47 = 1,27.
Следовательно, связь – ковалентная полярная; общие электронные пары смещены к более электроотрицательному элементу – брому. На атоме алюминия возникает эффективный положительный (δ+), а на атомах брома –эффективные отрицательные (δ−) заряды.
13Al 1s 2 2s 2 2p 6 3s 2 3p 1
тип гибридизации sp 2 :
35Br 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5
Механизм образования: обобществление валентных (неспаренных) электронов в общие электронные пары:
Br δ – Al 3 δ+ Br δ –
1). Насыщаемость (ковалентность) равна 3, так как образовались три общие пары электронов;
2). Направленность определяет форму молекулы:
3. Определить тип связи в молекуле SbH3 и ее форму. Какая связь возникает между молекулами NH3? Почему эта связь не возникает между молекулами SbH3?
1). Природа атомов элементов: Sb – неметалл, p-семейство; Н – неметалл, s-семейство; N – неметалл, р-семейство.
2). Величина относительной электроотрицательности (ОЭО):
ОЭО (Sb) = 1,82, ОЭО (H) = 2,1, ОЭО (N) = 3,07. Определяем ΔОЭО связи Sb – H: 2,1 – 1,82 = 0,28.
Следовательно, связь – ковалентная неполярная.
ΔОЭО связи N – H = 3,07 – 2,1 = 0,97.
Cледовательно, связь – ковалентная полярная.
51Sb 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 3
51Sb KLMN 5 s p
Форма молекулы:
Между молекулами NH3 возникает водородная связь:
H – N 3 δ – . H δ+ – N
Водородная связь возникает между протоном Н + одной молекулы и сильно электроотрицательным элементом N другой молекулы.
Поскольку в молекуле SbH3 имеется ковалентная неполярная связь, и молекула не является диполем, то между молекулами SbH3 не возникает водородная связь.
4. Определить тип связи в соединении V2O5 и металлическом ванадии. Сравнить строение этих соединений.
Решение.
1). Природа атомов элементов:
V – металл, d-семейство; O – неметалл, p-семейство.
2). Величина относительной электроотрицательности (ОЭО):
ОЭО (V) = 1,45; ОЭО (O) = 3,5; определяем ΔОЭО связи V – O: 3,5 – 1,45 = = 2,05.
Следовательно, связь – ионная.
Соединение V2O5 имеет кристаллическую решетку ионного типа.
В металлическом ванадии – связь металлическая.
Ионный кристалл Кристалл металла
В ионном кристалле в узлах находятся положительные и отрица-тельные ионы, чередующиеся друг с другом.
В кристалле металла в узлах находятся положительные ионы. В междоузлиях — свободные электроны.
5. Охарактеризовать силы взаимодействия при растворении в воде сероводорода H2S и кислорода O2.
Решение.
1). Природа атомов элементов:
H – неметалл, s-семейство; O – неметалл, p-семейство; S – неметалл, р-семейство.
2). Величина относительной электроотрицательности (ОЭО):
ОЭО (Н) = 2,1; ОЭО (O) = 3,5; ОЭО (S) = 2,6.
Определяем разницу относительной электроотрицательности:
ΔОЭО связи Н – O = 3,5 – 2,1 = 1,4; ΔОЭО связи Н – S = 2,6 – 2,1 = 0,5;
ΔОЭО связи О – O = 3,5 – 3,5 = 0.
Следовательно, в молекулах Н2О и Н2S связь – ковалентная полярная, а в молекуле О2 – ковалентная неполярная.
При растворении в воде: между двумя полярными молекулами (Н2О и Н2S) возникает ориентационное, а между полярной (Н2О) и неполярной (О2) возникает индукционное взаимодействие (силы Ван-дер-Ваальса).
6. Объяснить образование иона гидроксония [H3O] + .
Решение.
😯 1s 2 2s 2 2p 4
Н — О: + □ Н + → [ Н — О □ Н ] +
В ионе гидроксония все три связи – ковалентные: две связи между атомами водорода и кислорода в молекуле воды образованы по обычному ковалентному механизму, а связь между кислородом и ионом водорода образована по донорно-акцепторному механизму.
7. Вода имеет аномально высокую температуру кипения и низкую температуру замерзания. Объяснить: чем это вызвано?
Решение.
Н — О 2 δ – . Н δ+ – О 2 δ – . δ+ Н – О (Н2О)n
ассоциация молекул воды
Между молекулами H2O возникает водородная связь, образуются ассоциаты, что приводит к аномально высокой температуре кипения и низкой температуре замерзания.
1. Определить тип связи и форму молекулы AsCl3.
2. Определить тип связи в молекуле H2Se. Объяснить механизм ее образования. Показать графически форму молекулы H2Se.
3. Почему молекулы HF способны образовывать димеры и полимеры?
4. Определить тип связи в молекуле GaCl3. Объяснить механизм ее образования и показать графически форму молекулы. Определить тип гибридизации.
5. Определить тип связи в молекуле BF3. Объяснить механизм ее образования. Показать графически форму молекулы. Определить тип гибридизации.
6. Определить тип связи в соединении CsF. Объяснить механизм ее образования, свойства.
7. Определить тип связи в молекуле MnBr2. Объяснить механизм ее образования. Показать графически форму молекулы. Определить тип гибридизации.
8. Определить тип связи в молекуле GeCl4, тип гибридизации. Объяснить механизм ее образования и свойства. Показать графически форму молекулы.
9. Определить тип связи в молекуле HВr. Какой вид взаимодействия проявляется между молекулами HВr?
10. Определить тип связей в соединениях: FrCl и в металлическом Fr. Объяснить механизм образования этих связей. Показать соответствующие кристаллические решётки.
11. Объяснить механизм образования донорно-акцепторной связи на примере молекулы хлорида аммония NH4Cl.
12. Определить тип связей в соединении FeF2 и металлическом железе. Охарактеризовать связи между частицами в ионном и металлическом кристаллах.
13. Определить тип связи в молекуле SnCl4, тип гибридизации. Объяснить механизм ее образования, свойства. Показать графически форму молекулы.
14. Одинаковую ли геометрическую форму имеют молекулы: BCl3 и PCl3? На основании разницы относительных электроотрицательностей сравнить полярность молекул. Дать качественную оценку частичного (эффективного) заряда (δ) и дипольного момента (μ) для данных молекул.
15. Определить тип связи в молекуле Cl2. Показать механизм ее образования, написав электронные формулу и схему. Объяснить свойства этой связи: насыщаемость и направленность.
16. Определить тип связи в молекуле HCl. Показать механизм ее образования, написав электронные формулу и схему. Объяснить свойства этой связи: насыщаемость и направленность. Чем обусловлена полярность связи?
Какой количественной величиной характеризуется полярность молекулы?
17. Определить тип связи в молекуле H2S. Показать механизм ее образования, написав электронные формулу и схему. Объяснить свойства этой связи: насыщаемость и направленность. Чем обусловлена полярность связи?
Что характеризует дипольный момент?
18. Определить тип связи в молекуле АsH3. Показать механизм ее образования, написав электронные формулу и схему. Объяснить свойства этой связи: насыщаемость и направленность.
19. Определить тип связи в молекуле BeВr2. Показать механизм ее образования, написав электронные формулу и схему с учетом того, что один из атомов претерпевает гибридизацию электронных облаков. Объяснить свойства этой связи.
20. Определить тип связи в молекуле BI3. Показать механизм ее образования, написав электронные формулу и схему, с учетом того, что один из атомов претерпевает гибридизацию электронных облаков. Объяснить свойства этой связи.
21. Определить тип связи в молекуле SiH4. Показать механизм ее образования, написав электронные формулу и схему, с учетом того, что один из атомов претерпевает гибридизацию электронных облаков. Объяснить свойства этой связи.
22. Какая ковалентная связь называется π-связью? Какой тип связи имеется в молекуле N2? Объяснить механизм образования этой молекулы, написав электронные формулу и схему атома азота. Объяснить свойства данной связи.
Какая связь возникает между молекулами азота?
23. Определить тип связи в молекулах: HI, НBr, НСl. Для молекулы, имеющей наибольший дипольный момент (пользоваться величиной относительной электроотрицательности), показать механизм образования связи, ее свойства, написав электронные формулы и схемы атомов, составляющих данную молекулу.
24. Какой способ образования ковалентной связи называется донорно-акцепторным? Какие химические связи имеются в ионе BF4 ¯ (ВF3 + F ¯ )? Объяснить механизм их образования, написав электронные формулы и схемы атомов, составляющих этот ион. Учесть, что один из атомов претерпевает гибридизацию электронных облаков.
25. Имеется: фторид водорода HF и фторид натрия NaF. Определить тип связи в данных соединениях. Объяснить механизм образования соединения с ионной связью. Что отличает данные связи?
26. Какой тип связи имеется в кристалле натрия? Чем отличаются структуры кристаллов хлорида натрия — NaCl и металлического Na? Показать механизмы образования ионов в данных типах связи, написав электронные формулы их атомов и ионов.
27. Какие кристаллические структуры называются ионными, атомными, молекулярными, металлическими? Кристаллы каких веществ: алмаз, хлорид натрия, диоксид углерода (твердый) – «сухой лед», магний, имеют указанные структуры? Объяснить механизм образования связи в ионном и металлическом кристаллах.
28. Указать типы химической связи в комплексном соединении Na[BF4]. Чем отличаются механизмы образования обычной ковалентной связи от донорно-акцепторного? Пояснить, написав электронные формулы и схемы атомов элементов, составляющих данную молекулу.
29. Определить тип связи в молекулах NCl3 и BCl3. Чем определяется направленность связи? Объяснить, написав электронные формулы и схемы атомов элементов, образующих данные молекулы. Определить формы молекул с учетом того, что один из атомов, образующих молекулу, претерпевает гибридизацию.
30. Какие типы связей имеются в димере фтористого водорода H2F2 и ионе гидроксония H3O + ? Объяснить механизмы образования этих связей.
Источник: cyberpedia.su
В каких соединениях химическая связь имеет более ковалентный характер
Задача 993.
Закончить уравнения реакций:
а) Au(OH) 3 + HCl (конц.) →
б) AuCl 3 + H 2 O 2 + KOH →
в) AuCl 3 + SnCl 2 + H 2 O →
г) Au + NaCN + O2 + H2O →
д) Au + HCl + HNO3 → H[AuCl4] +
Решение:
а) Au(OH)3 + 3HCl (конц.) → AuCl3 + 3H2O;
б) AuCl3 + H2O2 + 2KOH → AuCl + 2KCl + O2↑ + 2H2O;
в) AuCl3 + SnCl2 + H2O → H[AuCl4] + SnOHCl;
г) Au + 8NaCN + O2 + 2H2O → 4Na[Au(CN)2] + 4NaOH;
д) Au + 4HCl + HNO3 → H[AuCl4] + NO↑ + 2H2O.
Задача 994.
В каком из соединений — КСI или АgС1 — химическая связь имеет более ковалентный характер? Чем это можно объяснить?
Решение:
Относительная электроотрицательность элементов K, Ag и Cl соответственно равны 0,93, 1,46 и 2,9. Разность электроотрицательностей элементов в связях К — Cl и Ag — Cl соответственно равны 1,97 (2,9 – 0,93 = 1,97) и 1,44 (2,9 – 1,46 = 1,44). Таким образом, связь
Ag — Cl более ковалентна, чем связь К — Cl, так как 1,44 < 1,97.
Задача 995.
Кусочек серебряной монеты массой 0,300 г растворили в азотной кислоте и осадили из полученного раствора серебро в виде АgС1. Масса осадка после промывания и высушивания оказалась равной 0,199 г. Сколько процентов серебра (по массе) содержалось в монете?
Решение:
Уравнения реакций имеют вид:
Согласно закону эквивалентов вещества реагируют друг с другом в эквивалентных отношениях, поэтому
(Ag) = (AgNO3) = (AgCl).
Рассчитаем массу серебра:
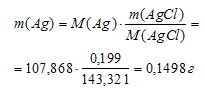
Рассчитаем массовую долю серебра в образце:
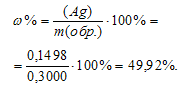
Ответ: 49,92%.
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Ковалентность связи.Задачи 993 — 995
Источник: buzani.ru