Сахароза — это твёрдое кристаллическое вещество со сладким вкусом. Сахароза хорошо растворяется в воде (при (100)(°C) в (100) г воды может раствориться (487) г этого вещества).
При нагревании сахароза легко плавится, а при застывании образует карамель — прозрачную твёрдую массу.
Химические свойства
1. Свойства многоатомных спиртов
В молекуле сахарозы есть восемь гидроксильных групп, и ей характерны реакции многоатомных спиртов. Так, если к раствору сахарозы добавить свежеосаждённый гидроксид меди((II)), то наблюдается растворение осадка и образуется ярко-синий раствор сахарата меди((II)):
C 12 H 22 O 11 + Cu ( OH ) 2 → C 12 H 20 O 11 Cu + 2 H 2 O .
Обрати внимание!
В отличие от глюкозы при нагревании сахарозы с гидроксидом меди((II)) красный осадок не образуется, так как в молекуле сахарозы нет альдегидной группы. Это невосстанавливающий сахар. Нет у сахарозы и реакции серебряного зеркала.
Смотри видео.
Как многоатомный спирт сахароза может вступать в реакцию этерификации с карбоновыми кислотами.
2. Гидролиз
Углеводы. Глюкоза. Олигоса- хариды. Сахароза
В присутствии ферментов или при нагревании раствора сахарозы в присутствии кислоты происходит гидролиз и её молекулы распадаются на молекулы глюкозы и фруктозы:
C 12 H 22 O 11 + H 2 O ⟶ H + C 6 H 12 O 6 глюкоза + C 6 H 12 O 6 фруктоза .
Образование глюкозы можно подтвердить качественными реакциями на альдегидную группу — реакцией серебряного зеркала или образованием красного осадка при нагревании с гидроксидом меди((II)).
Смотри видео.
3. Горение и разложение
Поджечь сахарозу можно в присутствии солей лития (содержатся в пепле от сигарет), при горении образуются углекислый газ и вода:
C 12 H 22 O 11 + 12 O 2 → 12 CO 2 + 11 H 2 O .
При нагревании, а также под действием концентрированной серной кислоты сахароза разлагается и обугливается:
C 12 H 22 O 11 → 12 C + 11 H 2 O .
Применение сахарозы
Сахароза — пищевое вещество. В организме под действием ферментов она быстро расщепляется на глюкозу и фруктозу, которые кровью доставляются к клеткам и используются в процессах обмена веществ. Но увлекаться сладким не надо, его избыток в пище может привести к проблемам со здоровьем — вызвать кариес или стать причиной сахарного диабета.
Сахароза (сахар) продаётся в магазинах, а также используется в пищевой промышленности для придания продуктам сладкого вкуса и в качестве консерванта.
Источник: www.yaklass.ru
Опыты по химии. Углеводы

Докажем, что в состав молекулы сахарозы входят гидроксильные группы.
Прильем к раствору сахарозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае сахароза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Продукт реакции – сахарат меди (II).
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)
Доказать наличие альдегидной группы в глюкозе можно с помощью аммиачного раствора оксида серебра. К аммиачному раствору оксида серебра добавим раствор глюкозы и подогреем смесь на водяной бане. Вскоре на стенках колбы начинает осаждаться металлическое серебро. Эта реакция называется реакцией серебряного зеркала. Ее используют как качественную для открытия альдегидов.
Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту.
СН2ОН – (СНОН)4 – СОН + Ag2O = СН2ОН – (СНОН)4 – СООН + 2Ag↓
Реакцию серебряного зеркала используют в промышленности для серебрения зеркал, изготовления колб для термосов, елочных украшений.
Оборудование: колба круглодонная, горелка, стакан, штатив, прокладка огнезащитная.
Техника безопасности. Аммиачный раствор оксида серебра нельзя хранить. После опыта неиспользованный раствор нейтрализуют соляной кислотой.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественная реакция глюкозы с гидроксидом меди (II)
Глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу. Поэтому она относиться к альдегидоспиртам. Ее химические свойства похожи на свойства многоатомных спиртов и альдегидов. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи.
Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться.
Сначала образуется желтый осадок Cu2O, который с течением времени образует более крупные кристаллы CuO красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Кислотный гидролиз крахмала
В присутствии кислот крахмал гидролизуется. При гидролизе крахмала образуется глюкоза. Экспериментально проверим это. Прокипятим смесь крахмального клейстера и серной кислоты. Полноту гидролиза будем проверять с реакцией с йодом. Гидролиз проводится до тех пор, пока реакция с йодом не станет отрицательной, т. е. проба раствора не будет давать с йодом синего окрашивания.
Проверим наличие глюкозы в полученном растворе. Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. Нагреем раствор.
Выпадает красный осадок оксида меди (I).
(С6Н10О5)n + n Н2О = n С6 Н12О6
Углеводы. Фармацевтический анализ углеводов
Углеводы составляют обширную группу природных веществ, выполняющих в растительных и животных организмах разнообразные функции. Углеводы получают главным образом из растительных источников. Это связано с тем, что углеводы являются первичными продуктами фотосинтеза, осуществляемого растениями из оксида углерода и воды. Углеводы представляют своеобразный мост между неорганическими и органическими соединениями.
Название — «углеводы» возникло потому, что многие представители этого класса имеют общую формулу Сn(Н2О)m, и формально могут быть отнесены к «гидратам углерода».
Наиболее значимым ЛС данной группы является глюкоза. К группе углеводов относятся также сахароза, лактоза, галактоза и крахмал (табл. 11).
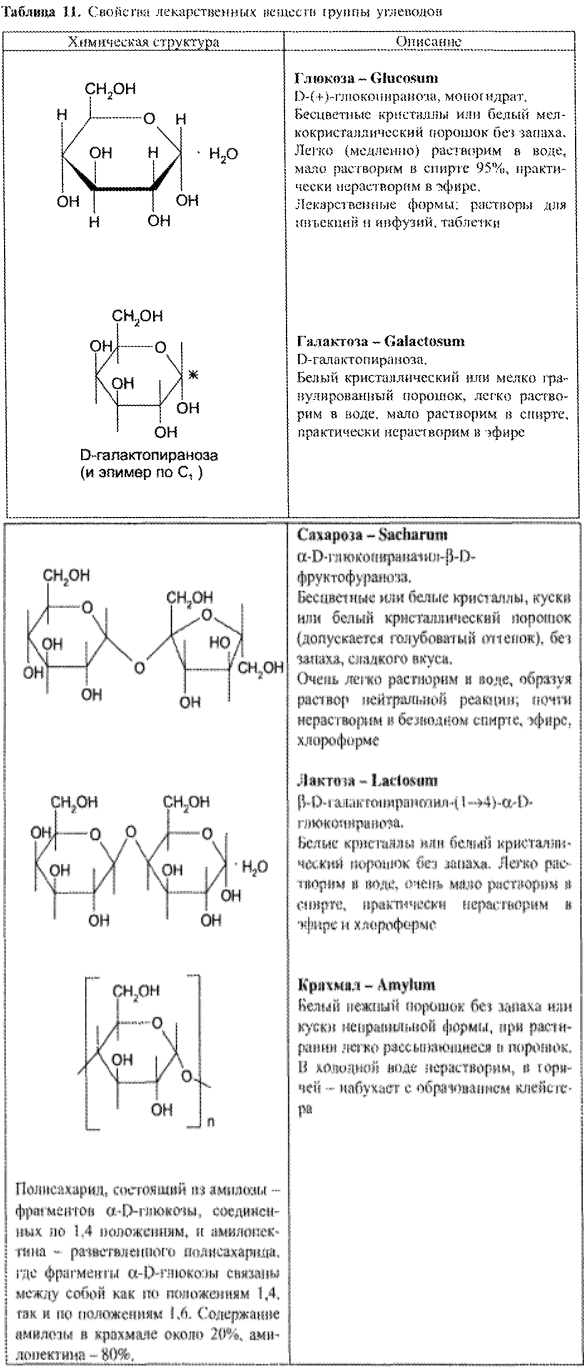
Требования НД к качеству глюкозы как лекарственному средству соответствуют требованиям к химически чистым веществам. Характерными физическими свойствами глюкозы являются следующие: — определённая форма крупных или мелких кристаллов, оптическая активность с сильно выраженным вращением плоскости поляризации (удельное вращение 10% раствора глюкозы +52,3°), Тпл безводной глюкозы.
Для глюкозы, которую получают в виде моногидрата, количество кристаллизационной воды является показателем качества ЛС. Содержание кристаллизационной воды должно составлять 10% от массы глюкозы моногидрата.
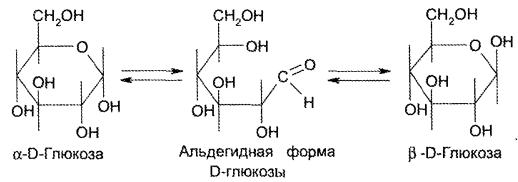
Определение удельного вращения глюкозы имеет свои особенности. В свежеприготовленных растворах глюкозы происходит мутаротация (изменение во времени величины угла вращения; через определенный временной интервал эта величина становится постоянной).
Мутаротацию можно ускорить путем прибавления к раствору глюкозы раствора аммиака (не более 0,1%). Если определять угол вращения глюкозы сразу после ее растворения и без прибавления к раствору аммиака, то этот показатель составит +109,16° и конечного значения +52,3° достигнет только через несколько часов.
Явление мутаротации объясняется тем, что при растворении глюкозы, которая в кристаллическом состоянии находится в какой-либо одной циклической форме, образуется ее альдегидная форма, через которую получаются аномерные циклические формы глюкозы: α и β — формы, различающиеся расположением полуацетального гидроксила относительно 1-го углеродного атома. Для α -D-глюкозы величина угла вращения составляет +109,6°, а для β-D-глюкозы +20,5°. Конечное значение угла вращения соответствует состоянию равновесия между α- и β — формами, которые через альдегидную форму в растворе превращаются друг в друга:
ХИМИЧЕСКИЕ СВОЙСТВА
Глюкоза и галактоза относятся к моносахаридам, сахароза и лактоза — к олигосахаридам, крахмал — к полисахаридам. Моносахариды, являясь веществами с двойственными функциями, вступают во многие реакции, характерные для спиртов и карбонильных соединений (альдегидов). Олигосахариды и полисахариды подвергаются гидролизу (ферментативному или кислотному) с образованием соответствующих моносахаридов.
Как многоатомные спирты глюкоза, галактоза, сахароза и лактоза (подобно этиленгликолю и глицерину) способны взаимодействовать с меди (II) гидроксидом с образованием комплексных соединений синего цвета (химизм — см. с. 100).
Лекарственные вещества группы углеводов способны также к реакциям этерификации.
Окисление, В зависимости от условий окисления моносахариды превращаются в различные продукты, В щелочной среде моносахариды окисляются под воздействием таких мягких окислителей, как реактивы Толленса и Фелинга (химизм — см. с, 107). С реактивом Толленса проходит реакция «серебряного зеркала», которая характерна для альдегидов. Следовательно, в эту реакцию моносахариды вступают в своей открытой (альдегидной) форме.
С реактивом Фелинга моносахариды образуют Сu2О красно-оранжевого цвета. И в этом случае моносахарид реагирует в открытой форме за счет альдегидной труппы. Обе реакции используются для обнаружения моносахаридов (например, глюкозы) в биологических жидкостях (кровь, моча).
Гликозиды и другие производные углеводов, не содержащие по- луацет:шьного гидроксила., не могут переходить в альдегидную форму и поэтому не обладают восстанавливающей способностью и не дают реакций с указанными реактивами.
В нейтральной среде окислению подвергается только альдегидная группа. При этом образуются альдоновые кислоты, которые в кислой среде, отщепляя воду, превращаются в лактоны.
Образование озазонов. При нагревании моносахаридов с фенил- гидразином сахара превращаются в кристаллические соединения, плохо растворимые в воде, — озазоны. На 1-й стадии образуется фенилгидразон, который перегруппировывается в ходе внутримолекулярной окислительно-восстановительной реакции в моноимин 1,2-дикарбонильного соединения. Из последнего образуется озазон:
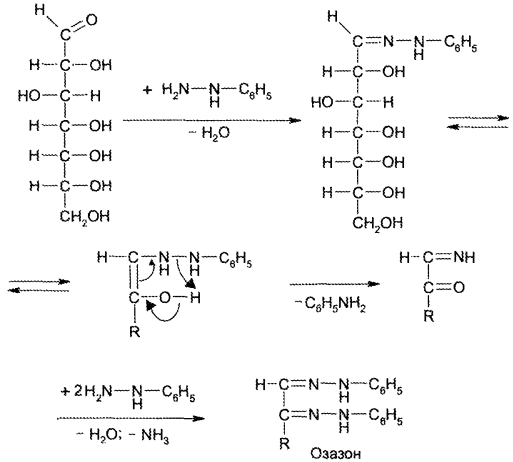
Озазоны — кристаллические вещества желтого цвета с четкой Тпл Реакция образования озазонов широко используется для установления подлинности сахаров, а также для выделения их из смесей.
АНАЛИЗ ИНДИВИДУАЛЬНЫХ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Глюкоза (декстроза)
Подлинность. ФС в качестве испытания подлинности приводит реакцию окисления глюкозы реактивом Фелинга (химизм — см. с. 107).
Известны и другие чувствительные и специфические реакции на глюкозу, не включенные в НД. Так, преобразование глюкозы в ме- тилфурфурол является чувствительной реакцией, которая основана на получении фурфурола из глюкозы при действии концентрированных серной или хлороводородной кислот с одновременным взаимодействием фурфурола с каким-либо фенолом (резорцином, тимолом, а-нафтолом) или ароматическим амином:
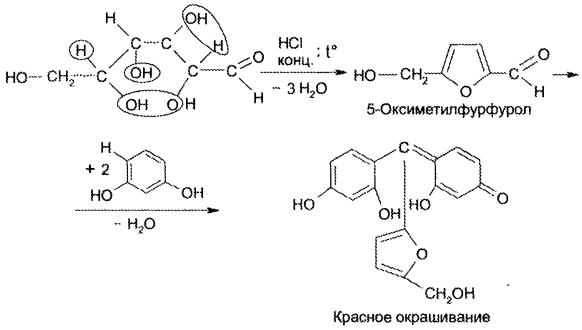
С меди (II) сульфатом глюкоза при подщелачивании (без нагревания!) образует растворимый фиолетово-синий комплекс; при стоянии раствора происходит окислительно- восстановительная реакция с выделением Сu2О. Таким образом, одновременно доказывается наличие и альдегидной, и спиртовых функциональных групп.
Регламентируется также определение удельного вращения. Измерение угла вращения проводят после прибавления к испытуемому раствору 2 капель раствора аммиака для предотвращения мутаротации.
Чистота, Статья ГФ на глюкозу включает стандартные испытания: прозрачность и цветность раствора, кислотность, присутствие хлоридов, сульфатов, кальция, бария, декстрина, мышьяка. Растворы для инъекций дополнительно проверяют на пирогенность.
Количественное определение. ГФ не регламентирует количественное определение субстанции. В препаратах глюкозы, в частности в растворах для инъекций, глюкозу определяют поляриметрически.
Сахароза
Сахароза является невосстанавливающим дисахаридом (олигосахаридом), так как образование гликозидной связи произошло за счет полуацетальных гидроксилов глюкозы и фруктозы. Поэтому сахароза не окисляется (в обычных условиях) реактивами Толленса и Фелинга. Сахароза — самый распространенный дисахарид, главный источник углеводов в пище человека. В фармации сахарозу применяют в виде сиропа — средство для улучшения вкуса.
Подлинность. Как многоатомный спирт сахароза образует с раствором кобальта (И) нитрата в присутствии эквивалентного количества натрия гидроксида комплекс фиолетового цвета.
Британская фармакопея (2001) регламентирует регистрацию ИК- спектра, а также ТСХ с использованием в качестве свидетелей стандартного образца сахарозы и других дисахаридов.
Чистота. Определение проводят так же, как у глюкозы.
Количественное определение не проводят.
Лактоза
Подлинность. У лактозы гликозидная связь образована между полуацетальным и спиртовым (С4) гидроксилами, поэтому подлинность лекарственного вещества доказывают прибавлением при нагревании реактива Фелинга. В результате выпадает кирпично-красный осадок меди (I) оксида (химизм — см. с. 107).
Чистота, Определение проводят так же, как у глюкозы.
Количественное определение не проводят.
Похожие записи:
А Вам помог наш сайт? Мы будем рады если Вы оставите несколько хороших слов о нас.
- (0)
- Главная страница (0)
- Каталог (0)
- Документы (5)
- Федеральные законы (4)
- Постановления Правительства РФ (0)
- Приказы Минздрав РФ (1)
- Фармацевтическая технология (19)
- Фармацевтическая химия (77)
- Фармакология (206)
- Фармакогнозия (71)
- Управление и экономика фармации (81)
- Токсикологическая химия (98)
- Патологическая физиология (129)
- Нормальная физиология (64)
- Органическая химия (19)
- Микробиология (126)
- ГО, МК, МПЗ, военная токсикология (110)
- Биохимия (46)
- Аналитическая химия (30)
- Патологическая анатомия (37)
- Стоматология (41)
- Анатомия (172)
- Биотехнология (19)
- Кардиология (61)
- Ревматология (13)
- Неврология (62)
- Геронтология (11)
- Латинский язык (0)
- Акушерство и гинекология (108)
- Дерматовенерология (49)
- Биология (121)
- Гигиена (63)
- Химия общая (20)
- Химия физическая (4)
- Судебная медицина (29)
- Нефрология (18)
- Этика и деонтология (61)
- Ботаника (75)
- Анатомия лучевая (76)
- Иммунология, аллергология (30)
- Офтальмология (15)
- Фармацевтическая технология (4)
- Фармацевтическая химия (8)
- Фармакология (71)
- Фармакогнозия (20)
- Управление и экономика фармации (29)
- Токсикологическая химия (5)
- Патологическая физиология (74)
- Нормальная физиология (8)
- Микробиология (5)
- Биохимия (10)
- Аналитическая химия (30)
- ГО, МК, МПЗ, военная токсикология (7)
- Биотехнология (1)
- Стоматология (6)
- Анатомия (6)
- Дерматовенерология (5)
- Акушерство и гинекология (3)
- Гигиена (0)
- НМО (8)
- Токсикологическая химия (1)
- Токсикологическая химия Т. Х. Вергейчик (9)
- Основы фармацевтической биотехнологии (13)
- Фармтехнология (21)
- Фармацевтическая химия (23)
- Фармакогнозия (97)
- Управление и экономика фармации (8)
- Биотехнология (10)
- Биохимия (1)
- Государственная фармакопея (ГФ) (405)
Источник: farmf.ru