Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0,40403 нм. Температура плавления чистого металла 660°C, температура кипения около 2450°C, плотность 2,6989 г/см 3 . Температурный коэффициент линейного расширения алюминия около 2,5·10 -5 К -1 . Стандартный электродный потенциал Al 3+ /Al –1,663В.
Легче алюминия только щелочные и щелочноземельные металлы (кроме бария), бериллий и магний. Плавится алюминий тоже легко – при 600° С (тонкую алюминиевую проволоку можно расплавить на обычной кухонной конфорке), зато кипит лишь при 2452° С. По электропроводности алюминий – на 4-м месте, уступая лишь серебру (оно на первом месте), меди и золоту, что при дешевизне алюминия имеет огромное практическое значение.
В таком же порядке изменяется и теплопроводность металлов. В высокой теплопроводности алюминия легко убедиться, опустив алюминиевую ложечку в горячий чай. И еще одно замечательное свойство у этого металла: его ровная блестящая поверхность прекрасно отражает свет: от 80 до 93% в видимой области спектра в зависимости от длины волны. В ультрафиолетовой области алюминию в этом отношении вообще нет равных, и лишь в красной области он немного уступает серебру (в ультрафиолете серебро имеет очень низкую отражательную способность).
Алюминий. Химические и физические свойства.
Чистый алюминий – довольно мягкий металл – почти втрое мягче меди, поэтому даже сравнительно толстые алюминиевые пластинки и стержни легко согнуть, но когда алюминий образует сплавы (их известно огромное множество), его твердость может возрасти в десятки раз.
Источник: www.allmetals.ru
Опишите физические свойства алюминия?
Алюминий типичный металл, который обладает кристаллической решеткой и следовательно имеет свободные электроны. Отсюда его высокая электропроводность, по которой он уступает немногим металлам, меди, серебру, золоту, его высокая теплопроводность — алюминий очень легко нагревается.
Также к физическим свойствам отнесем не самую высокую твердость, но зато очень высокую пластичность. Алюминий плавится при температуре 660 градусов Цельсия, а закипает при температуре 2500 градусов. Алюминий не отличается высокой плотностью, это весьма легкий металл, но все-таки в два с половиной разя более плотный, чем вода.
К физическим свойствам металла также относят его цвет — алюминий светлый, серебристо-белый. При температуре в 1.2 Кельвина становится сверхпроводником. Слабый парамагнетик.
Источник: www.bolshoyvopros.ru
Презентация на тему Алюминий, его физические и химические свойства
Цели урока: Дать характеристику алюминия по его положению в периодической системе химических элементов. На основе строения атома рассмотреть его физические и химические свойства. Познакомиться с промышленным способом получения алюминия и
Химия 9 класс (Урок№25 — Алюминий. Свойства алюминия. Амфотерность оксида и гидроксида алюминия.)
- Главная
- Физика
- Алюминий, его физические и химические свойства
Слайды и текст этой презентации
Слайд 1
Тема урока: «Алюминий, его физические и химические
свойства».
Из глины я обыкновенной,
Но я на
редкость современный. Я не боюсь электротока, Бесстрашно в воздухе лечу; Служу на кухне я без срока — Мне все задачи по плечу. Горжусь своим я именем: Зовусь я .

Слайд 2Цели урока:
Дать характеристику алюминия по его положению
в периодической системе химических элементов.
На основе
строения атома рассмотреть его физические и химические свойства.
Познакомиться с промышленным способом получения алюминия и указать области его применения.

Слайд 3
Из истории открытия алюминия… «Серебро из глины»
В период открытия алюминия этот металл был
дороже золота. Англичане хотели почтить богатым подарком великого русского химика
Д.И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая — из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции.

Слайд 4Интересные факты
Немецкий учёный Ф.Велер
(1827 г.)
Памятник
Дж.
Вашингтону
В лунном грунте обнаружен алюминий
Самый большой телескоп в России

Слайд 5Применение алюминия

Слайд 6Авиастроение
Применение алюминия и его сплавов во всех
видах транспорта, а в особенности воздушного привело
к уменьшению собственной массы транспортных средств и к резкому увеличению эффективности их использования.

Слайд 7Кораблестроение
Алюминий и его сплавы применяют при
отделке и изготовлении корпусов и дымовых труб
судов, спасательных лодок, радарных мачт, трапов.

Слайд 8Машиностроение
Моторы, блоки, головки цилиндров, картеры, коробки передач,
насосы и многие другие детали также изготавливают
из алюминия и его сплавов.

Слайд 9Пищевая промышленность
Алюминиевая фольга дешевле оловянной и полностью
заменила ее как упаковочный материал для пищевых
продуктов. Все больше и больше используется алюминий при изготовлении тары для консервирования и храпения продуктов сельского хозяйства.

Слайд 10Электротехника
Алюминий и его сплавы используют
в электротехнической промышленности для изготовления кабелей, шинопроводов,
конденсаторов, выпрямителей переменного тока.

Слайд 11Военная промышленность
Алюминий, а также
его сплавы является стратегическим металлом и
широко используется в военной промышленности при строительстве военной техники и оружия: самолетов, танков, артиллерийских установок, ракет, зажигательных веществ, а также для других целей в военной технике.

Слайд 12Строительство
Алюминий и его сплавы применяются в промышленном
и гражданском строительстве при изготовления каркасов зданий,
ферм, оконных рам, лестниц и др. конструкций.

Слайд 13
Периодическая система химических элементов Д.И.Менделеева
Периоды
1
2
3
4
5
6
7
Ряды
1
2
3
4
10
9
8
7
5
6
Группы элементов
I
II
VI
V
VII
III
IV
VIII

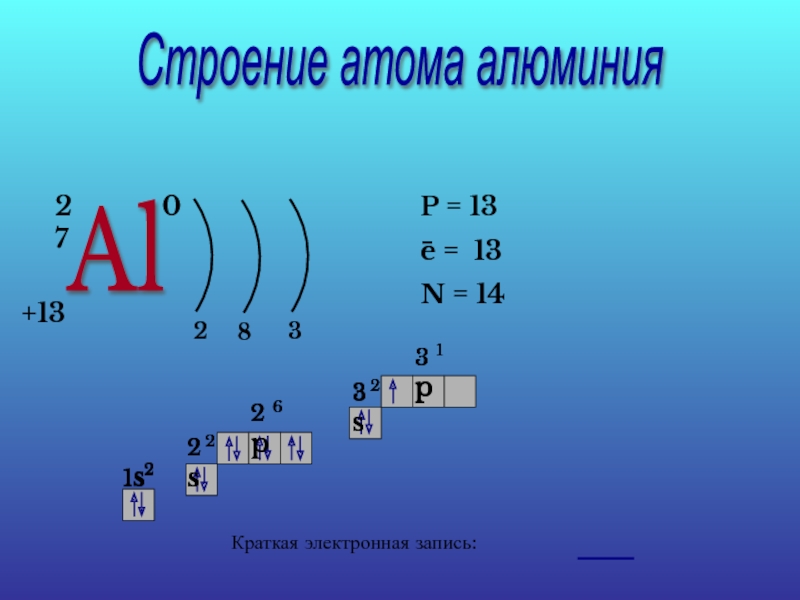
Слайд 14Строение атома алюминия
Al
27
+13
= 13
N = 14
−
Краткая электронная запись:
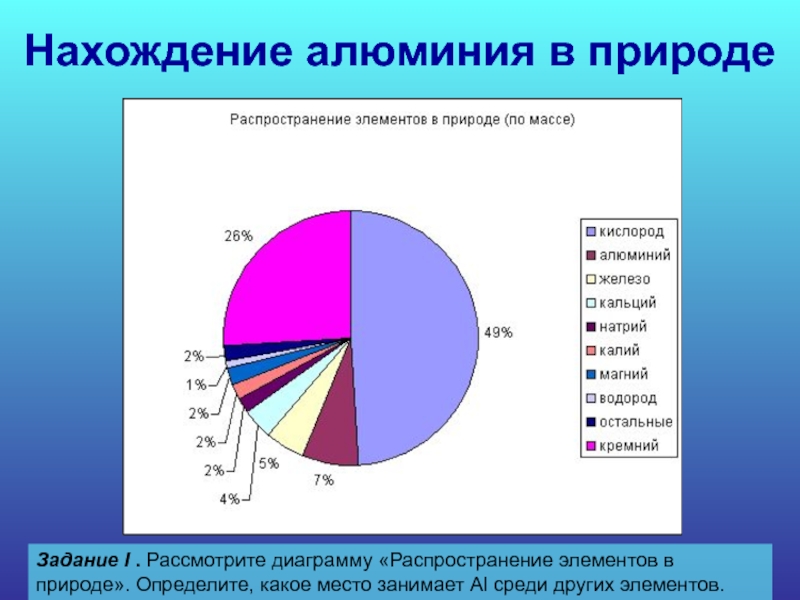
Слайд 15Нахождение алюминия в природе
Задание I . Рассмотрите
диаграмму «Распространение элементов в природе». Определите, какое
место занимает Al среди других элементов.
Слайд 16Природные соединения алюминия
Задание II. Рассмотрите
образцы природных соединений, сравните их по твердости,

Слайд 17Физические свойства алюминия. Лабораторная работа.
Инструктивная карта.
1. Рассмотрите алюминиевую
пластинку.
2. Определите агрегатное состояние вещества алюминия.
3. Какого
цвета пластинка?
4. Определите, имеет ли блеск данная пластина?
5. Опустите пластинку на ¼ её длины в стакан с горячей водой на 10-15 секунд.
Вытащите пластинку из воды, протрите салфеткой и определите, обладает ли алюминий теплопроводностью?
6. Возьмите в руки алюминиевую фольгу. Определите, обладает ли алюминий пластичностью? Лёгкий ли это металл?
7. Поместите в стакан с холодной водой алюминиевую пластинку, проверните несколько раз. Наблюдается растворение алюминия?
8. Кратко запишите свои наблюдения согласно плану:
— агрегатное состояние,
— цвет,
— блеск,
— теплопроводность,
— пластичность,
— растворимость в воде.

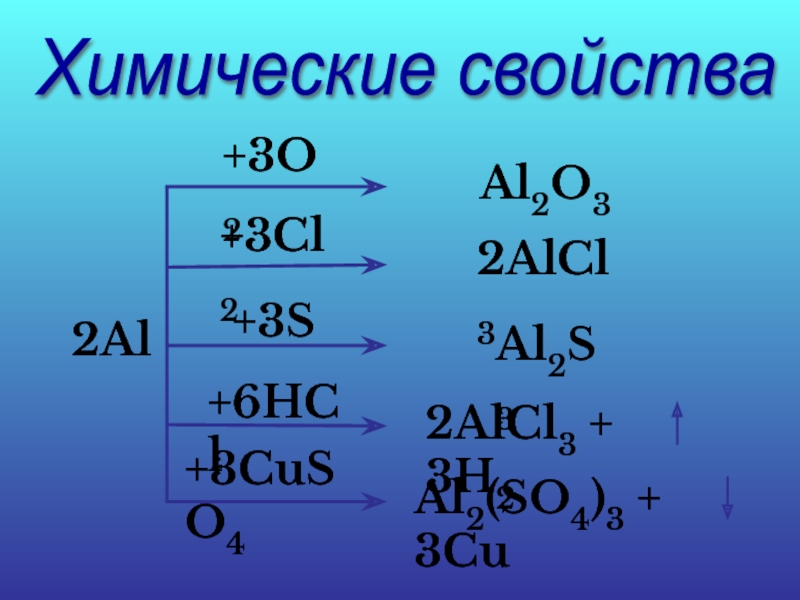
Слайд 18Химические свойства
2Al
+3O2
Al2O3
+3Cl2
2AlCl3
+3S
Al2S3
+6HCl
2AlCl3 + 3H2
+3CuSO4
Al2(SO4)3 + 3Cu
Слайд 19Лабораторная работа: «Химические свойства алюминия».
Инструктивная карта.
1. Возьмите
две пробирки. В каждую положите по кусочку
алюминия. Прилейте в одну из них 1-2 мл раствора соляной кислоты, а в другую столько же раствора серной кислоты. Что наблюдаете? Пробирки слегка нагрейте. Запишите уравнения соответствующих реакций.
2. Кусочек алюминия положите в пробирку. Прилейте 1,5 мл концентрированной серной кислоты. Что наблюдаете? Запишите уравнение реакции.
3. В пробирку поместите кусочек алюминия и прилейте раствор щёлочи. Содержимое пробирки нагрейте. Что происходит? Запишите уравнение реакции.
4. Результаты проделанной работы оформите в таблицу:

Слайд 20Вывод:
Алюминий является амфотерным элементом: взаимодействует с
кислотами и со щелочами.
2Al + 6HCl =
2AlCl3 + 3H2
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2

Слайд 21Получение алюминия в промышленности
Алюминий получают электрохимическим методом
из бокситов.
2Al2O3 ток> 4Al + 3O2

Слайд 22Тест
1.Какова электронная конфигурация атома алюминия?
А) 1s22s22p1 Б)1s22s22p3
B) 1s22s22p63s23p1 Г)
1s22s22p63s23p63d14s2
2. С какими из указанных веществ реагирует
алюминий?
А) СаО Б) HCl
B) Cl2 Г) NaOH
3. Какие из указанных металлов являются более активными,
чем алюминий?
А) Na Б) Cu
B) Ca Г) Fe
4. Наиболее характерная степень окисления алюминия:
А) +1 Б) +2
В) +3 Г) +4
5. Алюминий в химических реакциях проявляет свойства:
А) окислителя Б) инертного соединения
В) восстановителя Г) окислителя и восстановителя
6. В промышленности алюминий получают:
А) используя в качестве восстановителя металлический натрий
Б) электролизом расплава оксида алюминия
В) используя в качестве восстановителя оксид углерода (П)
Г) электролизом раствора солей алюминия
Источник: thepresentation.ru