
Что такое кристаллическое строение твердых тел

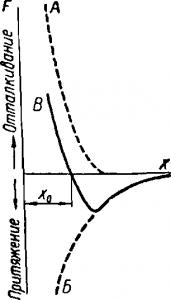
Твердые тела по сравнению с газами и жидкостями характеризуются наименьшим расстоянием между частицами и наиболее значительными молекулярными силами как притяжения, так и отталкивания. Величина этих сил зависит от расстояния х между частицами: при уменьшении расстояния силы возрастают, при уве личении — быстро убывают.
При этом в обоих случаях силы отталкивания с изменением расстояния изменяются в большей степени, чем силы притяжения (рис. 2, кривая А —силы отталкивания, кривая Б —силы притяжения).
Если для данного тела произвести сложение сил отталкивания и притяжения (т. е. для каждого значения расстояния х произвести алгебраическое сложение ординат этих кривых), то получится результирующая кривая В, из которой видно, что при некотором расстоянии х0 между молекулами силы отталкивания и притяжения уравновешивают друг друга; на этом расстоянии в среднем и находятся молекулы в веществе.
Взаимодействие элементарных частиц, 1984
Молекулярные силы имеют упругий характер. Поэтому частицы в твердых телах совершают колебания около точек своего среднего положения. Колебания происходят во всех направлениях и имеют беспорядочный характер, свойственный молекулярному движению.
Молекулярные силы обусловлены взаимодействием имеющихся в атомах электрических зарядов. Однако во многих случаях это взаимодействие имеет более сложный характер, чем кулоновские силы, действующие между свободными зарядами.
Кристаллическое строение
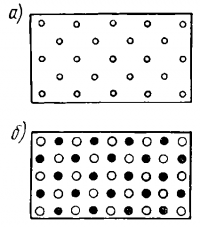
Характерным для твердых тел является кристаллическое строение, т е. упорядоченное, геометрически правильное расположение частиц в веществе. Совокупность точек, определяющих расположение частиц (атомов, ионов, молекул) в общей структуре вещества, называется пространственной (или кристаллической) решеткой. В зависимости от природы вещества-решетки разделяются на атомные, ионные, металлические и молекулярные.
Простые вещества имеют атомную решетку. Молекулярные силы в них образуются в результате обмена электронами и образования между атома ми общих электронных оболочек. Два электрона от разных атомов с противоположно направленными спинами спариваются на одной орбите и связывают ядра этих атомов силой притяжения.
Между атомами образуется обменная или ковалентная связь, отличающаяся высокой прочностью. Ковалентная связь атомов характерна для органических веществ, хотя часто встречается и у неорганических. Последние отличаются твердостью, высокой температурой плавления и малой растворимостью.
На рис. 3 показаны условные плоскостные схемы различных пространственных решеток. Схема атомной решетки — рис. 3, а.
Урок 276. Сила Лоренца. Движение заряженных частиц в магнитном поле
В веществах с ионным строением каждый ион связан с окружающими его ионами противоположного знака силами электростатического притяжения. Пример — кристалл поваренной соли с кубической пространственной решеткой . Условная плоскостная схема ионной решетки — рис. 3, б. Вещества с ионным строением тверды, хрупки, имеют высокую температуру плавления и хорошо растворимы в воде.
Пространственная решетка в металлах
В металлах пространственная решетка состоит из атомов, потерявших: наиболее слабо связанные с ядром внешние электроны, т. е. из ионов. Оторвавшиеся электроны называют свободными электронами. В процессе теплового движения они беспорядочно перемещаются по всей массе металла и, взаимодействуя с ионами, создают силы, связывающие эти ионы в одну общую массу вещества. Наличие в металлах свободных электронов обусловливает их высокую теплопроводность и электропроводность. Плоскостная схема металлической решетки — рис. 3, е.
В веществах с молекулярным строением в узлах пространственной решетки расположены молекулы. Связь между ними образуется так называемыми силами Ван-дер-Ваальса, которые возникают как силы притяжения между электрическими диполями (рис. 4 ). Эти диполи могут быть постоянными, как, например, у молекул, полярных от природы , они могут индуцироваться вследствие поляризации молекул при их взаимном сближении и, наконец, можно считать, что мгновенные диполи, непрерывно меняющие свою величину и направление, образуются в процессе движения электронов вокруг ядер атомов.
Силы отталкивания между атомами или молекулами связывают с взаимным отталкиванием электронных оболочек атомов при сближении их на достаточно малое расстояние.
Связь через силы Ван-дер-Ваальса является наиболее универсальной в природе и встречается не только у твердых тел и жидкостей органической или неорганической природы, но и у газов. Твердые вещества с молекуляр ным строением мягкие, с низкой температурой плавления, большей частью хорошо растворимые. Плоскостная схема молекулярной решетки с двух атомными молекулами — рис. 3 , е.
Решетка кристаллов в реальных условиях
В реальных условиях пространственная решетка кристаллов часто имеет те или иные нарушения, проявляющиеся в виде местного беспорядочного расположения атомов или молекул, а также включения, например, в атомную или молекулярную решетку ионов того же вещества или даже атомов и молекул посторонних веществ.
Упорядоченное расположение атомов или молекул может обусловливать некоторое отличие физических свойств вещества по различным направлениям. Это свойство кристаллических тел называется анизотропией. Анизотропия проявляется, например, в том, что механическая прочность вещества в различных направлениях неодинакова и при раздроблении кристалл раскалывается на мелкие части, которые сохраняют такую же геометрическую форму. По различным направлениям могут различаться также теплопроводность, электропроводность, оптические свойства и т. д.
Монокристаллом называется кристаллическое тело, которое имеет одну общую пространственную решетку. Таковы, например. кристаллы кварца, алмаза, квасцов и др.
Тела, состоящие из мелких кристаллов различной величины, .расположенных в беспорядке, и не всегда сохраняющих свою правильную форму , на зываются поликристаллическими. Большинство тел имеют поли кристаллическую структуру. Вследствие беспорядочного расположения мелких кристаллов анизотропия у поликр исталлических тел не проявляется.
Существует также аморфное с остояние твердых тел, которое характе ризуется беспорядочным расположе нием частиц вещества. Аморфное строе ние имеют, например, стекло, смолы и др. Физические свойства аморфных тел не зависят от направления. Такие вещества называются изотропными.
Статья на тему Кристаллическое строение твердых тел
Похожие страницы:
Агрегатные состояния вещества В предыдущих главах мы познакомились со строением атомов и молекул — мельчайших частиц, из которых состоят все.
Теория атомного ядра Как только выяснилось существование нейтронов, было предложено совершенно новое представление о строении ядра, впервые высказанное и обоснованное советским.
Молекулярно кинетическая теория МКТ это теория которая рассматривает свойства вещества, которые обусловлены его молекулярным строением: превращения вещества при изменении энергии.
Что такое строение вещества Атомы и молекулы Атомная теория Дальтона Гипотеза Авогадро Теория химического строения Периодический закон и система элементов.
Внутреннее строение кристаллов Давно предполагали, что внешняя форма кристалла является лишь отображением его скрытого внутреннего строения и обусловлена правильным расположением.
Химическая связь Строение молекул [no_toc] Это взаимодействие атомов которая имеет электрическую природу, происходит в результате движения наружных частиц в результате.
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Источник: znaesh-kak.com
Презентация, доклад по химии на тему Кристаллические решетки
Состав и номенклатура основных классов неорганических соединений1. Составьте формулы следующих солей: сульфата алюминия, нитрата железа (III), фосфата магния, фосфата натрия, силиката калия, нитрата меди (II). 2. Названия следующих солей: KCl, Na2SO4, Al(NO3)3, K2CO3, Fe2S3, FePO4, CaSiO3, BaSO3. 3.
- Главная
- Химия
- Презентация по химии на тему Кристаллические решетки
Слайд 1Кристаллические и аморфные вещества.
Кристаллические решётки.

Слайд 2Состав и номенклатура основных классов неорганических соединений
1. Составьте формулы следующих солей:
сульфата алюминия, нитрата железа (III), фосфата магния, фосфата натрия, силиката калия, нитрата меди (II).
2. Названия следующих солей: KCl, Na2SO4, Al(NO3)3, K2CO3, Fe2S3, FePO4, CaSiO3, BaSO3.
3. NaOH, H3PO4, Cu(OH)2, KNO3, Ca(OH)2, Na2O, HNO3, Al2O3, K3PO4, H2SO4, FeCl2, NO2, SO3, H2CO3, PbSiO3, Fe(OH)2.

Слайд 3Что объединяет вещества?
Поваренная соль
Полиэтилен
Железо
Янтарь
Алмаз
Жемчуг

Слайд 4Что отличает вещества?
Поваренная соль
Полиэтилен
Железо
Янтарь
Алмаз
Жемчуг

Слайд 5Классификация твёрдых веществ
Кристаллические
упорядоченное расположение частиц (атомов, молекул или ионов) в строго
определённых точках пространства;
наличие постоянной температуры
плавления.
отсутствие строгого порядка в расположении частиц;
отсутствие постоянной температуры плавления;
текучесть.

Слайд 6Кристаллические вещества
Железо
Поваренная соль
Алмаз
Графит
Сахароза

Слайд 7Аморфные вещества
Янтарь
Жемчуг
Канифоль
Полиэтилен
Стекло
Пчелиный воск

Слайд 8
Кристаллические вещества.
Типы кристаллических решёток.
Почему изделие из кремния при ударе
раскалывается
на кусочки,
а изделие из свинца
только расплющивается?

Слайд 9Пространственная структура, отражающая расположение образующих вещество частиц в твёрдом агрегатном состоянии,
называется кристаллической решёткой.
Слайд 10Ионная кристаллическая решётка
Структурные частицы — ионы
Физические свойства:
высокая твёрдость
прочность
тугоплавкость
нелетучесть
растворы и
Поваренная соль NaCl
Негашёная известь СаО

Слайд 11Атомная кристаллическая решётка
Структурные частицы — атомы
Физические свойства:
высокая твёрдость
тугоплавкость
прочность
нерастворимость в воде
диэлектрики (исключение графит, кремний)
Кварц, кварцевый песок SiO2

Слайд 12Кристаллическая решетка алмаза

Слайд 13Кристаллическая решетка графита

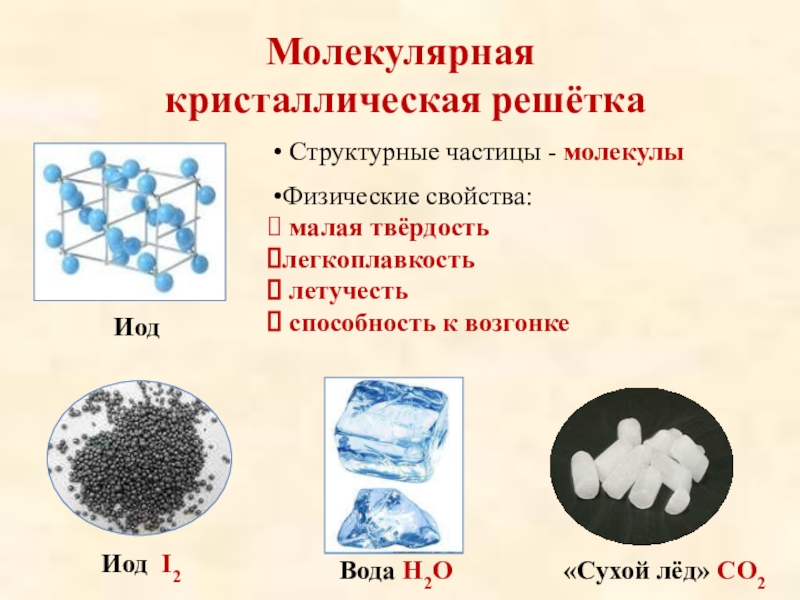
Слайд 14Молекулярная кристаллическая решётка
Иод
Структурные частицы — молекулы
Физические свойства:
малая твёрдость
легкоплавкость
летучесть
способность к возгонке
Слайд 15Металлическая кристаллическая решётка
Медь Cu
Структурные частицы – атомы и катионы
Физические свойства:
твёрдость, кроме ртути Hg
ковкость, пластичность, тягучесть
электропроводность
теплопроводность
металлический блеск

Слайд 16Определите кристаллические и аморфные вещества
1) Пищевая сода NaHCO3
2) Полиэтилен (-СН2-СН2-)n
3) Древесная
5) «Сухой лёд» СО2

Слайд 17Определите тип кристаллической решётки у веществ
Пищевая сода NaHCO3
Кремний Si
Медный купорос СuSO4•5H2O
Источник: shareslide.ru