Нормальность раствора нитрата серебра определяют следующим образом. Добавляют 3 мл нитробензола, колбу закрывают и энергично встряхивают 10 сек, вводят 3 мл раствора железо-аммонийных квасцов и избыток AgNO3 титруют раствором роданида калия ( /) до появления красновато-коричневой окраски. [1]
Установка нормальности раствора нитрата серебра может быть произведена весовым игаи объемным путем. [2]
Весовым путем нормальность раствора нитрата серебра устанавливают так. К точно отмеренному пипеткой объему раствора AgNOa приливают при нагревании 1 мл разбавленной азотной кислоты ( 1: 1) и соляной кислоты до полноты осаждения. Стакан со смесью обертывают черной бумагой и оставляют в темном месте на несколько часов для отстаивания и лучшего формирования осадка. Затем полученный осадок AgCl отфильтровывают, хорошо промывают сначала разбавленным раствором азотной кислоты, а под конец — дестиллированной водой, высушивают в сушильном шкафу при 100 — 110 и взвешивают. Определение нужно повторить еще раз и для расчета взять средний вес осадка. [3]
4.Молярность и нормальность растворов. Подготовка к олипиадам по химии 8-9 класс.
Техника определения аналогична установлению нормальности раствора нитрата серебра . Содержание ионов С1 — нередко определяют в удобрениях и других сельскохозяйственных химикалиях. [4]
Исходными веществами для установки нормальности раствора нитрата серебра служат хлорид натрия или хлорид калия. [5]
Стандартными веществами для установки нормальности раствора нитрата серебра служат хлорид натрия или хлорид калия. [6]
К — поправочный коэффи — — циент для проведения к точной нормальности раствора нитрата серебра; N — нормальность раствора нитрата серебра ; V — объем порции отгона, взятой на титрование, мл; V — общий объем отгона, мл; К2 — объем пробы, взятой на определение, мл; 52 04 — — эквивалент цианид-ионов. [7]
На чем основана аргентометрия. Как готовят н устанавливают нормальность раствора нитрата серебра . На чем основано действие индикатора хромата калия. Как определяют серебро по методу Мора. [8]
Объемным путем нормальность раствора AgNO3 может бысть установлена по чистовому раствору хлорида натрия или хлорида алия. Выделившиеся кристаллы NaCl отфильтровывают, промывают небольшим количеством дестиллированной воды и высушивают сначала на воздухе, а затем прокаливают в платиновом тигле при 500 — 600 до постоянного веса. Имея химически чистый хлорид натрия, легко установить нормальность раствора AgNOs. Для установки нормальности раствора нитрата серебра достаточно будет 250 мл раствора этой соли. [9]
Нормальность раствора AgNO3 можно установить по раствору хлорида натрия или хлорида калия, которые сравнительно легко получить химически чистыми. Готовят, нагревая, насыщенный раствор NaCl или КС1 и очень медленно пропускают через него газообразный хлористый водород. Выделившиеся кристаллы NaCl или КС1 отфильтровывают, промывают небольшим количеством дистиллированной воды и высушивают сначала на воздухе, а затем прокаливают в платиновом тигле при 500 — 600 С до постоянного веса. Эти растворы и служат для установки нормальности раствора нитрата серебра . [10]
Кузьмич Е.С. Приготовление раствора кислоты и установка точной концентрации.
Источник: www.ngpedia.ru
5.5. Определение содержания хлора в образце по Мору
Техника определения аналогична установлению нормальности раствора нитрата серебра. Содержание ионов Cl — нередко определяют в удобрениях и других сельскохозяйственных химикалиях.
Ход определения. Возьмите пробирку с образцом анализируемого вещества, содержащим то или иное количество хлорида. Взвесьте ее, перенесите содержимое пробирки в мерную колбу вместимостью 10 мл. Снова взвесьте пробирку и по разности найдите величину навески.
Положим, навеска вещества составляла 0,1302 г, а на титрование 10,00 мл полученного раствора пошло в среднем 4,74 мл раствора нитрата серебра. Достаточно умножить эту величину на титр раствора нитрата серебра по хлору, чтобы найти массу Cl — в 10,00 мл анализируемой жидкости: 4,74∙0,0007244 = 0,003434 г. Но весь раствор содержит хлора в десять раз больше: 0,003434∙10 = 0,03434 г. Далее вычисляют массовую долю (%) хлора в образце
Использование титра раствора нитрата серебра по хлору особенно удобно при серийных определениях иона Cl — в образцах.
5.6. Приготовление стандартизированного раствора тиоцианата аммония
Раствор NH4SCN или KSCN с точно известным титром нельзя приготовить растворением навески, так как эти соли очень гигроскопичны. Поэтому готовят раствор с приблизительной нормальной концентрацией и устанавливают ее по стандартизированному раствору нитрата серебра. Индикатором служит насыщенный раствор NH4Fe(SO4)2∙12H2O. Чтобы предупредить гидролиз соли Fe, к самому индикатору и к анализируемому раствору прибавляют перед титрованием 6 н. азотную кислоту.
Приготовление 100 мл приблизительно 0,05 н. раствора тиоцианата аммония. Молярная масса эквивалента NH4SCN равна его молярной массе, т.е. 76,12 г/моль. Поэтому 0,1л 0,05н. раствора должны содержать 76,12∙0,05∙0,1 = 03806 г NH4SCN.
Возьмите на аналитических весах навеску около 0,3-0,4 г, перенесите в колбу вместимостью 100 мл, растворите, доведите объем раствора водой до метки и перемешайте.
Стандартизация раствора тиоцианата аммония по нитрату серебра. Подготовьте бюретку для титрования раствором NH4SCN. Ополосните пипетку раствором нитрата серебра и отмерьте 10,00 мл его в коническую колбу. Добавьте 1 мл раствора NH4Fe(SO4)2 (индикатор) и 3 мл 6 н. азотной кислоты.
Медленно, при непрерывном взбалтывании, приливайте из бюретки раствор NH4SCN. Титрование прекратите после появления коричнево-розовой окраски [Fe(SCN)] 2+ , не исчезающей при энергичном встряхивании.
Повторите титрование 2-3 раза, из сходящихся отсчетов возьмите среднее и вычислите нормальную концентрацию NH4SCN.
Допустим, что на титрование 10,00 мл 0,02043 н. раствора нитрата серебра пошло в среднем 4,10 мл раствора NH4SCN. Тогда
с (NH4SCN) ∙ 4,10 = 0,02043∙10,00; с (NH4SCN) = 0,02043∙10,00/4,10 = 0,04982.
Источник: studfile.net
Контроль знаний и применение знаний на практике.
Техника титрования. Определение коэффициента поправки для децинормальных растворов. Установка титра рабочего раствора по исходному веществу. Определение количества вещества в контрольном растворе.
Практическая работа № 9. Техника определения коэффициента поправки для децинормальных растворов. Установка титра рабочего раствора по исходному веществу. Определение количества вещества в контрольном растворе.

1.1. Вычисление поправочного коэффициента. При выражении точной нормальной концентрации рабочего раствора часто применяют так называемый поправочный коэффициент К. Это величина, на которую нужно умножить величину предлагаемой нормальности раствора, чтобы получить точную концентрацию раствора. Например, имеется приблизительно 0,1 н. раствор, для которого К = 0,945.
Следовательно, точная нормальная концентрация раствора равна 0,1 0,945. Величину К находят, разделив определённую титриметрически нормальность раствора на величину предполагаемой нормальности раствора:

Где N — определённая нормальность раствора; N0 — предполагаемая нормальность раствора.
Если рабочий раствор приготовлен из фиксанала, то К = 1.
Пример. Чему равно К примерно 0,1 н. раствора NaOH, если его определённая титриметрически нормальная концентрация равна 0,0885.

1.2. Вычисление титра. Чаще в аналитических лабораториях концентрацию рабочего раствора выражают в виде титра по определяемому веществу. Это количество граммов (реже миллиграммов) определяемого вещества, которому соответствует 1 мл рабочего раствора. Для расчётов пользуются формулой:

Где х — рабочий раствор; у — определяемые вещества; Nх — нормальность рабочего раствора; Эу — эквивалентная масса определяемого вещества.
Пример. Нормальность рабочего раствора нитрата серебра AgNO3 равна 0,1020, его титр по хлору равен:
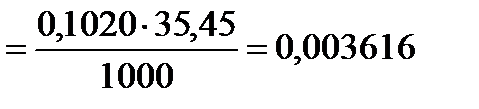
ТAgNO3 · Cl г/мл
Титр обычно рассчитывают до четвёртой значащей цифры.
1.3. Вычисление массы определяемого вещества. Как было сказано выше, приготовив рабочий раствор и определив его точную концентрацию, используют этот раствор для титриметрического определения количества различных веществ, которое можно титровать данным рабочим раствором.
Для этого определённое количество испытуемого раствора титруют данным рабочим раствором, определяют его объём, пошедший на титрование и рассчитывают количество вещества по формуле:
Где Ру — масса определяемого вещества, г; Vх — объём рабочего раствора, пошедшего на титрование, мл; Тху — титр рабочего раствора по определяемому веществу.
Пример. Какое количество хлора содержалось в титруемом хлориде, если на титрование затрачено 8,20 мл нитрата серебра?
Т AgNO3 · Cl = 0,003616
РClˉ = ТAgNO3 · Cl · V AgNO3 = 0,003616 · 8,20 = 0,02965 г.
Решение задач.
Задача 1.
Сколько граммов КОН надо взять для приготовления 500 мл 0,05 М раствора щелочи?
Задача 2.
Какой объем раствора НС1 с массовой долей НС1, равной 20% (ρ = 1,10 г/мл) надо взять для приготовления 500 мл 0,1 М раствора НС1?
Ответ: 8,3 мл.
Задача 3.
Определите молярную концентрацию раствора КОН, если на тирование 15,00 мл его израсходовано 18,70 мл раствора НС1 с титром, равным 0,002864 г/мл.
Ответ: 0,09782 моль/л.
Задача 4.
В 1 кг воды растворили 250 гNаОН. Плотность полученного раствора равна 1,219 г/мл. Вычислите: а) массовую долю NаОН; б) молярную концентрацию; в) нормальность; г) титр раствора щелочи.
Ответ: а) 20%; б) и в) 6,10 моль/л; г) 0,2439 г/мл.
Контроль знаний и применение знаний на практике.
а) Самостоятельная работа – «Определение титра р-ра КМnО4».
Реактивы: 0,1н р-р щавелевой кислоты, дистиллированная вода, серная кислота (1:8), р-р КМnО4, водяная баня.
Ход работы.
1. В коническую колбу поместить: 10 мл р-ра 0,1н Н2С2О4
50 мл Н2О (дистиллированной)
Полученный раствор нагреть до 80 0 С (кипятить нельзя, т.к. щавелевая кислота разлагается).
2. В бюретку налить 25 мл раствора КМnО4 (0,1н).
3. Титровать до появления первого неисчезающего бледно – розового окрашивания.
4. Записать объём КМnО4 ушедший на титрование.
5. Промыть бюретку раствором щавелевой кислоты, 3-4 раза водопроводной водой и 1-2 раза дистиллированной водой.
6. Произвести расчёт результатов анализа.
б) расчёт результатов анализа – «Расчёт тира КМnО4».
Объёмы растворов, количественно реагирующих между собой, обратно пропорциональны нормальным концентрациям этих растворов:
V 1 N 2 V1 – объём рабочего раствора пошедшего на титрование
V2 = N1 V2 – объём исследуемого раствора
N1 – концентрация рабочего раствора
N2 – концентрация исследуемого раствора
Нормальную концентрацию рассчитывают с точностью до четвёртого десятичного знака. Концентрация раствора может быть выражена титром, т.е. в граммах вещества на 1мл раствора.
Э КМnО4 = 31,61 г/моль
Пример расчёта:
| V1 (КМnО4) = 14,5 мл V2 (Н2С2О4) = 10 мл N2 (Н2С2О4) = 0,1н. Э (КМnО4) = 31,61 г/моль | V 1 N 2 V2 = N1 =>N1= V 2 х N 2 V1 N1 = 10 х 0,1 = 0,0689н 14,5 Т = N х Э |
Т КМnО4 =? Т= 0,0689 х 31,61 = 0,002177 г/мл
Домашнее задание:
Источник: poisk-ru.ru