Найди верный ответ на вопрос ✅ «Вычислите растворимость йодида серебра при 25 градусов С (в г/л) . » по предмету Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Новые вопросы по химии
Что произойдёт с железом при взаимодействии с водой? 3 класс.
C8h18 формула глюкозы
1. Цинк растворили в концентрированной азотной кислоте. Полученный газ растворили в горячей воде. В ходе этого взаимодействия образовался бесцветный газ. Он легко окисляется кислородом воздуха до образования бурого газа.
Закончите формулы. H2+CuO= Na+HCl =
Что такое макроэлементы и ультромикроэлементы?
Источник: urokam.net
Расчет растворимости
Растворимость s малорастворимого электролита, выраженная в молях вещества в 1 л раствора, связана с произведением растворимости:
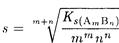
Качественные реакции на ион серебра Ag+
(4-1)
Следует помнить, что если:
1) ионную силу можно принять равной нулю и протеканием конкурирующих реакций пренебречь, то растворимость осадка вычисляют по величине Кs°;
2) влиянием ионной силы пренебречь нельзя (имеем дело с заметно растворимым соединением в присутствии посторонних электролитов), но конкурирующие реакции отсутствуют, растворимость вычисляют по величине Ks;
3) конкурирующими реакциями пренебречь нельзя, растворимость вычисляют по величине Ks`.
Обычно изменение растворимости осадка из-за конкурирующих реакций значительно больше, чем из-за электростатических взаимодействий ионов, поэтому при расчете растворимости осадка в условиях протекания конкурирующих реакций без особых погрешностей коэффициенты активности часто можно принять равными единице
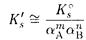
Формула (4-1) пригодна лишь в том случае, когда расход реагента, вступающего в конкурирующую реакцию, невелик. Это условие выполняется при расчете растворимости в забуференных растворах или в присутствии большого избытка этого реагента.
ПРИМЕР 1. Какова растворимость оксалата кальция, если Ks°(CaC2O4) = 2.29·10 -9
Решение. Ks°(CaC2O4) — малая величина, поэтому можно принять ионную силу, создаваемую собственными ионами осадка, равной нулю. Конкурирующими реакциями
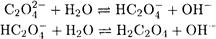
также можно пренебречь, поскольку С2О4 2- и НС2О4 — являются весьма слабыми основаниями. Итак, γ(C2O4 2- ) = γ(Ca 2+ ) = 1, a (C2O4 2- ) = 1. Поэтому
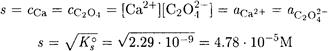
ПРИМЕР 2. Рассчитайте растворимость оксалата кальция в 0.01 М растворе нитрата калия.
Решение. Ионную силу нельзя принять равной нулю, так как концентрация ионов постороннего электролита достаточно высока. Как и в предыдущем примере, конкурирующими реакциями можно пренебречь. Итак, γ ≠ 1, a (C2O4 2- ) = 1. Ионная сила, создаваемая ионами калия и нитрата, составляет
Качественные реакции на хлорид-, бромид- и йодид-ионы
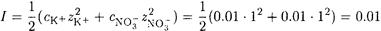
По таблицам находим при I = 0.01 γ(Ca 2+ ) = γ(C2O4 2- ) = 0.63. Вычисляем Ks при I = 0.01:
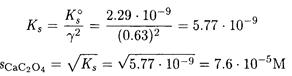
Увеличение растворимости оксалата кальция по сравнению с предыдущем примером обусловлено электростатическими взаимодействиями ионов кальция и оксалата с ионами нитрата и калия.
ПРИМЕР 3. Рассчитайте растворимость оксалата кальция при рН 3.00.
Решение. Поскольку среда кислая, необходимо учесть кислотно-основные реакции с участием оксалат-иона
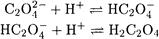
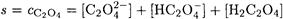
Находим а -коэффициент для оксалат-иона при рН 3.00:
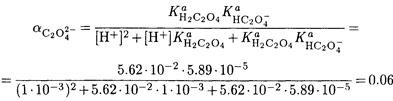
Принимая коэффициенты активности ионов кальция и оксалата равными единице, находим:
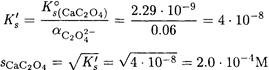
Сравним результат с полученным в примерах 1 и 2. Видно, что вклад конкурирующей химической (кислотно-основной) реакции (пример 3) оказал более существенное влияние, чем вклад ионной силы (электростатических взаимодействий, пример 2). Таким образом, допущение, что коэффициенты активности можно принять равными единице в данном примере вполне правомочно.
ПРИМЕР 4. Рассчитайте растворимость оксалата кальция в 1·10 -3 М соляной кислоте.
Решение. Пренебрегая образованием Н2С2О4 ввиду большого различия констант кислотности Н2С2О4, реакцию, протекающую при растворении осадка, можно представить в виде:
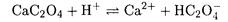
Находим константу равновесия этой реакции
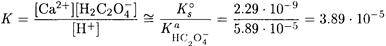
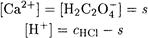
Подставляя найденные соотношения в выражение для константы равновесия, получаем
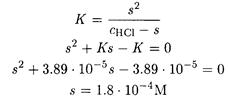
ПРИМЕР 5. Рассчитайте растворимость сульфата бария в 0.10 М растворе сульфата натрия.
Решение. Необходимо учесть, что растворимость сульфата бария уменьшается из-за присутствия одноименного иона и в то же время повышается из-за увеличения ионной силы.
Находим ионную силу, создаваемую ионами натрия и сульфата:
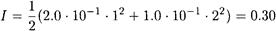
По таблицам γ(Ba 2+ ) = γ(SO4 2- ) = 0.42. Ks(BaSO4) при ионной силе 0.30 составляет

поэтому растворимость сульфата бария в 0.10 М растворе сульфата натрия равна
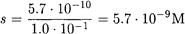
ПРИМЕР 6. Рассчитайте растворимость иодида серебра в растворе с концентрацией аммиака 1 М.
Решение. При расчете растворимости необходимо использовать Ks`, так как протекают конкурирующие реакции комплексообразования
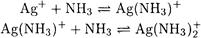
Находим a (Ag + ):
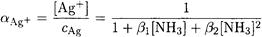
Поскольку C(NH3) >> С(Ag + ). принимаем [NH3] = C(NH3) = 1 M и
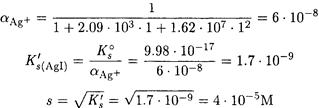
ПРИМЕР 7. Рассчитайте растворимость иодида серебра в 0.01 М растворе цианида калия.
Решение. Нельзя считать, что равновесная концентрация цианид-иона равна исходной. Судя по константам устойчивости в растворе доминирует комплекс Ag(CN)2 — . Пренебрегая присутствием других комплексных форм, запишем реакцию растворения
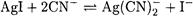
и выражение для константы равновесия
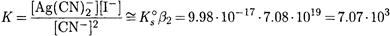
Подставляя в выражение для константы равновесия соотношения
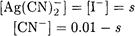
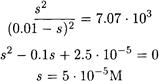
Расчет растворимости по формуле (4-1) правомерен лишь для соединений с ионной кристаллической решеткой т. е для сильных электролитов (BaSО4, MgNН4PO4, Ва(IO3)2 и др.).
В насыщенных растворах малорастворимых слабых электролитов (органические кислоты, комплексы, ионные ассоциаты) устанавливаются равновесия:
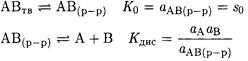
и растворимость определяется суммой молекулярной и ионной составляющих:
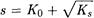
(4-2)
Значение K0 можно вычислить по формулам формулам:
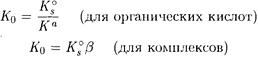
(4-3)
Если К0 < 20 Кs °, вкладом s0 можно пренебречь. Полезно помнить, что s0 не зависит от присутствия одноименного иона.
ПРИМЕР 8. Рассчитайте растворимость бензойной кислоты: а) в воде, б) в 0.1 М соляной кислоте.
Решение. В насыщенном водном растворе С6H5СООН (обозначим НА) устанавливаются равновесия
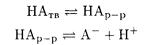
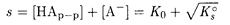
Принимая коэффициенты активности равными единице, находим
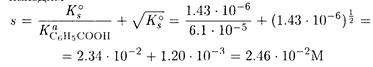
Как видно, основной вклад вносит молекулярная растворимость.
В присутствии одноименного иона (Н + )
Источник: studopedia.su
Вычислить произведение растворимости иодида серебра AgI, если растворимость этой соли при температуре 25°С
Вычислить произведение растворимости иодида серебра AgI, если растворимость этой соли при температуре 25°С равна 2,865 ∙ 10–6 г/л.
Ответ
Решение
Потяни, чтобы посмотреть
Произведение растворимости малорастворимого йодида серебра AgI – это произведе-ние концентраций ионов соли в насыщенном растворе:
ПР(Ag I) = [Ag+] ∙ [I–]
Растворившаяся часть AgI полностью диссоциирована на ионы:
Ag I Ag+ + I–
Пересчитаем массовую концентрацию соли в насыщенном растворе на молярную, учи-тывая М(AgI) = 234,77 г/моль:
М
Следовательно, концентрации ионов Ag+ и I– в насыщенном растворе:
[Ag+] = [I–] = 1,22 ∙10–8 моль/л
Произведение растворимости AgI:
ПР(AgI) = 1,22 ∙10–8 ∙1,22 ∙10–8 = 1,49 ∙10–16
Ответ: 1,49∙10–16
50% контрольной работы недоступно для прочтения
Закажи персональную контрольную работу. Эксперты напишут качественную работу за 30 минут! ⏱️
Источник: author24referat.ru

