Агрега́тное состоя́ние — термодинамическое состояние вещества, сильно отличающееся по своим физическим свойствам от других агрегатных состояний этого же вещества.
Агрегатное состояние определяется физическими условиями, в которых находится вещество, главным образом температурой и давлением.
Термин «агрегатное состояние» довольно размытый и часто слишком огрубляет свойства вещества. Так, почти все вещества в твёрдом агрегатном состоянии могут обладать, в зависимости от давления и температуры, несколькими различными
- 1 Агрегатные состояния, наблюдающихся практически у всех веществ
- 2 Вырожденная материя
- 3 Другие состояния
- 4 Комментарии читателей:
Агрегатные состояния, наблюдающихся практически у всех веществ [ ]
- аморфное либо жидкость, характеризуется более низкой плотностью и промежуточными температурами. Жидкость держит объём, но не держит форму.
- газообразное состояние, характеризуется низкой плотностью и достаточно высокой температурой. Газ не держит ни форму, ни объём.
- плазма (часто называемое четвёртое состояние вещества), представляет собой частично или полностью ионизованный газ и возникает при высокой температуре, от нескольких тысяч кельвинов и выше. В целом её свойства напоминают свойства газообразного состояния вещества, за исключением того факта, что для плазмы принципиальную роль играет электродинамика.
Вырожденная материя [ ]
- Ферми-газ 1-я стадия Электронно-вырожденный газ, наблюдается в белых карликах, играет важныю роль в эволюции звезд
- 2-я стадия нейтронное состояние в него вещество переходит при сверхвысоком давлении, недостижимом пока в лаборатории, но существующем внутри нейтронных звёзд. При переходе в нейтронное состояние электроны вещества взаимодействуют с протонами и превращаются в нейтроны. В результате вещество в нейтронном состоянии полностью состоит из нейтронов и обладает плотностью порядка ядерной. Температура вещества при этом не должна быть слишком высока (в энергетическом эквиваленте не более сотни МэВ).
- при сильном повышении температуры (сотни МэВ и выше) в нейтронном состоянии начинают рождаться и аннигилировать разнообразные мезоны. При дальнейшем повышении температуры происходит деконфайнмент, и вещество переходит в состояние кварк-глюонной плазмы . Оно состоит уже не из адронов, а из постоянно рождающихся и исчезающих кварков и глюонов. Возможно (1), деконфайнмент происходит в два этапа.
- При дальнейшем неограниченном повышении давления без повышения температуры вещество коллапсирует в чёрную дыру.
- При одновременном повышении и давления, и температуры к кваркам и глюонам добавляются иные частицы. Что происходит с веществом (а точнее, с веществом + пространством-временем) при температурах, близких к планковской температуре, пока неизвестно.
Другие состояния [ ]
Состояния материи
3. Агрегатные состояния вещества
Выделить Агрегатное состояние и найти в:
Полезные и лечебные свойства серебра. Это поразительно…
- Вокруг светасостояние адрес
- Академиксостояние/ru/ru/ адрес
- Астронетадрес
- Элементысостояние+mode=2results_per_page=10 адрес
- Научная Сеть
- Традиция — адрес
- Циклопедия — адрес
- Викизнание — состояние адрес
- Bing
- Yahoo
- Яндекс
- Mail.ru
- Рамблер
- Нигма.РФ
- Спутник
- Google Scholar
- Апорт
- Онлайн-переводчик
- Архив Интернета
- Научно-популярные фильмы на Яндексе
- Документальные фильмы
- Список ru-вики
- Вики-сайты на русском языке
- Список крупных русскоязычных википроектов
- Каталог wiki-сайтов
- Русскоязычные wiki-проекты
- Викизнание:Каталог wiki-сайтов
- Научно-популярные сайты в Интернете
- Лучшие научные сайты на нашем портале
- Лучшие научно-популярные сайты
- Каталог научно-познавательных сайтов
- НАУКА В РУНЕТЕ: каталог научных и научно-популярных сайтов
Источник: science.fandom.com
Ответы и решения – страница 30 рабочая тетрадь по химии О. С. Габриелян (2009-2017)

а) Железо может быть жидким ;
б) Кислород может быть твердым ;
в) Уксусная кислота может быть газообразной .
Комментарий: температура плавления железа 1539 °C, температура плавления кислорода −218,35 °C, температура кипения уксусной кислоты 118,1 °C.
2. Дополните предложения.
В каком агрегатном состоянии находится вещество, если:
а) оно не сохраняет форму, но сохраняет объем – жидкое ;
б) тело из него сохраняет свою форму и объем – твердое ;
в) оно принимает форум того сосуда, в котором находится – жидкое .
Комментарий: газ НЕ сохраняет объем и форму, жидкость сохраняет объем (но не форму), твёрдое тело сохраняет форму и объем.
3. Подчеркните «лишнее» слово в каждой группе.
а) кислород, углекислый газ, серебро ;
б) уксусная кислота, лимонная кислота, спирт ;
в) вода , мел, графит;
г) ртуть, вода, кислород ;
д) неон , железо, сахар;
е) мел , угарный газ, сероводород.
Комментарий:
а) кислород и углекислый газ – газы, серебро – твёрдое вещество;
б) уксус и “лимонка” – кислоты, спирт относится к классу спиртов;
в) мел и графит – твёрдые вещества, вода – жидкость;
г) ртуть и вода – жидкие вещества, кислород – газ;
д) неон – газ, железо и сахар – твёрдые вещества;
е) мел – твёрдое вещество, угарный газ и сероводород – газы.
4. Ответьте на вопрос.
Чем отличаются твёрдые кристаллические вещества от твёрдых аморфных?
В кристаллических веществах атомы расположены в узлах кристаллической решетки. Такие вещества имеют определенную температуру плавления. В аморфных веществах атомы расположены хаотично. Они не имеют точной температуры плавления.
Источник: himgdz.ru
1.2. Различные агрегатные состояния и кристаллическое строение металлов
Все вещества в зависимости от температуры и давления могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
В чистых металлах при повышении температуры происходит изменение агрегатного состояния: при превышении температуры плавления твердое состояние сменяется жидким, при превышении температуры кипения жидкое состояние переходит в газообразное. Эти температуры перехода зависят от давления.
Температура плавления – особенно важная константа свойств металла – колеблется для различных металлов в весьма широких пределах: от минус 38,9 для ртути, самого легкоплавкого металла, находящегося при комнатной температуре в жидком состоянии, до 3390 — для самого тугоплавкого металла – вольфрама.
При постоянном давлении температуры плавления, плотность и некоторые теплофизические характеристики вполне определенны и для наиболее распространенных в технике металлов приведены в табл.1.
В газообразном состоянии частицы вещества не связаны между собой молекулярными силами притяжения и хаотически движутся, заполняя весь возможный объем. При обычных давлениях и температурах среднее расстояние между молекулами в газах примерно в 10 раз больше, чем в твердых телах и жидкостях. Поэтому газы имеют значительно меньшие плотности, чем твердые тела и жидкости. При обычных температурах газы – хорошие диэлектрики, так как их атомы и молекулы электрически нейтральны.
При нагреве газа до высоких температур происходит его ионизация: концентрация заряженных частиц увеличивается, причем объемные плотности положительных и отрицательных электрических зарядов заряженных частиц становятся практически одинаковыми. Термически ионизированный газ отличается от обычного газа рядом особенностей, позволяющих считать его четвертым (после твердого, жидкого и газообразного) состоянием вещества – плазмой. В технике широкое применение получила «холодная» или низкотемпературная плазма (10 3 -10 4 К).
Плотность, теплоемкость, температура плавления и теплота плавления некоторых металлов
Жидкости представляют собой вещества в конденсированном агрегатном состоянии, промежуточном между твердым и газообразном. Жидкости подобно твердым телам обладают малой сжимаемостью и большой плотностью, но в то же время подобно газам не обладают упругостью формы и легко текут.
В жидкостях среднее расстояние между молекулами сравнимо с размерами самих молекул (10 Нм = 10 -10 м) и силы межмолекулярного взаимодействия весьма значительны. Подобно частицам твердого тела молекулы жидкости совершают тепловые колебания около некоторых положений равновесия. Однако, если в твердых телах эти положения равновесия неизменны (т.е. имеет место дальний порядок), то в жидкостях они время от времени изменяются: по истечении некоторого времени молекула жидкости перескакивает в новое положение равновесия, перемещаясь на расстояние, сравнимое с расстоянием между молекулами. Эти перемещения молекул жидкости обусловливают ее текучесть. Таким образом, несмотря на то, что в жидкостях не соблюдается дальний порядок, как у твердых тел, для них имеет место «ближний порядок»: в среднем для каждой молекулы жидкости число ближайших соседей и их взаимное расположение одинаковы.
В твердом состоянии физические тела характеризуются стабильностью формы. При изменении формы в твердых телах возникают упругие силы, препятствующие этому изменению. В твердых телах элементарные частицы (атомы, молекулы или ионы) совершают малые тепловые колебания около некоторых фиксированных положений равновесия, т.е. имеет место «дальний порядок», вследствие которого элементарные частицы твердого тела могут располагаться по узлам кристаллических решеток.
Правильное регулярное расположение атомов в твердом теле, характеризующееся периодической повторяемостью в трех измерениях, образует кристаллическую решетку, а тела, имеющие кристаллическую решетку, называют твердыми телами. Металлы являются телами кристаллическими.
Наиболее простой кристаллической решеткой у металлов является кубическая, имеющая две разновидности: кубическую объемно-центрированную (ОЦК) и кубическую гранецентрированную (ГЦК). У обоих типов этих решеток основу ячеек составляют восемь атомов, образующих куб и находящихся в его вершинах.
Остальные атомы находятся или в центре объема куба (1 атом на пересечении диагоналей в решетке ОЦК), или в центре каждой из его граней (6 атомов в решетке ГЦК). Кристаллические решетки ОЦК имеют альфа-железо, хром, ванадий, вольфрам и другие металлы. Решетку ГЦК имеют гамма-железо, алюминий, медь, никель и др. металлы.
Другой разновидностью кристаллических решеток у металлов является гексагональная плотноупакованная решетка (ГПУ). Ячейка этой решетки представляет собой шестигранную призму с центрированными основаниями, между которыми на некотором расстоянии от центров трех граней расположены еще три атома. ГПУ решетку имеют магний, цинк, бериллий и другие металлы (рис. 1.4).
Плоскости, параллельные координатным плоскостям, находящиеся на расстоянии а, в, с, разбивают кристалл на множество параллелепипедов, равных и параллельно ориентированных. Наименьший параллелепипед называют элементарной ячейкой. Вершины параллелепипеда называют узлами пространственной решетки. Размер элементарной ячейки оценивают отрезками а, в, с.
Их называют периодами решетки. Дополнительными характеристиками кристаллической решетки являются координационное число и коэффициент компактности.
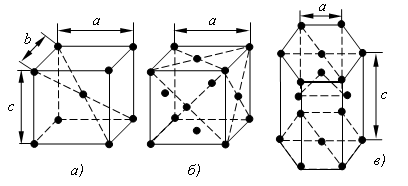
Рис. 1.4. Кристаллические решетки: а) кубическая объемно-центрированная (ОЦК), б) кубическая гранецентрированная (ГЦК), в) гексагональная плотноупакованная (ГПУ)
Координационное число К – число ближайших равноудаленных частиц (атомов) от любого атома в кристаллической решетке (для ОЦК – К8, для ГЦК – К12). Коэффициент компактности – отношение объема всех частиц, приходящихся на одну элементарную ячейку, ко всему объему элементарной ячейки (для ОЦК – 0,68, для ГЦК – 0,74).
Упорядоченность расположения атомов в кристаллической решетке позволяет четко выделить кристаллографические направления и плоскости (рис. 1.5). Кристаллографические направления – лучи, выходящие из какой-нибудь точки отсчета, вдоль которых на определенном расстоянии друг от друга располагаются атомы.
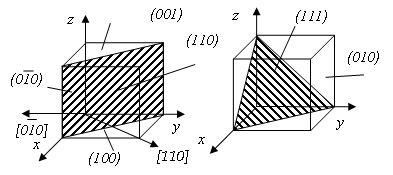
Рис. 1.5.Основные кристаллографические направления и плоскости
Точками отсчета могут служить вершины куба, при этом кристаллографическими направлениями являются его ребра и диагонали грани.
Кристаллографические плоскости – плоскости, на которых лежат атомы, например, грани куба или его диагональной плоскости. Кристаллографические направления и плоскости принято обозначать индексами Миллера. Для определения индекса какого-либо направления следует найти координаты ближайшего к точке отсчета атома, лежащего на этом направлении, выраженные через параметр решетки.
Пример. Координаты ближайшего атома вдоль оси ох выразятся через 100. Этими цифрами принято обозначать индекс направления вдоль оси ох и параллельных ему направлениях [100]. Индексы направлений вдоль оси оу и оz и параллельных им направлений выразятся соответственно через [010] и [001], а направления вдоль диагонали грани хоz, хоу, уоz и диагонали куба получат индексы соответственно [101], [110], [011], [111].
Для определения индекса кристаллографической плоскости следует вначале найти координаты ближайших точек ее пересечения с осями координат, проведенными из точки отсчета 0. Затем обратные величины найденных координат следует записать в обычной последовательности в круглых скобках. Использование понятий о кристаллографических направлениях и плоскостях и их индексах позволяет описывать различные явления, происходящие в кристаллических телах, а также особенности свойства кристаллических тел вдоль различных направлений и плоскостей.
Физические и прочностные свойства металлов вдоль различных кристаллографических направлений зависят от числа атомов, расположенных на этих направлениях. В действительности в кристаллической решетке на различных направлениях находится разное число атомов. Например, в кубических решетках (рис. 1.5) вдоль диагонали куба ОЦК решетки [111] или диагонали грани решетки ГЦК [110], [101], [011] размещается больше атомов, чем по направлениям вдоль ребер кубов [100], [010], [001].
Из этого следует, что в кристаллических веществах должна наблюдаться анизотропия, т.е. неодинаковость свойств вдоль различных кристаллографических направлениях.
Анизотропия – это зависимость свойств кристалла от направления, возникающая в результате упорядоченного расположения атомов в пространстве. Анизотропия механических и других свойств наблюдается при испытании образцов, вырезанных вдоль различных кристаллографических направлений. Не всем свойствам кристаллических тел присуще явление анизотропии, такое свойство, как теплоемкость, от направления не зависит. Анизотропия проявляется только в пределах одного кристаллического зерна. Реальные металлы являются телами поликристаллическими, состоящими из огромного числа зерен, произвольно ориентированных друг к другу своими кристаллографическими направлениями и плоскостями.
В связи с этим, недостаток какого-либо свойства по одному из направлений приложения силы в одних зернах компенсируется избытком этого свойства по этому же направлению в других зернах. Поэтому реальные металлы являются изотропными телами, т.е. телами с примерно одинаковыми свойствами по всем направлениям.
Источник: studfile.net