Потенциал отдельного электрода экспериментально определить невозможно, поэтому для потенциометрических измерений используют два электрода. Один из электродов электрохимической ячейки должен обратимо реагировать на изменение состава анализируемого раствора, чтобы по наличию (или отсутствию) аналитического сигнала и его интенсивности можно было судить о том, есть ли интересующий нас компонент в растворе и сколько его. Этот электрод называют измерительным или индикаторным. Индикаторный электрод не должен реагировать с компонентами раствора, поэтому для его изготовления применяют химически инертные токопроводящие материалы: благородные металлы (золото, платина, ртуть), углеродные материалы (графит, сгеклоуглерод). В зависимости от природы измеряемого параметра индикаторные электроды различаются по материалу, из которого они изготовлены, размеру и форме.
Индикаторный электрод должен удовлетворять следующим требованиям. Его потенциал должен быть воспроизводим и устанавливаться достаточно быстро. При исследовании потенциала металлического электрода в растворе его соли и в некоторых других случаях индикаторный электрод должен быть обратим. Электрод должен обладать также определенной химической устойчивостью, чтобы не реагировать с другими компонентами анализируемого раствора. В потенциометрии в качестве индикаторных применяют мембранные и металлические электроды.
Потенциометрические определения.
Другой (сравнительный) элекгрод должен иметь постоянный потенциал. Универсальным электродом сравнения является стандартный водородный электрод, который используют для калибровки pH-метров и индикаторных электродов. Его потенциал принят равным нулю при всех температурах.
Конструктивно водородный электрод представляет собой платинированную платиновую пластинку, омываемую газообразным водородом при давлении 1,013-10 5 Па и погруженную в раствор кислоты с активностью ионов Н + , равной единице. Но для практической работы он неудобен из-за необходимости использования водорода, нетехнологичности, хрупкости и ряда других причин. Поэтому в качестве электродов сравнения используют специальные, более удобные в работе стабильные электроды сравнения, потенциал которых по отношению к стандартному водородному точно известен.
В потенциометрии применяют электроды первого и второго рода, окислительно-восстановительные и мембранные.
Электроды первого рода — обратимые по катиону, общему с материалом электрода. Они представляют собой металлическую пластинку или проволоку, погружённую в раствор хороню растворимой соли этого металла. Потенциал такого электрода является функцией активности собственных ионов в растворе. Электроды из серебра, ртути, кадмия и некоторых других металлов обратимы и дают хорошие результаты. Однако электроды из таких металлов, как хром, кобальт и некоторые другие в качестве индикаторных не используют, так как они не дают достаточно воспроизводимых результатов.
Различают три разновидности электродов первого рода.
1. Металл М, погружённый в раствор соли того же металла. На поверхности таких электродов протекает обратимая реакция
Революционные достижения в лечении сахарного диабета первого типа.

Реальный потенциал такого электрода зависит от активности катионов металла (уравнение 4.1).
2. Газовые электроды, например, водородный электрод, в том числе и стандартный водородный электрод. Потенциал обратимо работающего газового водородного электрода определяется активностью ионов водорода, т.е. величиной pH раствора при комнатной температуре

Поскольку для водородного электрода стандартный потенциал принимают равным нулю (Е0 = 0), а в соответствии с водородной реакцией

то число электронов, участвующих в этой реакции, равно единице, т.е. п = 1.
3. Амальгамные электроды, представляющие собой амальгаму металла, погружённую в раствор, содержащий катионы того же металла. Амальгама (позднелат. amalgama, букв. — сплав) — жидкий, полужидкий или твёрдый сплав ртути с другим металлом. Потенциал таких электродов зависит от активности
катионов металла в растворе а(М» ) и активности металла в амальгаме я(М)

Амальгамные элекгроды обладают большой обратимостью.
Электроды второго рода обратимы по аниону. Они состоят из металла, покрытого слоем малорастворимого соединения этого металла и погружённого в раствор хорошо растворимого соединения с тем же анионом. К ним относят хлорсеребряный, каломельный и некоторые другие. Потенциалы электродов второго рода при достаточно большой площади поверхности и постоянной концентрации аниона хорошо воспроизводятся, поэтому их основное назначение — служить электродами сравнения. Различают следующие виды электродов второго рода.
1. Металл, поверхность которого покрыта малорастворимой солью этого же металла, погружённый в раствор, содержащий анионы, входящие в состав этой малорастворимой соли. Примерами могут служить хлорсеребряный и каломельный электроды.
Хлорсеребряный электрод (рис. 4.2, а) состоит из серебряной проволоки, электролитически покрытой слоем хлорида серебра AgCl и погружённой в раствор хлорида калия KCI, насыщенный хлоридом серебра.
В соответствии с уравнением Нернста для этого электрода имеем

Как следует из уравнения (4.12), потенциал хлорссрсбряного электрода определяется активностью хлорид-ионов в растворе. Хотя известно несколько видов хлорсеребряных электродов, но чаще других применяют насыщенный хлорсеребряный электрод. При 25 °С его потенциал равен 0,222 ± 0,002 В.

Рис. 4.2. Электроды сравнения хлорсеребряный (а, в) и каломельный (б) с двойным солевым мостиком:
1 — асбестовое волокно, обеспечивающее контакт с анализируемым раствором; 2 — внешний раствор KCI (насыщенный); 3 — крошечное отверстие для контакта; 4 — внутренний раствор КС1 (насыщенный), AgCl (твёрдый); 5 — отверстие для ввода раствора КС1; б — паста из смеси Hg2Cl2, Hg и КС1 (насыщенный)
Каломельный электрод. Каломель (от греч. ка/,ост — красивый и . це^аст — чёрный), Hg2Cl2 — хлорид ртути. В основе работы каломельного электрода (рис. 4.2, 6) лежит полурсакция

поэтому потенциал этого электрода зависит от активности хлорид-ионов в растворе. Известны 0,1 М, 1 Ми насыщенный каломельный электроды в зависимости от концентрации раствора хлорида калия, контактирующего с пастой из металлической ртути и каломели. Серийно выпускают насыщенный каломельный электрод, имеющий при 25 °С потенциал 0,247 ± 0,001 В.
Электроды второго рода рассмотренного типа обладают высокой обратимостью и стабильны в работе, поэтому их нередко используют в качестве электродов сравнения, способных устойчиво поддерживать постоянное значение потенциала.
2. Газовые электроды второго рода, например, хлорный электрод, применяют редко.
Окислительно-восстановительные электроды состоят из инертного металла (платина, золото, вольфрам, титан, графит и др.), погружённого в раствор, содержащий окисленную и восстановленную формы данного вещества. Поскольку их потенциалы зависят от соотношения активностей окисленной и восстановленной форм полуреакции, то электроды используют для индикации конечной точки окислительно-восстановительного титрования.
Существуют две разновидности окислительно-восстановительных электродов:
- — электроды, потенциал которых не зависит от активности ионов водорода, например, Pt/FeCh, FeCl2, Pt/K3(Fe(CN)6), K4(Fe(CN)6) и т.д.;
- — электроды, потенциал которых зависит от активности ионов водорода, например, хингидронный электрод.
Мембранные электроды — обратимые по тем или иным ионам (катионам или анионам), сорбируемым твёрдой или жидкой мембраной. Потенциал таких электродов зависит от активности тех ионов в растворе, которые сорбируются мембраной.
В работе мембранных электродов используется не электрохимическая реакция с переносом электрона, а разность потенциалов, возникающая на границе раздела фаз, и равновесие иоиов между мембраной и раствором.
В обычных конструкциях мембранных электродов мембрана разделяет исследуемый и вспомогательный внутренний растворы. Наиболее широко применяемым электродом этого типа является стеклянный электрод. Известны также фторидный, сульфидный и многие другие мембранные электроды.
Для аналитического контроля широко используют ноиосе- лективные (от ион. и лат. selection — отбор) электроды, которые позволяют избирательно измерять концентрацию того или иного иона.
Важнейшей составной частью большинства этих электродов является полупроницаемая мембрана — тонкая плёнка, диск или таблетка, отделяющая внутреннюю часть электрода (внутренний раствор) от анализируемого и обладающая способностью пропускать ионы только одного вида (катионы или анионы). Способность мембраны пропускать ионы определённого знака заряда обусловлена наличием ионогенных групп.
Основными характеристиками ионоселективного электрода являются электродная функция, селективность и время отклика. Электрод имеет нернстовскую электродную функцию в интервале активности (концентрации), где зависимость потенциала от рА (-lga.i) линейна. Протяжённость этого интервала зависит от природы мембраны. При низких концентрациях (для хороших электродов порядка 10 6 М) электрод утрачивает электродную функцию, точка перегиба на графике характеризует практическую величину предела обнаружения.
Различают следующие ионоселективные электроды:
- — с кристаллическими мембранами;
- — с жёсткой матрицей (стеклянные);
- — с подвижными носителями — положительно заряженными, отрицательно заряженными, незаряженными (с «нейтральными переносчиками»);
- — сенсибилизированные (от лат. sensibilis — чувствительный), активированные электроды — газочувствительные, ферментные.
Источник: studme.org
Электроды в потенциометрии. Принцип действия
Электроды, которые используются в потенциометрии, различаются по назначению и по принципу действия.
В зависимости от назначения электроды бывают индикаторными или электродами сравнения.
Индикаторный электрод – это электрод, потенциал которого зависит от активности или концентрации определяемых ионов.
Требования к индикаторным электродам.
1. Электрод должен обратимо реагировать на изменение активности или концентрации определяемых ионов.
2. Потенциал его должен устанавливаться быстро. Это особенно важно при проведении потенциометрического титрования.
3. Электрод не должен влиять на состав раствора. Например, часто используемый платиновый электрод может катализировать протекание некоторых реакций.
4. Электрод должен быть химически устойчив по отношению к веществам, находящимся в растворе. Например, цинковый электрод в кислых растворах может растворяться.
5. Электрод должен быть неполяризуемым, т. е. его потенциал не должен меняться при протекании тока.
6. Электрод должен иметь простую конструкцию.
Электрод сравнения – это электрод, относительно которого измеряют потенциал индикаторного электрода (т. е. он нужен для измерения ЭДС гальванического элемента).
Требования к электродам сравнения.
1. Потенциал электрода должен оставаться постоянным и не зависеть от состава анализируемого раствора.
2. Электрод должен иметь низкое сопротивление.
Остальные требования к электроду сравнения – такие же, как в п. 3–6 требований к индикаторному электроду.
В зависимости от принципа действия различают электронообменные (металлические) и мембранные (ионоселективные) электроды.
Сравнительная характеристика электродов двух типов представлена в табл 1.
Металлические электроды, которые используются в потенциометрии, классифицируются следующим образом:
1. Активные электроды:
§ I рода (например, серебряный Ag/Ag + , медный Cu/Cu 2+ и др.). Потенциал таких электродов зависит от активности иона металла Ме n+ ;
§ II рода (например, хлоридсеребряный Ag, AgCl/KCl и др.). Потенциал таких электродов зависит от активности аниона An n – (например, Cl – для хлоридсеребряного электрода).
2. Инертные электроды (например, платиновый, золотой, палладиевый, водородный, хингидронный и др.). Такие электроды выполняют роль переносчиков электронов. Потенциал их зависит от отношения активностей окисленной и восстановленной форм сопряжённой окислительно-восстановительной пары.
Сравнительная характеристика электродов
| Электронообменные электроды (металлические) | Ионообменные электроды (мембранные) |
| На межфазной границе протекают реакции с участием электронов. | На межфазной границе протекают реакции ионного обмена. |
| Обладают электронной проводимостью. | Обладают ионной проводимостью. |
| Электронообменные электроды (металлические) | Ионообменные электроды (мембранные) |
Зависимость между равновесным потенциалом и активностью ионов выражается уравнением Нернста: 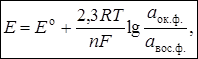 |
Зависимость между равновесным потенциалом и активностью ионов выражается уравнением Нернста: 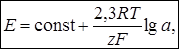 |
| где n – число электронов, участвующих в полуреакции; аок.ф. и авос.ф. – активности окисленной и восстановленной форм сопряжённой окислительно-восстановительной пары. | где z – заряд иона с учётом знака; а – активность иона в растворе |
Мембранные электроды классифицируются в зависимости от материала мембраны:
§ с твёрдой мембраной;
§ с жидкой мембраной;
§ ферментные и т. д. (см. следующий раздел).
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Большая Энциклопедия Нефти и Газа
Потенциометрическое титрование по методу осаждения особенно применимо для количественного определения анионов, которые с ионами серебра образуют нерастворимые соли ( галогениды, цианиды, фосфаты и др.) — Для этого удобно использовать серебряный индикаторный электрод , изготовленный из серебра или полученный осаждением серебра на платину. [31]
Далее учащиеся осваивают практические приемы потенциометрическо-го анализа при реакции осаждения на примере определения хлорида натрия взаимодействием с нитратом серебра. Титрование ведут с серебряным индикаторным электродом . [33]
Рассмотрим в качестве примера потенциометрическое титрование с осаждением галогенида серебра. Оно проводится с серебряным индикаторным электродом . Перед достижением точки эквивалентности в растворе имеется избыток ионов серебра, в точке эквивалентности концентрация ионов серебра равна концентрации галогенид-ионов, продолжение процесса титрования создает избыток последних. [34]
При титровании по второму способу внутрикомплексное соединение экстрагируют смесью спирта и эфира. Адсорбцию осадка на серебряном индикаторном электроде устраняют добавлением в анализируемый раствор нитрата калия. Хорошие результаты получены при титровании смеси серебра с медью, свинцом и цинком, а при титровании в смеси с медью, кадмием и цинком резкие скачки потенциала наблюдаются только для серебра и меди. [35]
Дифференцированное определение содержания в растворе смеси галогенидов возможно по двум скачкам потенциала. Титрование проводят стандартным раствором нитрата серебра с серебряным индикаторным электродом и насыщенным каломельным электродом сравнения компенсационным методом. [36]
Дифференцированное определение содержания в растворе смеси галогенидов возможно по двум скачкам потенциала. Титрование проводят стандартным раствором нитрата серебра с серебряным индикаторным электродом и насыщенным каломельным электродом сравнения компенсационным методом. AgI / I -, Ag j, поэтому серебряный электрод подключают к потенциометру со знаком минус.
Когда же все ионы I свяжутся и начнется реакция между ионами Ag и С1 -, потенциал индикаторного электрода станет положительнее потенциала насыщенного каломельного электрода, что приведет к необходимости переключения электродов к потенциометру. Следует и меть в виду, что в связи с образованием осадка равновесный потенциал индикаторного электрода устанавливается во времени.
Поэтому титрование ведут в присутствии сильного электролита Ва ( Ж) 3) 2или Ва ( СН3СОО) 2, который препятствует адсорбции галогенидов. При определении хлоридов или их смеси с другими галогенидами необходимо пользоваться мостиком, наполненным насыщенным раствором нитрата или сульфата калия, так как из раствора хлорида калия КС1 ионы могут диффундировать в титруемый раствор.
Перед каждым титрованием индикаторный электрод очищают от галогенидов серебра. Электрод опускают в 10-процентный раствор аммиака и тщательно промывают дистиллированной водой. В стакан для титрования берут аликвотную часть испытуемого раствора и прибавляют равный объем 10-процентного раствора нитрата или ацетата бария. Находят при ориентировочном титровании два скачка потенциала. Производят точное титрование, прибавляя по 2 капли титранта в области обоих скачков. [37]
Во время работы следят за тем, чтобы платиновая проволока или пластинка примерно наполовину была погружена в раствор и чтобы через систему непрерывно пропускался водород. При потенциометрическом титровании галогенов азотнокислым серебром необходимо пользоваться серебряным индикаторным электродом . [39]
Многократность применения ионоселективных электродов позволяет предполагать, что для анализа хлоридов в определенной области концентраций этот метод заменит все другие методы. В классической потенциометрии основной частью прибора является серебряный индикаторный электрод и каломельный электрод сравнения, последний соединяется с ячейкой солевым мостиком. Спиртовая среда предпочтительнее водной, хотя при этом и повышается значение диффузионного потенциала в точке эквивалентности. Потенциал индикаторного электрода зависит по уравнению Нернста от активности титруемого хлорида. [40]
Еще одним способом, позволяющим по-видимому исключить причины надежности определения жидкостных диффузионных потенциалов и изменяющихся коэффициентов активности в прямых потенциометриче-ских измерениях, является использование метода стандартных добавок. Допустим, что необходимо определить концентрацию иона серебра в растворе, используя электрохимический элемент, описанный ранее. Тогда переносят известный объем раствора исследуемой пробы в элемент, измеряют потенциал серебряного индикаторного электрода ( Ei) относительно насыщенного каломельного электрода сравнения, а затем добавляют известный объем стандартного раствора иона серебра в раствор пробы, находящийся в элементе. После этого измеряют новый потенциал серебряного индикаторного электрода Е2 относительно электрода сравнения. [41]
В слабокислой среде в присутствии комплексона только серебро и одновалентный таллий осаждаются йодидом калия, так как остальные катионы, как, например, свинец, висмут и медь, прочно связываются в комплексы и с йодидом не реагируют. В нейтральной среде серебро образует комплексное соединение Ag2Y2 -, как было установлено амперометрическим титрованием комцлек-соном [26], и не осаждается йодидом.
Подробным исследованием этой реакции показано, что только в нейтральной среде можно потенциометрически определить серебро при помощи серебряного индикаторного электрода . В кислых растворах, в которых происходит выделение йодида серебра, результаты всегда получаются пониженными. Авторы рекомендуют следующий ход определения.
К раствору, содержащему не менее 1 мг серебра, прибавляют требуемое количество комплексона и 5 капель бромтимолового синего. Присутствующий в небольшом избытке комплексен на определение не влияет. Таким путем можно определить серебро в присутствии свинца, меди, висмута, кадмия даже и тогда, когда эти элементы присутствуют в 300-кратном избытке.
Пятивалентный мышьяк и трехвалентная сурьма ( связанные в растворе винной кислотой) не мешают определению. Присутствие двухвалентной ртути и катионов группы бария делает определение невозможным. Согласно авторам, метод можно с хорошими результатами применять для анализа различных сплавов с серебром. После их растворения в азотной кислоте к раствору прибавляют комплексен и винную кислоту ( в присутствии сурьмы), нейтрализуют едким натром и титруют описанным способом. Аналогично поступают при анализе руд. [42]
В слабокислой среде в присутствии комплексона только серебро и одновалентный таллий осаждаются иодидом калия, так как остальные катионы, как, например, свинец, висмут и медь, прочно связаны в комплекс и с иодидом не реагируют. В нейтральной среде серебро образует комплексное соединение Ag2Y2 -, как было установлено амперометрическим титрованием его комплексоном [114], и не осаждается иодидом.
Подробным исследованием этой реакции показано, что только в нейтральной среде можно потенциометри-чески определить серебро — при помощи серебряного индикаторного электрода . В кислых растворах, в которых происходит выделение иодида серебра, результаты всегда получаются пониженными. Авторы рекомендуют следующий ход определения.
К раствору, содержащему не менее 1 мг серебра, прибавляют требуемое количество комплексона и 5 капель бромтимолового синего. Присутствующий в небольшом избытке комплексен на определение не влияет. Таким путем можно определить серебро в присутствии свинца, меди, висмута, кадмия даже и тогда, когда они присутствуют в 300-кратном избытке.
Пятивалентный мышьяк и трехвалентная сурьма ( связанные в растворе винной кислотой), не влияют на определение. Присутствие двухвалентной ртути и катионов группы бария делает определение невозможным. Согласно авторам, метод можно с хорошими результатами применять для анализа различных сплавов с серебром. После их растворения в азотной кислоте к раствору прибавляют комплексон и винную кислоту ( в присутствии сурьмы), нейтрализуют едким натром и титруют описанным способом. [43]
Метод основан на осаждении тиолов нитратом серебра. Применение спирта для растворения пробы и спиртового раствора нитрата серебра полностью предотвращает образование эмульсии и адсорбцию. Чтобы не допустить наличия избытка нитрата серебра к концу осаждения, конечную точку титрования определяют по-тенциометрически с помощью серебряного индикаторного электрода . [44]
Наибольшую ценность для микро — и ультрамикроанализа представляют методы [364, 388], в которых сочетается быстрота детектирования ТЭ с высокой чувствительностью и точностью. Метод дифференциальной электролитической потенциометрии [364] по чувствительности приближается к масс-спектрометрии и нейтрон-но-активационному анализу, но не требует столь сложной аппаратуры. Титрант генерируется в этом методе за счет растворения серебряного анода, соединенного в цепь с платиновым вспомогательным электродом, а индикация ТЭ осуществляется измерением разности потенциалов между двумя серебряными индикаторными электродами . Сила генерирующего тока при определении 80 и 0 8 нг Вг — составляет соответственно 2 2 и 0 122 мка, питающее напряжение 60 и 12 в. Хлориды определяют аналогично, но иодиды образуют на генераторном аноде непроводящую пленку. [45]
Источник: www.ngpedia.ru