Порядок заполнения оболочек атома меди (Cu) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Медь имеет 29 электронов, заполним электронные оболочки в описанном выше порядке:
Элемент Cu является исключением!
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
1 электрон на 4s-подуровне
10 электронов на 3d-подуровне
Степень окисления меди
Атомы меди в соединениях имеют степени окисления 4, 3, 2, 1, 0.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Химические элементы: медь
Ионы меди
Валентность Cu
Атомы меди в соединениях проявляют валентность IV, III, II, I.
Валентность меди характеризует способность атома Cu к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cu
Квантовые числа определяются последним электроном в конфигурации, для атома Cu эти числа имеют значение N = 3, L = 2, Ml = 2, Ms = -½
Видео заполнения электронной конфигурации (gif):

Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Энергия ионизации Cu:
Eo = 746 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Cu в таблице менделеева? найти
Источник: k-tree.ru
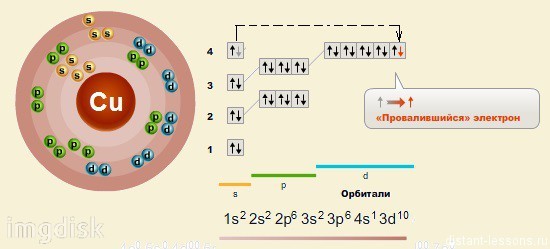
Строение атома меди
Относится к элементам d — семейства. Металл. Обозначение – Cu. Порядковый номер – 29. Относительная атомная масса – 63,546 а.е.м.
Электронное строение атома меди
Атом меди состоит из положительно заряженного ядра (+29), внутри которого есть 29 протонов и 35 нейтронов, а вокруг, по четырем орбитам движутся 29 электронов.
Химия 11 класс (Урок№12 — Медь. Цинк. Титан. Хром. Железо. Никель. Платина.)

Рис.1. Схематическое строение атома меди.
Распределение электронов по орбиталям выглядит следующим образом:
Состояние считается более энергетически выгодным, если на d-подуровне находится 5 или 10 электронов, поэтому в случае меди мы наблюдаем проскок: один электрон s-подуровня переходит на d-подуровень для того, чтобы положение было устойчивым.
Энергетическая диаграмма основного состояния принимает следующий вид:
Примеры решения задач
- P – фосфор.
- Порядковый номер – 15. Элемент находится в 3 периоде, в V группе, А (главной) подгруппе.
- Z=15 (заряд ядра), M=31 (массовое число), e=15 (число электронов), p=15 (число протонов), n=31-15=16 (число нейтронов).
- 15P 1s 2 2s 2 2p 6 3s 2 3p 3 – электронная конфигурация, валентные электроны 3s 2 3p 3 .
- Основное состояние


- p-элемент, неметалл.
- Высший оксид – P2O5 — проявляет кислотные свойства:
Гидроксид, соответствующий высшему оксиду – H3PO4, проявляет кислотные свойства:
- Минимальная степень окисления «-3», максимальная – «+5».
Дадим характеристику химическому элементу азоту :
- N – азот.
- Порядковый номер – 7. Элемент находится в 2 периоде, в V группе, А (главной) подгруппе.
- Z=7 (заряд ядра), M=14 (массовое число), e=7 (число электронов), p=7 (число протонов), n=14-7=7 (число нейтронов).
- 7N 1s 2 2s 2 2p 3 – электронная конфигурация, валентные электроны 2s 2 2p 3 .
- Основное состояние


- p-элемент, неметалл.
- Высший оксид – N2O5 — проявляет кислотные свойства:
Гидроксид, соответствующий высшему оксиду – HNO3, проявляет кислотные свойства:
- Минимальная степень окисления «-3», максимальная – «+5»
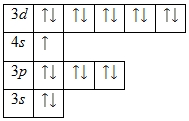
| Задание | Приведите электронную формулу атома хрома. Сколько неспаренных электронов имеет атом хрома в основном состоянии? |
| Ответ | +24 Cr)2)8)13)1; |
Энергетическая диаграмма основного состояния принимает следующий вид:

Количество неспаренных электронов в атоме хрома равно шести.
Источник: ru.solverbook.com
Медь

Медь расположена в IB группе Периодической системы химических элементов Д.И. Менделеева. В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3d 9 4s 2 , однако вследствие устойчивости d 10 -состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию: 3d 10 4s 1 . В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
Физические свойства меди
Медь – пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло- и электропроводностью, по значению электропроводности уступает только серебру. Температура плавления 1083°С, температура кипения 2567°С, плотность 8,92 г/см 3 .

На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления.
Химические свойства меди
С кислородом в зависимости от температуры взаимодействия медь образует два оксида:
2Cu + O2 = 2CuO (черный цвет)
При температуре около 150 о С металл покрывается темно-красной пленкой оксида меди (I):
4Cu + O2 = 2Cu2O
При нагревании с фтором, хлором, бромом образуются галогениды меди (II):
Cu + Br2 = CuBr2;
с йодом – образуется йодид меди (I):
2Cu + I2 = 2CuI.
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому она не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей.
Растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и оксида азота (II):
Реагирует с концентрированными растворами серной и азотной кислот с образованием солей меди (II) и продуктов восстановления кислот:
С концентрированной горячей соляной кислотой:
Получение
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырье содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°:
Затем обожженный концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди:
Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
Электролизный метод
Электролиз раствора сульфата меди:
Источник: www.yoursystemeducation.com