На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Бериллий имеет 4 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
Степень окисления бериллия
Атомы бериллия в соединениях имеют степени окисления 2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы бериллия
Валентность Be
Атомы бериллия в соединениях проявляют валентность II.
Валентность бериллия характеризует способность атома Be к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Производство, применение и получение бериллия. Преподаватель спец.дисциплин Оразов Ш.
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Be
Квантовые числа определяются последним электроном в конфигурации, для атома Be эти числа имеют значение N = 2, L = 0, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):

Результат:
Соединения бериллия
| Соль | BeHPO4 | Гидроортофосфат бериллия |
| Be(H2PO4)2 | Дигидроортофосфат бериллия | |
| Основание | Be(OH)2 | Гидроксид бериллия |
| Оксид | BeO | Оксид бериллия |
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Энергия ионизации Be:
Eo = 900 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Be в таблице менделеева? найти
Источник: k-tree.ru
55. Общая характеристика подгруппы бериллия
К подгруппе бериллия относятся: бериллий и щелочноземельные металлы: магний, стронций, барий, кальций и радий . Наиболее распространены в природе в виде соединений, причем в основном магния и кальция. Первые два элемента подгруппы занимают в ней несколько обособленное положение – бериллий по свойствам близок к алюминию, а магний – к цинку. Последний элемент подгруппы – радий – имеет радиоактивные изотопы. Кроме бериллия, все элементы подгруппы обладают металлическими свойствами, более твердые по сравнению с щелочными металлами, с высокими температурами плавления. Относятся к легким металлам (кроме радия).
Химия. Как найти, где главная и где побочная подгруппы?
На электронном уровне элементов имеют два электрона (s2), которые они отдают, образуя соединения со степенью окисления +2. По химической активности щелочноземельные металлы уступают щелочным. Они окисляются на воздухе, вытесняют водород из воды, но бериллий и магний взаимодействуют с ней медленно.
У щелочноземельных элементов растворимость гидроксидов увеличивается от магния к барию. Сжигая щелочноземельные металлы, можно получить оксиды. Перекиси щелочноземельных металлов менее стойки, чем перекиси щелочных металлов. С водородом образуют гидриды. Способность взаимодействовать с азотом возрастает с увеличением атомного веса, в результате образуются нитриды.
Соли щелочноземельных металлов малорастворимы в воде.
56. Кальций
Кальций (Са) – химический элемент 2-й группы периодической системы, является щелочноземельным элементом. Природный кальций состоит из шести стабильных изотопов. Конфигурация внешней электронной оболочки 4s2; имеет степень окисления +2, реже +1. Содержание в земной коре составляет 3,38 %. Встречается исключительно в виде соединений, в основном солей кислородсодержащих кислот.
Большое количество кальция находится в природных водах. Значительное количество кальция содержится в организмах многих животных.
Общие свойства. Кальций – серебристо-белый металл. Существует в двух аллотропных модификациях. На воздухе, имеющем пары воды, кальций быстро образует оксид СаО и гидроксид Са (ОН)2 . Вступает в реакцию с кислородом, образуя СаО; при повышении температуры в кислороде и на воздухе воспламеняется.
Из воды вытесняет водород Н2 , при этом образуется Са(ОН)2 , в холодной воде скорость реакции уменьшается. Взаимодействует с галогенами, образуя СаХ2. СН 2 при нагревании кальция дает гидрид СаН2 , в котором водород является анионом.
Кальций, нагреваемый в атмосфере азота, загорается и образует нитрид Ca3N2 . С углеродом образует кальция карбид СаС2 , с бором – борид СаВ6 . Образует соединения с металлами (Ag, Au, Al, Cu, Mg, Rb), вытесняет их из расплавов солей. Кальций растворим в жидком аммиаке NH3 с образованием синего раствора. Соли получают при взаимодействии кислотных оксидов с оксидом кальция. Они хорошо растворимы, способны образовывать кристаллогидраты.
В водных растворах образуются комплексы преимущественно с кислотосодержащими лигандами, имеющие в своем составе ион Са2+. На основе этих комплексов основано действие умягчителей воды – полифосфатов натрия. Ион Са2+в неводных растворах образует комплексы с молекулами растворителя.
Получение. Промышленное получение кальция состоит в алюмотермическом восстановлении оксида кальция и электролизе расплава хлорида кальция (75–85 %) и хлорида калия. Безводный хлорид кальция получают путем хлорирования его оксида в присутствии угля или обезвоживая кристаллогидрат хлорида кальция. По мере выделения кальция в расплаве в него добавляют хлорид кальция. Электролиз проводят, используя графитовый анод и в качестве катода – жидкий расплав кальция (62–65 %) и меди.
Применение . Кальций используют при ме-таллотермическом получении U, Th, Ti, Z r, Cs, Rb и некоторых лантаноидов, для удаления примесей кислорода, азота, серы, фосфора из сплавов, обезвоживания органических жидкостей, очистки Аr от примеси N2. Используются и соединения кальция, например, в качестве вяжущих материалов.
Источник: studfile.net
БЕРИЛЛИЙ


БЕРИЛЛИЙ (от греч. beryllion — уменьшит. от beryllos — берилл; лат. Beryllium) Be, хим. элемент II гр. периодич. системы, ат. н. 4, ат. м. 9,01218. В природе встречается только один стабильный изотоп 9 Ве. Поперечное сечение захвата тепловых нейтронов 0,90*10 -30 м 2 , поперечное сечение рассеяния нейтронов 7,54*10 -28 м 2 . Конфигурация внеш. электронной оболочки 2s 2 ; степени окисления +2, + 1 (крайне неустойчива); энергия ионизации Ве° -> Be 1+ ->Ве 2+ соотв. 9,3227 и 18,2112 эВ; электроотрицательность по Полингу 1,5; атомный радиус 0,113 нм; ионный радиус Be 2+ 0,030 нм (координац. число 3).
Содержание бериллия в земной коре 6*10 -4 % по массе, в воде морей и океанов 6*10 -7 мг/л. Известно 54 собственно бериллисвых минерала, важнейшие из них — берилл (и его разновидности — изумруд, аквамарин, гелиодор, воробьевит, ростерит, бандит) 3ВеО*А12О3*6SiO2 (14,0% ВеО), фенакит 2BeO*SiO2 (45,5% ВеО), бертрандит 4ВеО*2SiO2*Н2О (36,5% ВеО), гельвин (Mn,Fe,Zn)4[BeSiO4]3S (11,0-14,2% ВеО). Общие запасы бериллия в рудах (в виде берилла и бертрандита) — 380 тыс. т (1980).
Свойства. Бериллий — хрупкий твердый металл светло-серого цвета с металлич. блеском.
Имеет две кристаллич. модификации: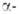 Be — решетка гексагональная типа Mg(a = 0,22866 нм, с = 0,35833 нм, z = 2, пространств. группа Р63/mmc);
Be — решетка гексагональная типа Mg(a = 0,22866 нм, с = 0,35833 нм, z = 2, пространств. группа Р63/mmc); 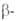 Be — решетка кубическая типа
Be — решетка кубическая типа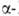 Fe (a = 0,25515 нм, пространств. группа /mЗm); т-ра перехода
Fe (a = 0,25515 нм, пространств. группа /mЗm); т-ра перехода 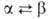 1277°С,
1277°С, 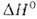 перехода 2,1 кДж/моль. Т. пл.
перехода 2,1 кДж/моль. Т. пл.
1287°С, т. кип. 2471 °С; плотн. 1,816 г/см 3 , жидкого 1,690 г/см 3 (1287°С); для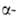
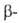 Be 30,0 Дж/(моль*К) (1555 К);
Be 30,0 Дж/(моль*К) (1555 К); 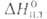 12,6 кДж/моль,
12,6 кДж/моль, 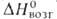 324 кДж/моль (298,15 К),
324 кДж/моль (298,15 К), 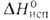 309,9 кДж/моль (2744 К); S°298 9,50 Дж/(моль*К). Ур-ния температурных зависимостей давления пара соотв. над твердым и жидким бериллием: lg p(Па) = 7,22364 — 16498,359/Т — 0,00047200T + 1,52356 lg T; lg pПа) = 16,68444 — 17051,58/T+ 0,00002400T — 1,60643 lg Т Температурный коэф. линейного расширения для бериллия 99,9%-ной чистоты при 300-500 К 12*10 -6 К -1 (параллельно оси с кристаллич. решетки), 9*10 -6 К -1 (перпендикулярно оси с), для бериллия с примесями [1,264% (А1 + Ме)1 13,9*10 -6 — 19,6*10 -6 К -1 (293-1373 К); температурный коэф. объемного расширения 33,24*10 -6 К -1 (273-323 К); теплопроводность для бериллия 99,9%-ной чистоты 2930-1464 Вт/(м*К) (20-95 К), для бериллия с примесями [1,264% (Al + Mg)] 194-81 Вт/(м*К) (273-1273 К);
309,9 кДж/моль (2744 К); S°298 9,50 Дж/(моль*К). Ур-ния температурных зависимостей давления пара соотв. над твердым и жидким бериллием: lg p(Па) = 7,22364 — 16498,359/Т — 0,00047200T + 1,52356 lg T; lg pПа) = 16,68444 — 17051,58/T+ 0,00002400T — 1,60643 lg Т Температурный коэф. линейного расширения для бериллия 99,9%-ной чистоты при 300-500 К 12*10 -6 К -1 (параллельно оси с кристаллич. решетки), 9*10 -6 К -1 (перпендикулярно оси с), для бериллия с примесями [1,264% (А1 + Ме)1 13,9*10 -6 — 19,6*10 -6 К -1 (293-1373 К); температурный коэф. объемного расширения 33,24*10 -6 К -1 (273-323 К); теплопроводность для бериллия 99,9%-ной чистоты 2930-1464 Вт/(м*К) (20-95 К), для бериллия с примесями [1,264% (Al + Mg)] 194-81 Вт/(м*К) (273-1273 К); 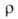 (в Ом*м] 4,0*10 -8 (30К), 6,6*10 -8 (293 К), 16*10 -8 (600 К), 32*10 -8 (1000 К); температурный коэфф.
(в Ом*м] 4,0*10 -8 (30К), 6,6*10 -8 (293 К), 16*10 -8 (600 К), 32*10 -8 (1000 К); температурный коэфф. 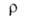 6,6*10 -3 К -1 (273-373 К); т-ра перехода в сверхпроводящее состояние для компактного металла 0,026 К, для тонких пленок, полученных осаждением из газовой фазы, 5,0-8,2 К; диамагнитен, магн. восприимчивость -1*10 -9 (293 К); стандартный электродный потенциал (Be/Be 2+ ) —1,7 В;
6,6*10 -3 К -1 (273-373 К); т-ра перехода в сверхпроводящее состояние для компактного металла 0,026 К, для тонких пленок, полученных осаждением из газовой фазы, 5,0-8,2 К; диамагнитен, магн. восприимчивость -1*10 -9 (293 К); стандартный электродный потенциал (Be/Be 2+ ) —1,7 В; 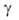 жидкого 1,444 Дж/м 2 (1560 К).
жидкого 1,444 Дж/м 2 (1560 К).
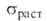
Мех. св-ва бериллия в значительной степени зависят от его чистоты и способа термич. обработки; 229-573 МПа, предел текучести при растяжении 213-277 МПа, относительное удлинение 0,36-15,8%, модуль упругости 0,290-0,311 МПа, твердость по Бринеллю 1060-1320 МПа. Для получения заготовок и изделий из бериллия в осн. используют методы порошковой металлургии.
Бериллий в жидком состоянии раств. во мн. металлах, напр. в А1, Си, Fe, Co, Ni, Zn, не раств. в Mg. Твердые р-ры образует лишь с нек-рыми металлами; наиб, растворим бериллий в сплавах с Си (2,75% по массе), N1 (2,7%), Сг (1,7%), р-римость сильно уменьшается с понижением т-ры, в результате чего сплавы, содержащие бериллий, способны к дисперсионному твердению.
Компактный бериллий устойчив на воздухе и не взаимод. с горячей и холодной водой благодаря образованию на его пов-сти пленки бериллия оксида ВеО; выше 800°С заметно окисляется. Взаимод. с разб. и конц. соляной к-той и H2SO4, при нагревании-с HNO3.
С р-рами щелочей (с концентрированными-на холоду, с разбавленными-при нагревании) образует соли — берилла ты М2[Ве(ОН)4], с расплавами щелочей — бериллаты М2ВеО2. При взаимод. с N2 или NH3 при 500-900°С получается нитрид Be3N2, с С при 1700-2100°С — карбид Ве2С, с галогенами — галогениды ВеНа12, с Р выше 750°С-фосфид Ве3Р2. В вакууме выше 700°С бериллий восстанавливает КОН, при 270°С — ВаО, при 1075°C — MgO, при 1400°С — ТiO2 до соответствующих металлов и при 270°C — SiCl4 до Si. С Н2 до 1300°С не взаимодействует. Ниже приводятся св-ва нек-рых соед. бериллия.
Гидроксид Ве(ОН)2 получают осаждением из водных р-ров солей бериллия аммиаком или NaOH; в зависимости от условий осаждения гидроксид может существовать в разл. формах, отличающихся структурой и р-римостью в воде. Он амфотерен; свежеосажденный реагирует с к-тами, с р-рами щелочей образует М2[Ве(ОН)4].
Из галогенидов бериллия наиб, важен бериллия фторид BeF2. Для ВеС12 т. пл. 416°С, т. кип. 550°С; раств. в воде (42,2% по массе при 20°С), спирте, эфире, CS2; получают действием С12 на смесь ВеО и С при 650-1000 °С; компонент расплавов при электролитич. получении бериллия. Для ВеВr2 т. пл.
488 °С, для Ве12 510°С.
Сульфат BeSO4 и нитрат Be(NO3)2 при обычных условиях существуют в виде тетрагидратов. Сульфат раств. в воде (29,7% BeSO4 при 25°С); мало гигроскопичен: при 400°С обезвоживается, при 547-600°С разлагается на ВеО и SO3. Нитрат раств. в воде [51,2% Be(NO3)2 при 20 С]; сильно гигроскопичен; при 60-100°С образует гидроксопитрат переменного состава, выше 200°С или при 130-300°С в вакууме разлагается до ВеО; безводную соль получают разложением Be(NO3)2*2N2O4 в вакууме при 50 o С.
Гидроксокарбонат — соед. переменного состава, образуется при взаимод. водных р-ров солей бериллия с Na2CO3 или (NH4)2CO3; с др. карбонатами дает комплексные соединения.
Действием карбоновых к-т на Ве(ОН)2 или гидроксокарбонат бериллия получают оксисоли типа Be4O(OOCR)6, представляющие собой молекулярные соединения. Наиб. важен оксиацетат Ве4О(ООССН3)6 — кристаллы; т.пл. 284°С, т. кип. 331°С, т. возг. 200°С (в вакууме), т. разл.
600-700°С; не раств. в воде, хорошо раств. в орг. р-рителях; промежут. продукт при очистке бериллия от др. элементов перегонкой, а также при получении ВеО высокой чистоты. Для формиата Ве4О(ООСН)6 т. возг. 247-257°С (в вакууме). В водных р-рах соли бериллия гидролизуются.
Получение. Бериллий извлекают из рудного концентрата (берилла) сульфатным или фторидным способом. В первом случае концентрат сплавляют (750°С) с Na2CO3 или СаСО3, сплав обрабатывают конц. горячей H2SO4. Из образовавшегося р-ра сульфатов Be, A1 и др. действием (NH4)2SO4 отделяют А1 в виде алюмо-аммониевых квасцов, оставшийся р-р обрабатывают избытком NaOH; при этом образуется р-р Na2[Be(OH)4] и алюминатов Na. При кипячении р-ра в результате разложения бериллата осаждается Ве(ОН)2; алюминат остается в р-ре; Ве(ОН)2 очищают от примесей экстракцией трибутилфосфатом.
По фторидному способу концентрат спекают с Na2[SiF6] и Na2CO3. Ок. 750°С образуется фторобериллат Na:
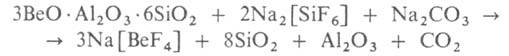
Фторобериллат Na2[BeF4] выщелачивают водой и из полученного р-ра действием NaOH осаждают Ве(ОН)2, при прокаливании к-рого образуется ВеО. Иногда Ве(ОН)2 дополнительно очищают, растворяя его в H2SO4 в присут. комплексонов и затем осаждая аммиаком. К оставшемуся после действия NaOH р-ру, содержащему NaF, для утилизации последнего добавляют Fe2(SO4)3, при этом осаждается Na3[FeF6], к-рый также используется для разложения берилла, частично заменяя Na2[SiF6].
Сульфатный способ используют также для извлечения бериллия из бертрандита. При этом сернокислый р-р экстрагируют керосином, содержащим ди(2-этилгексил) фосфорную к-ту. Орг. фракцию обрабатывают водным р-ром (NH4)2CO3, при этом осаждаются гидроксиды и гидроксокарбонаты Fe и А1, а бериллий остается в р-ре в виде (NH4)2[Be(CO3)2], к-рый при нагревании р-ра до 95°С количественно разлагается, образуя осадок 2ВеСО3*Ве(ОН)2; при прокаливании последнего при 165°С получают Ве(ОН)2.
Для получения металлич. бериллия ВеО или Ве(ОН)2 переводят в ВеС12 или BeF2. Фторид восстанавливают Mg при 925-1325°С. Расплав смеси ВеС12 с NaCl подвергают электролизу. Очищают бериллий до 99,98%-ной чистоты вакуумной дистилляцией. Пластичный бериллий, содержащий не более 10~ 4 % примесей, получают зонной плавкой.
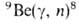
Определение. Для обнаружения бериллия используют эмиссионные дуговой и искровой спектральные методы (особенно широко — при анализе прир. и биол. объектов), колориметрич. (с хинализарином, бериллоном II или арсеназо I), флуорометрич. (с морином, 8-гидроксихинолином, 8-гидроксихинальдином) и радиоактивационные методы. Важное значение имеет фотонейтронный метод, не требующий отделения сопутствующих элементов; кол-во нейтронов, возникающих при р-ции Be, пропорционально содержанию бериллия в пробе. Для определения бериллия в биол. объектах и воде океанов практич. значение имеет метод изотопного разбавления с использованием искусственного радиоактивного изотопа 7 Ве(Т1/2 53,01 сут). Гравиметрич. методом бериллий определяют: в виде ВеО, получаемого после осаждения Ве(ОН)2 аммиаком при рН 9,6 в присут. комплексона III и прокаливания при 1000°С; в виде Ве2Р2О7, образующегося после осаждения и прокаливания при 800°С NH4BePO4; в виде [Co(NH3)6]2[Be4O(CO3)6]*хН2О (х = 10,8 — 11,3), осаждающегося при действии [Co(NH3)6]Cl2 на р-р (NH4)2[Be(CO3)2].
Применение. Бериллий-легирующая добавка в медных [бериллиевые бронзы; в США — ок. 80% производимого бериллия (1980)], никелевых, железных, магниевых и др. сплавах, приобретающих благодаря бериллию высокую прочность и твердость, хорошую электрич. проводимость, теплопроводность и коррозионную стойкость.
Насыщение пов-сти стальных деталей бериллием (бериллизация) повышает их коррозионную стойкость. Ок. 20% производимого бериллия (США, 1980) используется в авиастроении, ракетной (детали сверхзвуковых самолетов. оболочки ракет и др.) и ядерной технике (отражатели, замедлители нейтронов); ок. 40%-в электротехнике, ок. 15%-в электронике (напр., приборы акустоэлектроники).
Из бериллия изготовляют окошки рентгеновских трубок, т. к. он проницаем для рентгеновских лучей. Изотоп 7 Ве — радиоактивный индикатор. Бериллий в смеси с препаратами Ra служит источником нейтронов (т.к. испускает нейтроны при действии 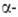 частиц,
частиц,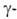 излучения) и дейтронов в результате ядерных р-ций:
излучения) и дейтронов в результате ядерных р-ций: 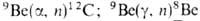 ; 9 Be(d, n) 10 Be.
; 9 Be(d, n) 10 Be.
Летучие и р-римые соед. бериллия, пыль, содержащая бериллий и его соед., очень токсичны, обладают аллергич. и канцерогенным действием, раздражают кожу и слизистые оболочки, вызывают дерматозы, конъюнктивиты, назофарингит и др. заболевания кожи и слизистых, заболевания легких и бронхов — трахеобронхит, пневмонию и опухоли легких. Заболевания могут возникнуть через 10-15 лет после прекращения контакта с бериллием. Для бериллия и его соед. (в пересчете на бериллий) ПДК 0,001 мг/м 3 , в питьевой воде 0,0002 мг/л.
Мировая добыча бериллиевых руд 1350 т/год (1979), самого бериллия-ок. 350 т/год (1980). Бериллий открыт Л. Вокленом в 1798. Металлич. бериллий получен Ф. Вёлером и независимо от него А. Бюсси в 1828.
===
Исп. литература для статьи «БЕРИЛЛИЙ» : Бериллий, под ред. Д.Уайта, Д. Берка, пер. с англ., М., 1960; Дарвин Дж., БаддериДж., Бериллий, пер. с англ., М., 1962; Кьелл грен Б. Р., Бериллий, в кн.: Справочник по редким металлам, пер. с англ., М., 1965, с. 47-80; Новоселова А. В., Бацанова Л. Р., Аналитическая химия бериллия, М., 1966; Эверест Д. А., Химия бериллия, пер. с англ., М., 1968; Котан Б. И., Капустинская К. А., Топунова Г. А., Бериллий, М., 1975: Бериллий.
Справочник, под ред. А. И. Бурназяна, М., 1980; Beryllium science and technology, ed. by D. Webster, G.J.London, v. 1-2, N.Y.-L.. 1979. A.B. Новоселова.
Страница «БЕРИЛЛИЙ» подготовлена по материалам химической энциклопедии.
Источник: xumuk.ru