Глава 4. Физико-химические методы анализа . Тесты с ответами (2011 год)
Электрохимические методы анализа . Тесты с ответами (2011 год)
1. ИОНОМЕТРИЯ ОСНОВАНА НА ИЗМЕРЕНИИ
3) электродвижущих сил
4) количества электричества
2. ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К ЭЛЕКТРОДУ СРАВНЕНИЯ
1) постоянный потенциал
2) механическая прочность
3) высокий мембранный потенциал
4) высокая восприимчивость к изменению pH
3. ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА РАВЕН
4. В УРАВНЕНИИ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА, ПРЕДСТАВЛЕННОГО ВЫШЕ, IR-ЭТО
1) сопротивление ячейки
2) омическое падение напряжения
3) силовая постоянная
4) скачок потенциала
5. В РАСТВОРЕ, СОДЕРЖАЩЕМ ХЛОРИД-ИОНЫ, СЕРЕБРЯНЫЙ ЭЛЕКТРОД ЯВЛЯЕТСЯ ЭЛЕКТРОДОМ
3) третьего рода
4) четвёртого рода
6. МЕТОД, ОСНОВАННЫЙ НА ИЗМЕРЕНИИ ПОТЕНЦИАЛА ЭЛЕКТРОДА В АНАЛИЗИРУЕМОМ РАСТВОРЕ И ПОСЛЕ ВВЕДЕНИЯ ИЗВЕСТНОГО ОБЪЁМА СТАНДАРТНОГО РАСТВОРА, НАЗЫВАЕТСЯ
Надо ли сушить электроды перед сваркой? Сварка сухим и сырым электродом. Термопенал Кедр
1) метод градуировочного графика
2) метод градуировки электрода
3) метод стандартов
4) метод добавок
7. ПРИ ПОТЕНЦИОМЕТРИЧЕСКОМ ТИТРОВАНИИ МОЖНО ОПРЕДЕЛИТЬ ОТДЕЛЬНО В РАСТВОРЕ ПРИ СОВМЕСТНОМ ПРИСУТСТВИИ СЛЕДУЮЩИЕ ГАЛОГЕНИД-ИОНЫ
8. СУММА ЭНЕРГИИ ТЕПЛОВОГО ДВИЖЕНИЯ, ВНУТРИ- И МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ, ЯДЕРНОЙ ЭНЕРГИИ ПРЕДСТАВЛЯЕТ СОБОЙ
1) внешнюю энергию
2) внутреннюю энергию
4) связанную энергию
9. ПРИ ПОВЕШЕНИИ ТЕМПЕРАТУРЫ НА 1º0ПО ПРАВ ИЛУ ВАНТ-ГОФФА СКОРОСТЬ РЕАКЦИИ УВЕЛИЧИВАЕТСЯ В
10. ЕСЛИ В КАЖДОЙ ИЗ ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНЫХ ПАР ПЕРЕНОСИТСЯ ОДИНАКОВОЕ ЧИСЛО ЭЛЕКТРОНОВ, ТО РЕАКЦИЮ НАЗЫВАЮТ
11. В ОСНОВЕ КУЛОНОМЕТРИЧЕСКОГО МЕТОДА АНАЛИЗА ЛЕЖАТ ЗАКОНЫ
12. МАССА ВЕЩЕСТВА, ВЫДЕЛИВШЕГОСЯ НА ЭЛЕКТРОДЕ В ПРОЦЕССЕ ЭЛЕКТРОЛИЗА ПРИ ПРОТЕКАНИИ ЕДИНИЦЫ КОЛИЧЕСТВА ЭЛЕКТРИЧЕСТВА
1) массовый эквивалент
2) электрохимическая единица
3) эквивалент массы
4) электрохимический эквивалент
13. КОЛИЧЕСТВО ЭЛЕКТРИЧЕСТВА, КОТОРОЕ НУЖНО ЗАТРАТИТЬ НА ВЫДЕЛЕНИЕ 1 МОЛЯ ВЕЩЕСТВА В ПРОЦЕССЕ ЭЛЕКТРОЛИЗА НАЗЫВАЕТСЯ
1) число Фарадея
2) электрохимическая единица
3) коэффициент Кулона
4) единица Кулона
14. КОЛИЧЕСТВО ЭЛЕКТРИЧЕСТВА, ПЕРЕНОСИМОЕ В 1 СЕКУНДУ ПРИ ПОСТОЯННОЙ СИЛЕ ТОКА В 1 АМПЕР, НАЗЫВАЕТСЯ
15. ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА, В КОТОРОЙ ПРИ ЗАМЫКАНИИ ЦЕПИ СО 100%-НЫМ ВЫХОДОМ ПО ТОКУ ПРОТЕКАЕТ ЭЛЕКТРОХИМИЧЕСКАЯ РЕАКЦИЯ ИЗВЕСТНОЙ СТЕХИОМЕТРИИ, НАЗЫВАЕТСЯ
16. ТИТРАНТ, ОБРАЗУЮЩИЙСЯ В РЕЗУЛЬТАТЕ ЭЛЕКТРОХИМИЧЕСКОЙ РЕАКЦИИ НА ЭЛЕКТРОДЕ, НАЗЫВАЕТСЯ
1) электролитический титрант
2) электрогенерированный кулонометрический титрант
3) кулоногенерированный титрант
4) титрант электродной генерации
17. ПРЯМАЯ КУЛОНОМЕТРИЯ ИСПОЛЬЗУЕТСЯ ДЛЯ ОПРЕДЕЛЕНИЯ
1) электрогенерируемых веществ
2) электронеактивных веществ
3) поляризуемых веществ
4) электроактивных веществ
18. ПРИЧИНОЙ ВОЗНИКНОВЕНИЯ КОНЦЕНТРАЦИОННОЙ ПОЛЯРИЗАЦИИ ЯВЛЯЕТСЯ
Лекция 6 Водородный электрод в качестве электрода сравнения
1) увеличение количества восстановленного вещества
2) обеднение поверхностного слоя электрода электроактивным веществом
3) уменьшение перенапряжения на электроде
4) высокая плотность тока
19. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ, СОСТАВЛЕННЫЙ ИЗ КАДМИЕВОГО КАТОДА, ПОГРУЖЁННОГО В РАСТВОР СОЛИ КАДМИЯ, И МЕДНОГО КАТОДА, ПОГРУЖЁННОГО В РАСТВОР СОЛИ МЕДИ – ЭТО

20. УРАВНЕНИЕ ЭЛЕКТРОХИМИЧЕСКОЙ ЯЧЕЙКИ – ЭТО
1) E ГЭ = E a — E k + IR
2) E ГЭ = E k — E a + IR
3) E ГЭ = E a + E k — IR
4) E ГЭ = E k — E a — IR
21. КАКАЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ СИСТЕМА ЯВЛЯЕТСЯ НЕОБРАТИМОЙ

22. ПРИ ПРОХОЖДЕНИИ ТОКА 0,8 А ЧЕРЕЗ РАСТВОР В ТЕЧЕНИИ 15,2 МИНУТ НА КАТОДЕ ВЫДЕЛИТСЯ

23. КОНДУКТОМЕТРИЯ ОСНОВАНА НА ИЗМЕРЕНИИ
2) удельного сопротивления
3) подвижности ионов
4) удельной электропроводности
24. В ПРОВОДНИКАХ ВТОРОГО РОДА ПЕРЕНОС ЭЛЕКТРИЧЕСТВА ОСУЩЕСТВЛЯЕТСЯ
1) движением электронов
2) движением ионов
3) движением атомов к катоду или аноду
4) движением свободных электронов, не участвующих в образовании связей
25. УМЕНЬШЕНИЕ ЭЛЕКТРИЧЕСКОЙ ПРОВОДИМОСТИ В КОНЦЕНТРИРОВАННЫХ РАСТВОРАХ ПРОИСХОДИТ ЗА СЧЁТ
1) увеличения сил межионного взаимодействия
2) образования пересыщенного раствора
3) увеличения давления на стенки сосуда
4) уменьшения скорости движения электронов
26. ПРОВОДИМОСТЬ РАСТВОРА, СОДЕРЖАЩЕГО 1 МОЛЬ ЭКВИВАЛЕНТА ВЕЩЕСТВА И НАХОДЯЩИМИСЯ МЕЖДУ ДВУМЯ ПАРАЛЛЕЛЬНЫМИ ЭЛЕКТРОДАМИ, РАССТОЯНИЕ МЕЖДУ КОТОРЫМИ 1 СМ, НАЗЫВАЕТСЯ
1) молярной проводимостью
2) удельной проводимостью
3) эквивалентной проводимостью
4) предельная проводимость
27. ТОРМОЖЕНИЕ ДВИЖЕНИЯ ИОНА ПОД ДЕЙСТВИЕМ ЭЛЕКТРИЧЕСКОГО ПОЛЯ НАЗЫВАЕТСЯ
1) релаксационным торможением
2) электростатическим торможением
3) компенсационным торможением
4) электрофоретическим торможением
28. СУЩЕСТВЕННО БОЛЬШЕЙ ПОДВИЖНОСТЬЮ ПО СРАВНЕНИЮ С БОЛЬШИНСТВОМ ИОНОВ ОБЛАДАЕТ ИОН

29. УДЕЛЬНАЯ ЭЛЕКТРОПРОВОДНОСТЬ СВЯЗАНА С ПОДВИЖНОСТЬЮ ПО СООТНОШЕНИЮ
30. ЕДИНИЦЕЙ ИЗМЕРЕНИЯ ЭЛЕКТРОПРОВОДНОСТИ ЯВЛЯЕТСЯ
31. ДЛЯ КОНДУКТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ ПРИГОДНЫ РЕАКЦИИ
1) окислительно-восстановительные и кислотно-основные
2) осадительные или косплексообразования
3) кислотно-основные или осадительные
4) комплексообразования или окислительно- восстановительные
32. В УРАВНЕНИИ R= p (d/A) p — ЭТО
1) удельное сопротивление
2) удельная электропроводность
3) плотность тока
4) эквивалентная электропроводность
4.1 Электрохимические методы анализа
Источник: www.sinref.ru
Мембранные электроды
Возникновение потенциала индикаторного электрода обусловлено ионообменными процессами на границе раздела электрод- раствор, потенциал металлического электрода определяется электроннообменными процессами на межфазной границе.
По определению ИЮПАК «ионоселективные электроды – это сенсоры (чувствительные элементы, датчики), потенциалы которых линейно зависят от lg а определяемого иона в растворе»
Важнейшей составной частью большинства этих электродов является полупроницаемая мембрана — тонкая пленка, отделяющая внутреннюю часть электрода (внутренний раствор) от анализируемого и обладающая способностью пропускать преимущественно ионы только одного вида.
Способность мембраны быть проницаемой для ионов определенного знака обусловлена наличием ионогенных групп. Если мембрана контактирует с двумя растворами А + с активностями а1 (анализируемый раствор) и а2 (внутренний раствор), то и на внешней и на внутренней сторонах мембраны происходит обмен ионами. Из- за различия активностей ионов А + в растворе и мембране на обеих сторонах мембраны возникают граничные потенциалы Е1 и Е2. С помощью электродов сравнения, помещенных во внешний и внутренний растворы, можно измерить разность Е1 и Е2 или так называемый мембранный потенциал Ем:
Активность ионов А + во внутреннем растворе постоянна, поэтому
Ем = const + 0,059 lg а1
потенциал мембранного электрода линейно зависит от логарифма активности иона А + в анализируемом растворе.
Любая мембрана в той или иной мере проницаема для всех ионов, находящихся в растворе, и поэтому необходимо учитывать влияние посторонних ионов, например В + , на потенциал электрода. Ионы В + проникают в фазу мембраны в результате реакции обмена
А + мембрана + В + раствор ↔ В + мембрана + А + раствор
Константа равновесия этой реакции (константа обмена, КА-В) зависит от природы мембраны и природы иона В + . Подвижности ионов А и В, и А и и В в фазе мембраны различны, поэтому возникает диффузионный потенциал, вносящий определенный вклад в величину Ем.
Потенциал мембранного электрода в растворе, содержащем кроме определяемого иона А посторонние ионы В,С и другие, зависит от потенциометрического коэффициента селективности, от значений потенциалов внешнего и внутреннего электродов сравнения,.зависит от природы мембраны
Потенциометрический коэффициент селективности отражает относительное влияние ионов А и В на величину мембранного потенциала и характеризует способность мембраны различать ионы А и В, А и С и т. д.
Основными характеристиками ионоселективного электрода являются электродная функция, селективность и время отклика. Электрод имеет нернстовскую электродную функцию в интервале активности (концентрации), где зависимость потенциала от рА (-lg аА) линейна и имеет угловой коэффициент 59,16 / zА мВ/рА (25 º С). Протяженность этого интервала зависит от природы мембраны. При очень низких концентрациях (для хороших электродов порядка 10 -6 М) электрод утрачивает электродную функцию, практически наступает предел обнаружения.
Существуют различные способы оценки величины k пот А,В. Чаще других используют метод смешанных растворов, основанный на измерении потенциала электрода в растворах с постоянной концентрацией мешающего иона В и переменной концентрацией определяемого иона А.
Время отклика (время установления стационарного потенциала) определяют по зависимости потенциала электрода от времени с момента погружения в анализируемый раствор. В зависимости от природы мембраны время отклика может колебаться от нескольких секунд до нескольких минут. Время достижения постоянного потенциала зависит от методики работы и изменяется от того, переносят ли электрод из более концентрированного раствора в более разбавленный или наоборот. У большинства электродов за 1мин потенциал достигает 90٪ от максимальной величины. Чем меньше время отклика, тем лучше, особенно при непрерывных измерениях в потоке или при автоматизированных измерениях.
Ионоселективные электроды. Согласно рекомендациям ИЮПАК, различают: первичные ионоселективные электроды – электроды с кристаллическими мембранами, электроды с жесткой матрицей (стеклянные); электроды с подвижными носителями – положительно заряженными, отрицательно заряженными, незаряженными (с «нейтральными переносчиками»); сенсибилизированные (активированные) электроды – газочувствительные, ферментные.
Электроды с кристаллическими мембранами. Кристаллические гомогенные мембраны изготовляют из индивидуального кристаллического соединения (Lа F3, Ag2 S) или гомогенной смеси кристаллических веществ (Ag2 S + АgCl, , Ag2 S + Сu S). При изготовлении гетерогенных кристаллических мембран электродно – активное вещество смешивают с инертной матрицей (силиконовая смола) или наносят на гидрофобизированный графит, электрическая проводимость этих мембран обусловлена способностью иона решетки с наименьшим радиусом и зарядом перемещаться по вакансиям решетки. Для кристаллических мембран характерна высокая специфичность, обусловленная тем, что размер, форма и распределение заряда вакансии решетки позволяют занять это место только определенному подвижному иону. Низкая растворимость материала мембраны (Lа F3, Ag2 S, Ag2 S + Сu S) позволяют достигать очень низких пределов обнаружения.
Превосходным электродно – активным кристаллическим веществом является сульфид серебра, обладающий малой растворимостью (КS ≈ 10 – 51 ), высокой устойчивостью к окислителям и восстановителям, низким электрическим сопротивлением. Мембрану можно изготовить из прессованного поликристаллического сульфида серебра или из пластинки монокристалла. Низкое электрическое сопротивление позволяет использовать сульфид серебра в качестве инертной токопроводящей матрицы при изготовлении электрода, селективного к ионам меди (на основе гомогенной смеси Сu S и , Ag2 S),свинца (на основе смеси , Ag2 S и Рb S) и других электродов.
Наиболее совершенным электродом с кристаллической мембраной является F – селективный электрод. Мембрана его выполнена из пластинки монокристалла фторида лантана, активированного для увеличения дефектов решетки (понижения электрического сопротивления) фторидом двухзарядного катиона (барий, европий).
В настоящее время электроды с кристаллическими мембранами делают и без внутреннего раствора, используя прямой контакт металлического проводника и мембраны. Такие электроды называют твердотельными (или электродами с твердым контактом), они удобнее в работе, чем электроды с внутренним раствором.
Электроды с жесткой матрицей. Стеклянные мембраны изготавливают и специальных стекол, подбирая их состав так, чтобы мембрана проявляла повышенную селективность к определенному иону и позволяла определять его в присутствии других. Первым ионоселективным электродом был стеклянный электрод для измерения рН.
В зависимости от целевого назначения электрод может иметь разную форму и размер (от крошечных стерженьков для введения в полость зуба или даже в отдельную клетку до шарика диаметром 10 – 15 мм для лабораторных аналитических работ). В любом случае главной частью электрода является тонкая рН- чувствительная мембрана.
Обычно ее изготавливают из стекла, содержащего 22٪ оксида натрия, 6٪ оксида кальция и 72٪ оксида кремния. Внутренним раствором служит 0,1 М раствор соляной кислоты, насыщенный хлоридом серебра. Чувствительностью к ионам водорода обладает только хорошо вымоченная мембрана.
При длительном выдерживании в воде на обеих сторонах мембраны образуется тонкий (приблизительно 10 -4 мм) слой гидратированного геля и все пустоты в трехмерной сетке из атомов Si и О, составляющей структуру стекла, на поверхности занимают ионы Н + ,вытесняя находившееся там ионы натрия. При движении внутрь мембраны уменьшается число пустот, занятых протонами, и увеличивается число пустот, занятых ионами натрия. Специальными измерениями с изотопами доказано, что ионы Н + через слой сухого стекла (около 10 -1 мм) не проходят. Внутри этого слоя ток переносится ионами натрия, способными перемещаться внутри пустот на расстояние, равное нескольким радиусам, и передавать энергию соседним ионам натрия.
Потенциал хорошо вымоченного стеклянного электрода описывается уравнением
Е = const + 0,059 lg аН + ,
т. е. электрод обладает водородной функцией.
Стеклянный электрод пригоден для правильного измерения рН в ограниченном интервале рН, зависящем от состава стекла. Предполагается, что неправильные результаты в сильнокислых растворах обусловлены разрушением стекла. Погрешность измерения рН в щелочных растворах указывает на то. что электрод реагирует не только на ионы Н + но и на ионы К + и других щелочных металлов.
Электроды на основе мембран с подвижными носителями имеют жидкие мембраны – раствор ионообменника или «нейтрального переносчика» в органическом растворителе, удерживаемый на пористом полимере. Органический растворитель влияет на свойства электрода. Так, если для растворения кальциевой соли эфира фосфорной кислоты используют диоктилфенилфосфонат, то электрод пригоден для определения ионов кальция в присутствии 100 – кратного количества магния. Но если растворителем является деканол – 1, то электрод не способен различить кальций и магний; его можно, однако, использовать для определения жесткости воды.
Современные конструкции подобных электродов выполняют на основе пластифицированных мембран. Одним из лучших электродов такого типа является К – селективный электрод с мембраной на основе «нейтрального переносчика» валиномицина, пригодный для определения калия в присутствии 10 4 – кратного количества натрия. Столь высокая селективность обусловлена удивительным соответствием размера внутренней полости циклической молекулы валиномицина (2,7 – 3,3 Å) диаметру иона калия (приблизительно 2,7 Å). Поэтому в отличие от маленьких ионов натрия или лития калий прочно удерживается в полости за счет ион – дипольных взаимодействий с кислородом валиномицина.
Сенсибилизированные (активированные электроды). Газочувствительные электроды – это датчики, объединяющие индикаторный электрод и электрод сравнения и имеющие газопроницаемую мембрану или воздушный зазор для отделения анализируемого раствора от тонкой пленки промежуточного раствора электролита. Он взаимодействует с определяемым газом, при этом изменяется какой — то параметр промежуточного раствора, например рН, что и фиксирует ионоселективный электрод. Отклик ионоселективного электрода пропорционален парциальному давлению определяемого компонента в анализируемом газе.
Ферментные электроды – это датчики, в которых ионоселективный электрод покрыт пленкой, содержащей фермент, способный вызывать реакцию органического или неорганического вещества (субстрата) с образованием веществ (ионов, молекул), на которые реагирует электрод. В основе работы электрода лежит ферментативная реакция
Определяемое вещество (субстрат)® Ион (молекула)
в результате которой образуется частица, обусловливающая отклик электрода. Поэтому за изменением ее концентрации можно проследить с помощью ионоселективного электрода. Селективность ферментных электродов очень высока, поскольку каждый фермент катализирует какую-то определенную реакцию.
Металлические электроды. Различают активные и инертные металлические электроды. Активные металлические электроды изготавливают из металлов, образующих восстановленную форму обратимой окислительно — восстановительной системы (Аg, Pb, Сu, Cd). Потенциал такого электрода является функцией активности собственных ионов в растворе, например для серебряного индикаторного электрода (Ag + + е ↔ Ag)
Такие электроды называют электродами l рода.
В присутствии анионов, образующих с ионами серебра малорастворимое соединение (AgCI, AgBr и др.), потенциал электрода зависит от активности иона. Например, в растворе, содержащем хлорид- ионы, потенциал серебряного электрода зависит от активности хлорид- ионов.
Его можно применить для определения хлорид-иона.Такие электроды называют электродами ll рода.
Потенциалы электродов ll рода при достаточно большой площади поверхности и постоянной концентрации аниона хорошо воспроизводятся, поэтому их основное назначение – служить электродами сравнения (хлорсеребряный и каломельный электроды сравнения).
Инертные металлические электроды изготавливают из благородных металлов
(Рt, Au).Они служат переносчиками электронов от восстановленной формы к окисленной, их потенциалы являются функцией соотношения активностей окисленной и восстановленной форм полуреакции. Эти электроды применяют в потенциометрическом
Воспользуйтесь поиском по сайту:

studopedia.org — Студопедия.Орг — 2014-2023 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.012 с) .
Источник: studopedia.org
В растворе содержащем хлорид ионы серебряный электрод является электродом
На практике в качестве электродов сравнения обычно используют другие электроды – например, каломельный или хлорсеребряный электроды. Их электродные потенциалы Е(В)постоянны и точно известны. Поэтому при необходимости из величины потенциала ЕВ, измеренной относительно электрода сравнения, можно всегда рассчитать соответствующую величину потенциала (Е) относительно стандартного водородного электрода как E = EB + E ( B ).
Электроды, на которых протекают окислительно-восстановительные процессы, называют металлическими. В зависимости от природы частиц – переносчиков заряда они подразделяются на инертные и активные. Активные электроды делятся на электроды 1-ого и 2-ого рода.
Инертным называется электрод, роль которого сводится к переносу электронов между частицами, находящимися в растворе. Таким электродом может служить платиновая проволока, погруженная в раствор соответствующего состава, например, содержащего ионы Fe + , Fe 3+ . В этом случае суммарная электродная реакция состоит из процессов переноса электронов из металла в раствор и последующего переноса электрона в растворе. Подобный электрод в принципе возможно себе представить применительно и к другим окислительно-восстановительным системам: Sn 4+ /Sn 2+ , Pb 4+ /Pb 2+ , 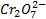 /Cr 3+ , MnO2, H + /Mn 2+ (две последние системы являются
/Cr 3+ , MnO2, H + /Mn 2+ (две последние системы являются 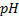 -зависимми).
-зависимми).
Роль активных электродов – перенос через границу раздела фаз. Такие электроды, состоящие из металла, погруженного в раствор собственных ионов, называются электродами первого рода.
Электроды второго рода – это системы, в которых происходит перенос не собственных катионов материала электрода, а анионов, образующих с ионами металла малорастворимые или устойчивые комплексы. К электродам второго рода, в основе действия которых лежит образование малорастворимого соединения, относятся хлорсеребряный и каломельный электроды. Они имеют большое практическое значение, поскольку повсеместно используются в качестве электродов сравнения.
В общем виде схему этого типа электродов можно представить следующим образом M|MX|X n — , где МХ – малорастворимая соль. Для электрода серебро-хлорид серебра (хлорсеребряного) Ag|AgCl(тв.) |Cl — . . Вертикальной линией обозначают границу раздела двух разных твердых фаз или твердой фазы раствора. Для соответствующей полуреакции

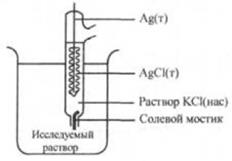
AgCl+e — ⇄+Ag+ Cl — потенциал описывается уравнением
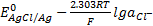
E= . (*)
Этот электрод пригоден для измерения активности хлорид-ионов в растворе. С увеличением активности хлорид-ионов потенциал уменьшается. Это справедливо для любого электрода, пригодного для определения анионов. Серебряная проволока покрыта осадком AgCl (его получают, например, при электролитическом окислении серебра в растворе, содержащем хлорид-ионы, в соответствии с уравнением обратимой реакции AgCl+ e — ⇄+Ag+ Cl — ). Но т. к серебряная проволока при погружении в раствор, содержащий хлорид-ионы, моментально покрывается тонким слоем AgCl, предварительной подготовки электрода обычно не требуется.
Электрод обычно применяют для измерения 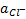 , но он пригоден и для измерения
, но он пригоден и для измерения 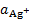 , которая определяется растворимостью малорастворимой соли. Т. к.
, которая определяется растворимостью малорастворимой соли. Т. к. 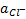 =
= 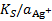 , уравнение (*) можно преобразовать следующим образом:
, уравнение (*) можно преобразовать следующим образом:
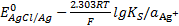
E= ,
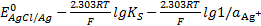
E= .
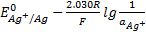
Сравнив полученное выражение с уравнением E = , видим, что
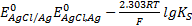
.(*)
Фактически здесь под 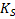 . Следует понимать термодинамическое произведение растворимости
. Следует понимать термодинамическое произведение растворимости 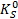 , поскольку при выводе уравнения использованы активности. Если в этом уравнении заменить
, поскольку при выводе уравнения использованы активности. Если в этом уравнении заменить 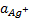 на
на 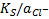 , можно получить другую форму уравнения (**).
, можно получить другую форму уравнения (**).
В растворе, содержащем смесь 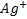 и
и 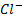 , например при титровании
, например при титровании 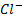 с помощью
с помощью 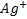 , их концентрации при равновесии таковы, что потенциал серебряного электрода, погруженного в этот раствор, можно, можно рассчитать по уравнению (*) и по уравнению (**). Это полностью согласуется с утверждением, что при равновесии потенциалы обеих полуреакцй равны. В данном случае полуреакции представлены Ag + +e — ⇄Ag и AgCl+e — ⇄+Ag+ Cl — , и результатом вычитания одной из них из другой будет суммарная химическая реакция: Ag + + Cl — ⇄ AgCl.
, их концентрации при равновесии таковы, что потенциал серебряного электрода, погруженного в этот раствор, можно, можно рассчитать по уравнению (*) и по уравнению (**). Это полностью согласуется с утверждением, что при равновесии потенциалы обеих полуреакцй равны. В данном случае полуреакции представлены Ag + +e — ⇄Ag и AgCl+e — ⇄+Ag+ Cl — , и результатом вычитания одной из них из другой будет суммарная химическая реакция: Ag + + Cl — ⇄ AgCl.
При титровании 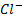 раствором
раствором 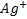 концентрация хлорид-ионов уменьшается, а ионов серебра – увеличивается. Из уравнения (*) видно, что потенциал увеличивается по мере уменьшения концентрации
концентрация хлорид-ионов уменьшается, а ионов серебра – увеличивается. Из уравнения (*) видно, что потенциал увеличивается по мере уменьшения концентрации 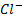 , п из уравнения E =
, п из уравнения E = 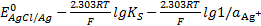 следует, что потенциал увеличивается с повышением концентрации
следует, что потенциал увеличивается с повышением концентрации 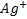 .
.
Серебряный электрод можно использовать для определения и других анионов, образующих с ионами 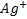 малорастворимые соединения, например,
малорастворимые соединения, например, 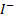 ,
, 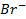 и
и 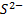 . Величина Е 0 вкаждом конкретном случае определяется полуреакцией Ag Х+e — ⇄+Ag+
. Величина Е 0 вкаждом конкретном случае определяется полуреакцией Ag Х+e — ⇄+Ag+ 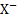 .
.

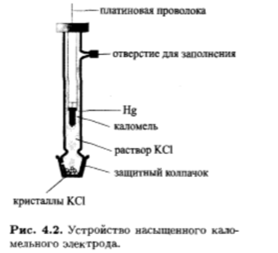
Для вывода уравнения, описывающего равновесный потенциал каломельного электрода, необходимо принять во внимание как собственно потенциалопределяющую стадию, так и равновесие осадок-раствор с участием Hg2Cl2.
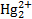
Поскольку в потенциалопределяющей стадии участвуют ионы , то
E=E 0 ( 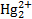 / Hg)+
/ Hg)+ 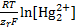 (1.1)
(1.1)
Для равновесия осадок-раствор Hg2Cl2⇄2 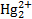 +2
+2 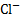 , произведение растворимости равно
, произведение растворимости равно
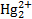
KL =[ ][ Cl — ] 2 =10 -17.96 =1.10*10 -18 .
Выразив концентрацию из последнего уравнения и подставив ее в уравнение (1.1), получим уравнение Нерста в виде E=E 0 ( 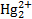 / Hg)+
/ Hg)+ 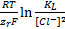 .
.
Таим образом, потенциал каломельного электрода зависит от концентрации хлорид-ионов.
4.Изобразите схематично ячейку, состоящую из насыщенного каломельного электрода (катод) и водородного электрода (анод), позволяющую измерять pH раствора.
Едва ли не самое известное применение прямой потенциометрии состоит в измерении рН при помощи стеклянного электрода. Стеклянный электрод состоит из корпуса, в который налит буферный раствор. В этот раствор погружен внутренний электрод сравнения- чаще всего хлоридсеребряный .
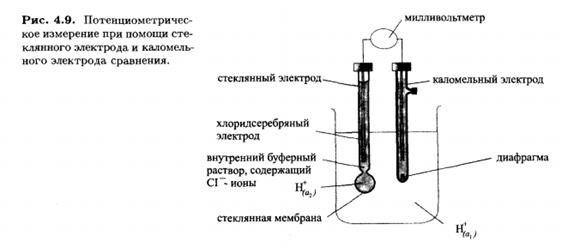
Нижняя шарообразная часть корпуса сделана из очень тонкого стекла и обычно называется стеклянной мембраной. Однако это не мембрана в обычном смысле слова, поскольку она непроницаема для компонентов раствора.
При контакте с раствором приповерхностный слой стекла выступает в роли ионообменника, обменивая катионы, находящиеся в пустотах силикатного каркаса, на ионы 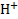 .Для того, чтобы мембрана электрода приобрела способность к такому обмену, ее следует предварительно вымочить в кислом растворе. Равновесное значение потенциала стеклянного электрода зависит от активностей ионов
.Для того, чтобы мембрана электрода приобрела способность к такому обмену, ее следует предварительно вымочить в кислом растворе. Равновесное значение потенциала стеклянного электрода зависит от активностей ионов 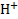 в анализируемом растворе (
в анализируемом растворе ( 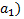 и внутреннем растворе электрода (
и внутреннем растворе электрода ( 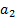 ). В первом приближении эта зависимость имеет вид
). В первом приближении эта зависимость имеет вид
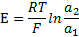
Поскольку активность ионов 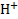 во внутреннем растворе (
во внутреннем растворе ( 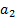 ) постоянна, то
) постоянна, то
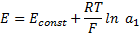

Величина Econst зависит от значения рН внутреннего раствора, а также от потенциала асимметрии стеклянной мембраны. На практике угол наклона градуиравочной зависимости может отличаться от теоретического значения. В этих случаях в уравнение вводят эмпирическую поправку k-коэффициент крутизны.
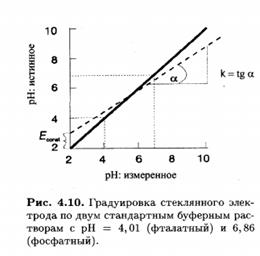
Стеклянные электроды позволяют с высокой точностью измерять значения рН от 1 до 10. На краях этого диапазона рН наклон градуировочной зависимости несколько ниже теоретического. При рН < 1 возникает кислотная погрешность, величина которой зависит от сорта стекла, использованного для изготовления мембраны. При рН >10 электрод становится чувствительным к ионам щелочных металлов, вследствие чего возникает щелочная погрешность . Существуют сорта стекла (в частности, на основе Li2 0-Ba0-La20 3-Si02 ), для которых рабочий диапазон рН более широкий как в кислой, так и в щелочной области. С другой стороны, чувствительность стеклянной мембраны к ионам натрия и калия можно использовать для создания специальных сортов стекол и разработке на их основе электродов для определения этих ионов.
(Поскольку 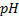 =- lg
=- lg 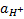 , а уравнение (1) можно представить в виде
, а уравнение (1) можно представить в виде
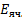 =k-
=k- 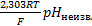 (3),
(3),
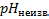 =
= 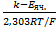 ( 4).
( 4).
Видно, что отклик стеклянного электрода при измерении 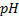 на 1 единицу (или на 10-кратное изменение
на 1 единицу (или на 10-кратное изменение 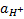 ) составляет
) составляет 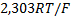 .величину
.величину 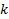 можно оценить при градуировке электрода по стандартным буферным смесям с известным
можно оценить при градуировке электрода по стандартным буферным смесям с известным 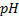 .
.
k= 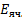 +
+ 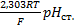 (5)
(5)
При подстановке уравнения (5) и (3) получаем
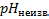 =
= 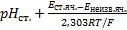
При вычислении 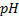 подобные вычисления не производят, поскольку шкалу -метра калибруют в единицах
подобные вычисления не производят, поскольку шкалу -метра калибруют в единицах 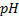 . Поскольку для измерения
. Поскольку для измерения 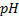 применяют мембранный электрод с очень высоким сопротивлением (1-100МОм), очень важно свести к минимуму падение напряжения i / R Для этого используют
применяют мембранный электрод с очень высоким сопротивлением (1-100МОм), очень важно свести к минимуму падение напряжения i / R Для этого используют 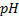 -метр, способный работать при протекании очень слабых токов.
-метр, способный работать при протекании очень слабых токов.
Дата: 2019-11-01, просмотров: 694.
Источник: findout.su