1 (2 балла). Общая формула предельных одноатомных спиртов:
А.СnН2n+1ОН. Б.СnН2n-2(ОН)2. В.СnН2n-1ОН. Г.СnН2nО2.
2 (2 балла). Название вещества, формула которого
А. Бутаналь. Б. Бутанол-2. В. Бутанол-3. Г. 3-Метилпропанол-1.
3 (2 балла). Вид изомерии, характерный для предельных одноатомных спиртов:
A. Зеркальная. Б. Положения кратной связи.
B. Пространственная (стереоизомерия). Г. Межклассовая.
4 (2 балла). (2 балла). Продуктами окисления первичных одноатомных спиртов являются:
А. Альдегиды. Б. Кетоны. В. Простые эфиры. Г. Сложные эфиры.
5 (2 балла). В цепочке превращений
СН2=СН—СН3——> X——► СН3—СНОН—СН3
веществом X является:
А. 1-Хлорпропан. Б. 2-Хлорпропан. В. 1,2-Дихлорпропан. Г. Пропан.
6 (2 балла). Формула вещества с наиболее ярко выраженными кислотными свойствами:
А. СН3ОН. Б. С2Н5ОН. В. С3Н7ОН. Г. С6Н5ОН.
7 (2 балла). Этанол не вступает в реакцию с веществом, формула которого:
36. Фенолы (часть 2)
A. Na. Б. НВг. В. NaOH. Г. СН3СООН.
8 (2 балла). Реактивом для распознавания этиленгликоля является:
А. Бромная вода. В. Гидроксид меди (II).
Б. Оксид меди (II). Г. Хлорид железа (III).
9 (2 балла). Вещество, из которого с помощью реакции нитрования А. Нобель изготовил динамит:
А. Глицерин. Б. Глицин. В. Фенол. Г. Этанол.
10 (2 балла). «Древесный спирт», впервые полученный путем сухой перегонки древесины, — это:
А. Бутанол. В. Пропанол.
Б. Метанол. Г. Этанол.
11 (2 балла). Число σ-связей в молекуле метаналя:
А. 2. Б. 3. В. 4. Г. 5.
12. (2 балла). Общая формула альдегидов:
^ A. RCOH. Б. RCOOH. В. R1OR2. Г. R1OOR2.
ЧАСТЬ Б. Задания со свободным ответом
13 (8 баллов). Составьте уравнения реакций по приведенной ниже схеме и укажите условия их осуществления:
метан—-► ацетилен—-> бензол —-> хлорбензол—-► фенол.
14 (6 баллов). Для 2-метилбутанола-1 составьте структурные формулы одного изомера и одного гомолога. Назовите все вещества.
15 (4 балла). С какими из перечисленных веществ: гидроксид натрия, бромная вода, бензол — будет реагировать фенол? Составьте уравнения возможных реакций и назовите органические вещества.
16 (3 балла). Напишите уравнение качественной реакции на альдегиды. Укажите признак этой реакции.
17 (5 баллов). Рассчитайте объем водорода (н. у.), полученного при взаимодействии 1,5 моль метанола с металлическим натрием, взятом в достаточном количестве.
^ Спирты и фенолы. Альдегиды и кетоны.
Вариант 2 ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Многоатомным спиртом является:
А. Бутанол-2. Б. Глицерин В. Фенол. Г. Этанол.
2 (2 балла). Название вещества, формула которого
А. 2-Метилбутанол-З. В. З-Метилбутанол-2. Б. Пентанол-2. Г. Метилбутанол.
3 (2 балла). Вид гибридизации электронных орбиталей атома углерода, отмеченного звездочкой в веществе, формула которого СН3—С*Н2ОН:
Реакция на альдегиды с фуксинсернистой кислотой
A. sp3. Б. sp2. В. sp. Г. Не гибридизирован.
4 (2 балла). Продуктом реакции гидратации углеводорода, формула которого
A. 3-Метилпентанол-1. Б. 3-Метилпентанол-2. B. 3-Метилпентанол-3.
5 (2 балла). В цепочке превращений
веществом X является: А. Хлорэтан. Б. 1,1-Дихлорэтан. В. 2,2-Дихлорэтан. Г. Этаналь.
6 (2 балла). Продуктами восстановления альдегидов водородом (катализатор Pt) являются:
A. Кетоны. Б. Сложные эфиры. B. Карбоновые кислоты. Г. Одноатомные спирты.
7 (2 балла). Метанол взаимодействует с веществом, формула которого:
A. Zn. Б. НВr. В. КОН. Г. Вr2(водн).
8 (2 балла). В реакцию «серебряного зеркала» могут вступать:
А. Альдегиды. Б. Фенолы. В. Кетоны. Г. Одноатомные спирты.
9 (2 балла). Вещество, применяемое для производства антифризов:
А. Глицерин. Б. Метанол. В. Этанол. Г. Этиленгликоль.
10 (2 балла). Пикриновую кислоту (тринитрофенол) можно получить путем взаимодействия фенола с веществом, формула которого:
А. Br2(водн.) B.HNO3. В. KMnO4(p.p). Г.NaOH.
11. (2 балла). Растворитель ацетон относят к классу органических веществ:
А. Альдегиды. Б. Кетоны. В. Сложные эфиры. Г. Спирты.
12. (2 балла). Межклассовыми изомерами являются:
A. Многоатомные спирты и фенолы. Б. Одноатомные спирты и фенолы.
B. Одноатомные спирты и простые эфиры. Г. Карбоновые кислоты и альдегиды.
ЧАСТЬ Б. Задания со свободным ответом
13 (8 баллов). Составьте уравнения реакций по приведенной ниже схеме и укажите условия их осуществления:
этилен—-> хлорэтан—-► бутан—-> 2-хлорбутан—-► бутанол-2.
14. (6 баллов). Составьте структурные формулы одного изомера и одного гомолога для бутаналя. Назовите все вещества.
15. (3 балла). Напишите уравнение качественной реакции для предельных одноатомных спиртов, укажите признак этой реакции.
16 (5 баллов). Рассчитайте массу фенолята натрия, полученного при взаимодействии 0,5 моль фенола с достаточным количеством раствора гидроксида натрия.
17 (4 балла). С какими из перечисленных веществ: гидроксид натрия, бромоводород, кислород — будет реагировать метанол? Составьте уравнения возможных реакций и назовите органические вещества.
^ Спирты и фенолы. Альдегиды и кетоны.
Вариант 3 ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Формула вещества, относящегося к классу предельных многоатомных спиртов:
А. С6Н4(ОН)2. Б. С6Н5ОН. В. С6Н5СН2ОН. Г. С2Н4(ОН)2.
2 (2 балла). Название вещества, формула которого
А. Пентанол-2. Б. 1-Метилбутанол-3. В. Метилбутанол. Г. 4-Метилбутанол-2.
3 (2 балла). Вид изомерии, характерный для предельных многоатомных спиртов:
A. Положения функциональной группы. Б. Положения кратной связи.
B. Пространственная (стереоизомерия). Г. Межклассовая.
4 (2 балла). Вид гибридизации электронных орбита-лей атома углерода, отмеченного звездочкой в веществе, формула которого СН3—С*ОН:
A. sp3. Б. sp2. В. sp. Г. Не гибридизирован.
5 (2 балла). В цепочке превращений
веществом X является:
А. Этаналь. Б. Этановая кислота. В. Этен. Г. Этин.
6 (2 балла). С металлическим натрием наиболее активно реагирует:
А. Метанол. Б. Этанол. В. Пропанол-1. Г. Бутанол-1.
7 (2 балла). Фенол не вступает в реакцию с веществом, формула которого:
A.Na. Б.С3Н8. B.NaOH. Г. Вr2(водн. раствор)
8 (2 балла). Реактивом для распознавания глицерина является:
А. Бромная вода. Б. Гидроксид меди (II). В. Оксид меди (II). Г. Хлорид железа (III).
9 (2 балла). Вещество, которое впервые применили в качестве антисептика при хирургических операциях:
А. Глицерин. Б. Метанол. В. Фенол. Г. Этанол.
10 (2 балла). Пищевой этиловый спирт получают:
A. Брожением глюкозы. Б. Гидратацией этилена.
B. Гидролизом бромэтана. Г. Гидролизом целлюлозы.
11. (2 балла). Число σ-связей в молекуле метанола:
А. 3. Б. 4. В. 5. Г. 6.
12. (2 балла). Продуктами окисления вторичных одноатомных спиртов являются:
А. Альдегиды. Б. Кетоны. В. Простые эфиры. Г. Сложные эфиры.
ЧАСТЬ Б. Задания со свободным ответом
13 (8 баллов). Составьте уравнения реакций по приведенной ниже схеме и укажите условия их осуществления:
этан—-> этен—-> этанол—-> бромэтан—-► бутан.
14 (6 баллов). Составьте структурные формулы одного изомера и одного гомолога для 2-метилпропаналя. Назовите все вещества.
15 (4 балла). С какими из перечисленных веществ: оксид меди (II), натрий, гидроксид натрия — будет реагировать этанол? Составьте уравнения возможных реакций и назовите органические вещества.
16. (5 баллов). Рассчитайте объем углекислого газа (н. у.), полученного при сгорании 160 г метанола.
17. (3 балла). Напишите уравнение качественной реакции на многоатомные спирты, укажите признак этой реакции.
Вариант 4 ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Формула вещества, относящегося к классу фенолов:
А. С6Н5-СН3. В. С6Н4(ОН)2.
Б. С6Н5—СН2—СН2—ОН. Г. С6НПОН.
2 (2 балла). Название вещества, формула которого
A. 1,3-Диметилбутанол-2. Б. 2,4-Диметилбутанол-З.
B. 4-Метилпентанол-З. Г. 2-Метилпентанол-З.
3 (2 балла). Вид изомерии, характерный для предельных одноатомных спиртов:
А. Положения функциональной группы. Б. Положения кратной связи.
38В. Пространственная (стереоизомерия). Г. Зеркальная.
4 (2 балла). Продуктом реакции гидратации углеводорода, формула которого
А. 2-Метилбутан. В. 2-Метилбутанол-З.
Б. 2-Метилбутанол-2. Г. З-Метилбутанол-2.
5 (2 балла). В цепочке превращений
с6нв —> х —> с6н5он
веществом X является:
А. Хлорбензол. В. Гексан.
Б. Циклогексан. Г. Гексахлорциклогексан.
6 (2 балла). Вещество с наиболее ярко выраженными кислотными свойствами:
А. Вода. Б. Метанол. В. Пропанол-1. Г. Этанол.
7 (2 балла). Этиленгликоль не взаимодействует с веществом, формула которого:
A. Na. Б. Cu(OH)2. В. HNO3. Г. FeCl3.
8 (2 балла). Реактивом для распознавания предельных одноатомных спиртов является:
А. Бромная вода. В. Оксид меди (II). .
Б. Гидроксид меди (II). Г. Хлорид железа (III).
9 (2 балла). Вещество, выполняющее роль увлажнителя в косметических кремах:
А. Глицерин. В. Этанол.
Б. Фенол. Г. Этиленгликоль.
10 (2 балла). Из чего Ф. Рунге впервые получил фенол? А. Из бензола. В. Из нефти.
Б. Из каменного угля. Г. Из природного газа.
ЧАСТЬ Б. Задания со свободным ответом
11 (8 баллов). Составьте уравнения реакций по приведенной ниже схеме и укажите условия их осуществления:
ацетилен—-> бензол—-> бромбензол—->
—-► фенол—-► пикриновая кислота.
3912 (6 баллов). Для бутадиола-1,2 составьте структурные формулы одного изомера и одного гомолога. Назовите все вещества.
13 (4 балла). С какими из перечисленных веществ: азотная кислота, натрий, бромная вода — будет реагировать глицерин? Составьте уравнения возможных реакций и назовите органические вещества.
14 (6 баллов). Напишите уравнения реакций получения фенола из бензола, укажите условия их осуществления.
15 (6 баллов). Рассчитайте массу гидроксида натрия, необходимого для нейтрализации 0,25 моль фенола.
Вариант 1 ЧАСТЬ А. Тестовые задания с выбором ответа
12 (12 баллов). Напишите уравнения химических реакций по схеме, определив неизвестные вещества:
г w пн +Cu0’S v +Ag2v+ CH3OH,H2SO4 L^xlgUrl r Л.^ т л_2* -^3*
Укажите тип реакций, дайте названия исходных веществ и продуктов реакций.
13 (6 баллов). Составьте схему получения уксусного альдегида из метана, над стрелками переходов
41укажите условия осуществления реакций и формулы необходимых для этого веществ.
Вариант 2 ЧАСТЬ А. Тестовые задания с выбором ответа
9 (2 балла). Формула вещества X в цепочке превращений
A. СН2ОН—СН2—СН3. Б. СН3—СНОН—СН3.
B. СН3—СНС1—СН3. Г. СН2С1—СН2—СН3.
ЧАСТЬ Б. Задания со свободным ответом
11 (5 баллов). При полном сгорании 2 моль неизвестного альдегида получено 2 моль углекислого газа и 2 моль воды. Определите формулу альдегида. Ответ подтвердите, написав уравнение реакции.
12 (12 баллов). Напишите уравнения химических реакций по схеме, определив неизвестные вещества:
+ Н2О, Hg*» + Н2, Ni, Pt + H2SO4>t < 140 °C
Укажите тип реакций, дайте названия исходных веществ и продуктов реакций.
Вариант 3 ЧАСТЬ А. Тестовые задания с выбором ответа
4 (2 балла). 5 (2 балла). Сложный эфир можно получить реакцией:
А. Галогенирования. В. Нитрования. Б. Гидрирования. Г. Этерификации.
7 (2 балла). Кислотные свойства наиболее ярко выражены у вещества, формула которого:
^ А. НСООН. В. С3Н7СООН.
Б. С2Н5ОН. Г. С4Н9ОН.
9 (2 балла). Формула вещества X в цепочке превращений
10 (2 балла). Для хранения влажных биологических препаратов используют водный раствор:
A. Муравьиной кислоты. Б. Формальдегида.
B. Уксусной кислоты. Г. Этанола.
ЧАСТЬ Б. Задания со свободным ответом
12 (12 баллов). Напишите уравнения химических реакций по схеме, определив неизвестные вещества:
CH3coONa ±ЗЗЬ» Xj+с2н5он.Нг8о4) Хг+н2о.каон Хз
Укажите тип реакций, дайте названия исходных веществ и продуктов реакций.
13 (6 баллов). Составьте схему получения этанола из этана, над стрелками переходов укажите условия осуществления реакций и формулы необходимых для этого веществ.
Вариант 4 ЧАСТЬ А. Тестовые задания с выбором ответа
1 (2 балла). Общая формула кетонов: A. RCOH. В. R^ORg.
Б. RCOOH. Г. R^OORg.
4 (2 балла). Вещество, в молекуле которого имеется л-связь:
А. Метанол. В. Этанол.
Б. Этаналь. Г. Этандиол-1,2.
6 (2 балла). Продуктами взаимодействия спиртов с карбоновыми кислотами являются:
А. Кетоны. В. Сложные эфиры.
Б. Простые эфиры. Г. Фенолы.
8 (2 балла). В реакцию этерификации могут вступать:
А. Альдегиды. В. Кетоны.
Б. Сложные эфиры. Г. Карбоновые кислоты.
9 (2 балла). Формула вещества X в цепочке превращений
CHgCOOC2Hg ^ X ^ С2Н^: А. СО2. В. С2Н5ОН.
Б. Н2О. Г. СН3СООН.
ЧАСТЬ Б. Задания со свободным ответом
11 (5 баллов). При полном сгорании 1 моль предельного одноатомного спирта получено 44,8 л (н. у.) углекислого газа и 54 г воды. Определите формулу спирта.
12 (12 баллов). Напишите уравнения химических реакций по схеме, определив неизвестные вещества:
CH2Br-CH2-CH3 ±^H>Xl^^X2 ^^->Х3.
Укажите тип реакций, дайте названия исходных веществ и продуктов реакций.
Источник: ronl.org
Качественные реакции в органической химии

Алкены Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакция Вагнера) C C π Реакция присоединения, окисления Br 2 KMnO 4 Обесцвечивание CH 2 =CH 2 +[O]+H 2 O HO-CH 2 -CH 2 -OH KMnO 4 этилен этиленгликоль(этандиол) 3 CH 2 =CH 2 +2KMnO 4 +4H 2 O 3HO-CH 2 -CH 2 -OH+2KOH+2MnO 2 Полное уравнение реакции В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO 4 . Поэтому она используется как качественная реакция на алкены.
Алкены Также алкены взаимодействуют с бромной водой: CH 3 -CH=CH-CH 3 +Br 2 CH 3 -CH-CH-CH 3 Br Br 2-бутен 2,3-дибромбутан
Алкины Неполное окисление. При действии сильных окислителей (KMnO 4 ) алкины окисляются с разрывом молекулы по тройной связи (кроме ацетилена). Конечным продуктом реакции являются карбоновые кислоты. Реакция присоединения, окисления Br 2 KMnO 4 Обесцвечивание C C π π KMnO 4 CH 3 -C C-CH 3 +3[O]+H 2 O 2CH 3 -C O OH Этановая кислота Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов R-C C-R’ R-CBr=CBr-R’ R-CBr 2 -CBr 2 -R’ Br 2 Br 2
Многоатомные спирты В отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов. Нерастворимый в воде Cu(OH) 2 голубого цвета растворяется в глицерине с образованием ярко-синего раствора глицерата меди (II). — C — O | H — C — OH Реакция замещения, комплексобразования Cu(OH) 2 Ярко-синий раствор + HO -Cu- OH + CH 2 -O H CH — OH CH 2 -O H H O-CH HO- CH 2 HO- CH 2 CH 2 -O H CH -O CH 2 -O Cu +2H 2 O H O-CH 2 O-CH H O-CH 2 H
Фенолы Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола H H H OH Реакция замещения Br 2 Обесцвечивание Белый осадок Реакция замещения, комплексообразования FeCl 3 Фиолетовый раствор O H OH +3Br 2 OH Br Br Br +3HBr
Фенолы В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа( III ) с образованием комплексного соединения. Другие фенолы, содержащие несколько гидроксильных групп в бензольном кольце, дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа ( III )
Альдегиды реакция «серебряного зеркала» — окисление аммиачным раствором оксида серебра : R — C O H Окисление-восстановление [Ag(NH 3 ) 2 ]OH Серебряное зеркало окисление гидроксидом меди (II) с образованием красно-кирпичного осадка Cu 2 O: Cu(OH) 2 Красный осадок R–CH=O + 2Cu(OH) 2 RCOOH + Cu 2 O + 2H 2 O t R–CH=O + 2[Ag(NH 3 ) 2 ]OH RCOOH + 2Ag + 4NH 3 + H 2 O t
Кетоны Реакция присоединения Желтый осадок CH 3 — C — R O HIO
Сахариды Глюкоза дает качественную реакцию многоатомных спиртов — со свежеполученным гидроксидом меди ( II ), образуя ярко-синий раствор соединения меди(II) Глюкоза как альдегид способна окисляться в соответствующую кислоту и давать качественные реакции альдегидов
Карбоновые кислоты При взаимодействии карбоновых кислот с карбонатом натрия выделяется углекислый газ R — C O O H Реакция замещения Na 2 CO 3 Выделение CO 2 2R-C O OH +Na 2 CO 3 2R-C O ONa + CO 2 +H 2 O
1. Бесцветный газ А, немного легче воздуха, почти не имеющий запаха, при окислении кислородом в присутствии хлоридов палладия и меди превращается в соединение В. Взаимодействуя с гидроксидом меди (II), это соединение окисляется до вещества С, водный раствор которого имеет кислую реакцию. Приведите формулы веществ А, В и С. Напишите уравнения реакций. CH 2 =CH 2 A CH 3 -C O OH C CH 2 =CH 2 + O 2 CH 3 CHO PdCl 2 B CH 3 -C O H CH 3 -C O H CH 3 -C O OH + 2Cu(OH) 2 + Cu 3 O + 2H 2 O
2. Вещество А вступает в реакцию «серебряного зеркала». Окислением А получают соединение В, которое вступает в реакцию с метанолом в присутствии концентрированной серной кислоты; при этом образуется С вещество, обладающее приятным запахом. При сгорании вещества С образуется углекислого газа в 1,5 раза больше, чем при сгорании вещества В. Приведите формулы веществ А, В и С. Напишите уравнения реакций. A CH 3 -C O H B CH 3 -C O OH C CH 3 -C O OCH 3 CH 3 -C O H +2O 2 2 CO 2 + 2H 2 O CH 3 -C O OCH 3 +3,5O 2 3 CO 2 + 3H 2 O 1.5*2=3 (моль)
3. Соединение неизвестного строения состава C 4 H 8 Cl 2 нагрели с водным раствором гидроксида натрия и получили органическое соединение, которое при окислении гидроксидом меди ( II ) превратилось в соединение состава C 4 H 8 O 2 . Определить строение исходного соединения. CH 3 -CH 2 -CH 2 -C-H Cl Cl +2NaOH CH 3 -CH 2 -CH 2 -C-H H O +2NaCl+H 2 O 1,1-дихлорбутан CH 3 -CH 2 -CH 2 -C-H H O CH 3 -CH 2 -CH 2 -C-H OH O +2Cu(OH) 2 +Cu 2 O +2H 2 O Бутановая кислота
4. Природное соединение состава C 5 H 10 O 5 дает реакцию серебряного зеркала, при действии метанола в присутствии каталитического количества хлороводорода образует монометиловый эфир, а при нагревании с йодисто-водородной кислотой и фосфором превращается в 2-йодопентан. Предложите возможную структурную формулу исходного вещества и продуктов его превращений. Составьте уравнение реакции образования 2-йодопентана из данного вещества . + Ag 2 O C H O H- C -OH H- C -OH H- C -OH CH 2 OH C HO O H- C -OH H- C -OH H- C -OH CH 2 OH +2Ag
Источник: nsportal.ru
Презентация на тему Альдегиды и кетоны: свойства, получение, применение

с резким запахом;
С4 – С6 – жидкости с неприятным запахом;
>С6 – твердые, нерастворимые в воде с цветочным запахом (применяются в парфюмерии).
НСОН, СН3СОН – растворимы в воде неограниченно, температуры кипения ниже, чем у соответствующих спиртов.

Слайд 14Электронное строение и общая характеристика реакционной способности
Повышенная
реакционная способность связи С=О вызвана различием электроотрицательности
углерода и кислорода. В связи с появлением частичного положительного заряда на атоме углерода альдегиды и кетоны проявляют склонность к реакциям с нуклеофильными реагентами.

Слайд 15
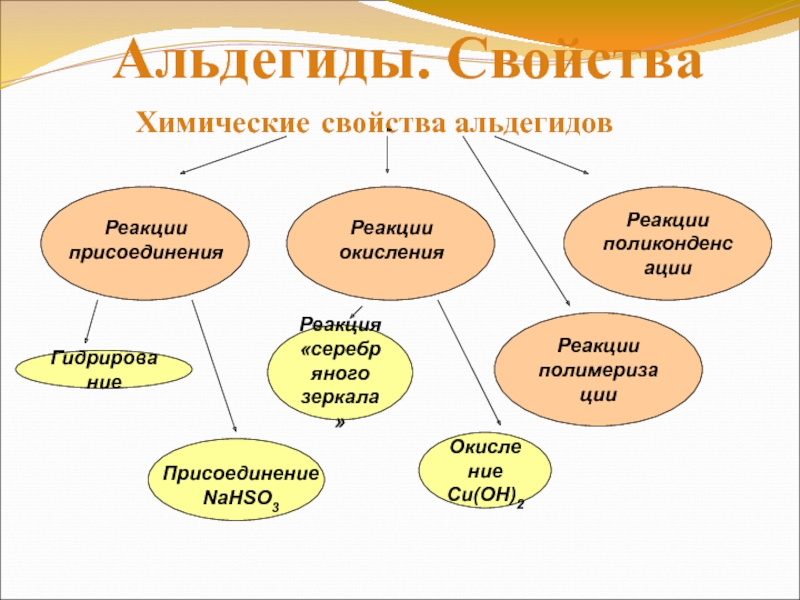
свойства альдегидов
Слайд 16R – C = O + [O]
→ R – C = O
Ι Ι
H OH
альдегид карбоновая
кислота
НСООН — метановая (муравьиная) кислота
СН3СООН — этановая (уксусная) кислота
![R – C = O + [O]](https://thepresentation.ru/img/tmb/4/333402/872c479b048d6f042cf15ef904e2c223-800x.jpg)
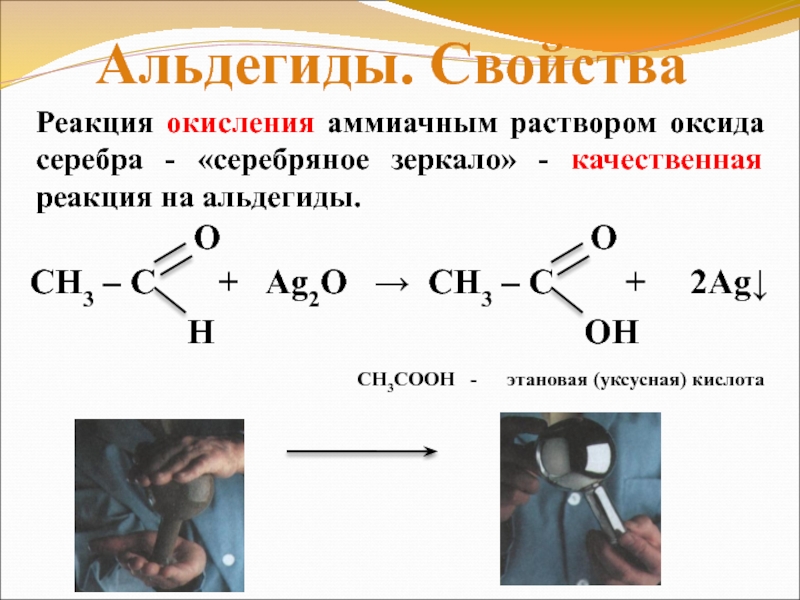
Слайд 17Реакция окисления аммиачным раствором оксида серебра —
«серебряное зеркало» — качественная реакция на альдегиды.
Альдегиды.
СН3СООН — этановая (уксусная) кислота
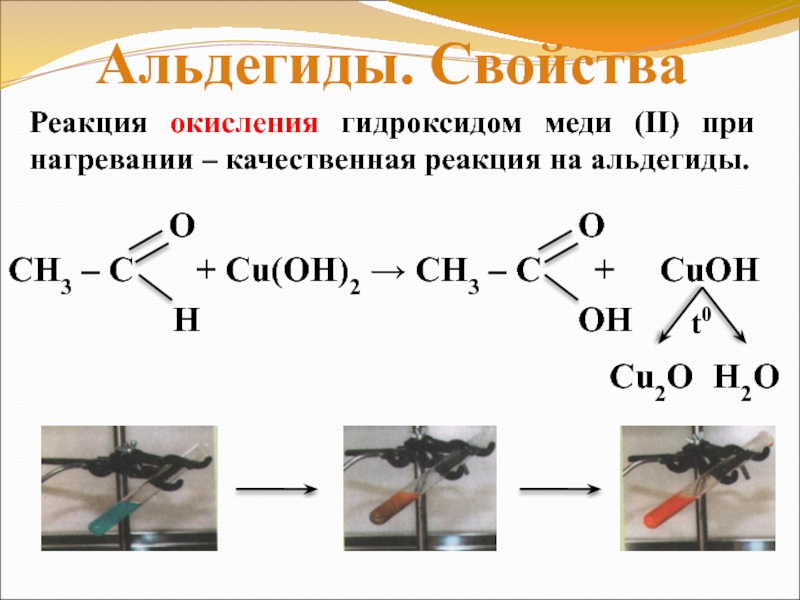
Слайд 18Реакция окисления гидроксидом меди (II) при нагревании
– качественная реакция на альдегиды.
Альдегиды. Свойства
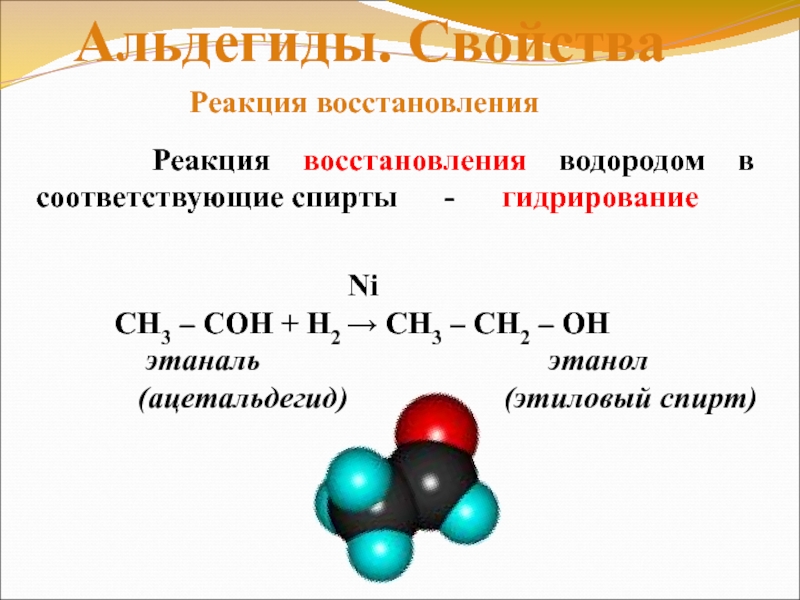
Слайд 19 Реакция восстановления водородом в соответствующие
спирты — гидрирование
Альдегиды.
Ni
СН3 – СОH + Н2 → CH3 – CH2 – OH
этаналь этанол
(ацетальдегид) (этиловый спирт)
Слайд 20(n+1)С6Н5ОН+nНСОН→[-CH2–C6H3OH — ]n-1+nH2O
фенол формаль- фенолформальдегидная
дегид смола
![(n+1)С6Н5ОН+nНСОН→[-CH2–C6H3OH - ]n-1+nH2O фенол формаль-](https://thepresentation.ru/img/tmb/4/333402/9e05085a8f16a7cf4154dfe433835d1f-800x.jpg)
Слайд 21Формальдегид
Альдегиды. Применение
Формали́н — водный раствор формальдегида (метаналь), стабилизированный метанолом
Фенолформальдегидные
Смолы, Лаки
Медицина
консервации
биологических материалов, ЛС, АНТИСЕПТИК

Слайд 22

Слайд 23
Уксусный
альдегид
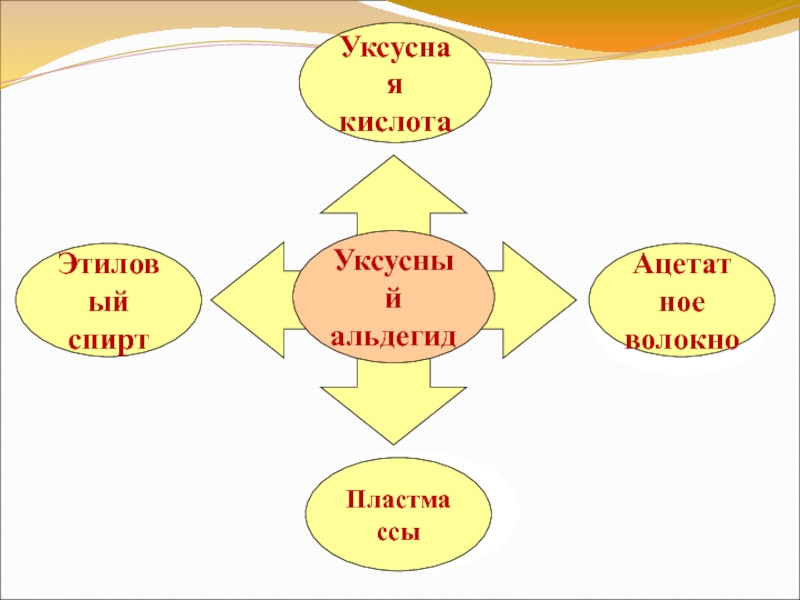
Слайд 24Ацетальдегид
Альдегиды. Применение
использовался в качестве прекурсора к уксусной кислоте.

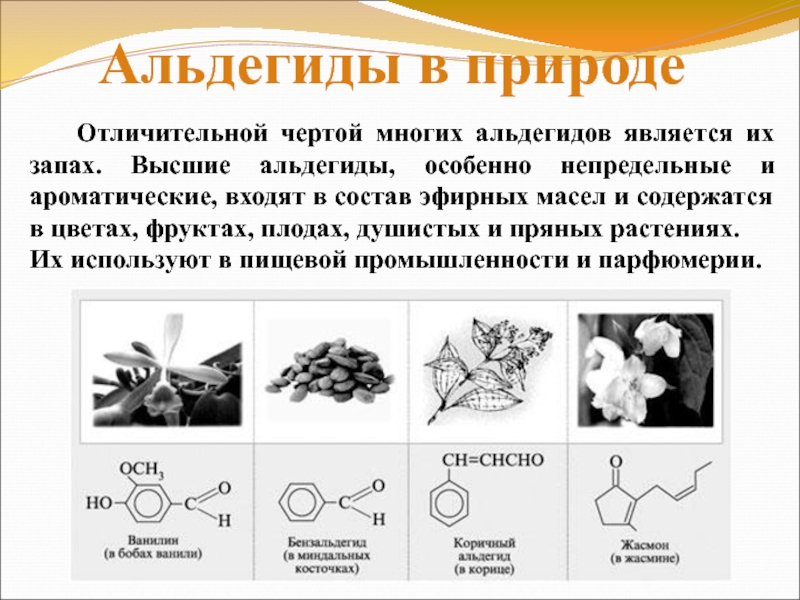
Слайд 25 Отличительной чертой многих альдегидов является
их запах. Высшие альдегиды, особенно непредельные и
ароматические, входят в состав эфирных масел и содержатся в цветах, фруктах, плодах, душистых и пряных растениях.
Их используют в пищевой промышленности и парфюмерии.
Альдегиды в природе
Слайд 26Булочки ванильные, корицы аромат,
Амаретто, шоколад
Альдегидов вкус таят.
В
землянике и кокосе,
И в жасмине, и в
малине,
И в духах, и в еде
Альдегидов след везде.
Что за запах, что за прелесть,
И откуда эта свежесть?!
Это высший альдегид
Аромат вам свой дарит!
Альдегиды в природе

Слайд 27 В плодах ванили
содержится ароматический альдегид, который придает им характерный
запах.
Ванилин применяется в парфюмерии, кондитерской промышленности, для маскирования запахов некоторых продуктов.
Альдегиды в природе

Слайд 28 Запах цитрусовых обусловлен данным диеновым
альдегидом. Его применяют в качестве отдушки средств
бытовой химии, косметических и парфюмерных веществ.
Альдегиды в природе

Слайд 29Коричный альдегид
3-фенилпропеналь
Коричный альдегид содержится
в масле корицы, его получают перегонкой коры
дерева корицы .
Применяется в кулинарии в виде палочек или порошка.
Альдегиды в природе

Слайд 30Бензальдегид
Бензальдегид – жидкость с
запахом горького миндаля.
Встречается в косточках и семечках(абрикос,
Альдегиды в природе

Слайд 31Фенилэтаналь
Фенилэтаналь по сравнению с бензальдегидом лучше соответствует
рецептору цветочного запаха.
Фенилэтаналь пахнет гиацинтом.
Альдегиды в природе

Слайд 32 Это соединение представляет собой
жидкость с гвоздичным запахом.
Гептаноном-2 обусловлен запах
многих плодов и молочных продуктов, например, сыра «Рокфор»
Кетоны в природе

Слайд 33n-Гидроксифенилбутанон-2
Этот кетон обуславливает в основном
запах спелых ягод малины.
Его
включают в состав синтетических душистых композиций
Кетоны в природе

Слайд 34Выполни задания теста
1. ( Общая формула
альдегидов :
А. RCOH В. R1COR2
Б. RCOOH Г. ROH
2. Функциональная
группа альдегидов :
А. — ОН В. – СОН
Б. — СО Г. – СООН
3. Формула формальдегида :
А.НСООН В.СН3СОН
Б.НСОН Г.СН3СООН
4. Вещество состава СН3СОН называется:
А. Метаналь В. Уксусная кислота
Б. Этаналь Г. Ацетальдегид

Слайд 355. Продуктами восстановления альдегидов водородом (катализатор Ni)
являются :
А. Сложные эфиры
В. Одноатомные спирты
Б. Карбоновые кислоты Г. Кетоны
6. В реакцию «серебряного зеркала» могут вступать :
А. Фенол В. Этанол
Б. Метаналь Г. Этаналь
7. Продуктом окисления этанола является :
А. Ацетон В. Уксусный альдегид
Б. Уксусная кислота Г. Диэтиловый эфир
8. Правой частью уравнения СН3СОН + 2Cu(ОН)2↓→ :
А. НСООН + Cu2O↓ + 2H2O
Б. CH3COOH + Cu2O↓ + 2H2O
Источник: thepresentation.ru