Презентация по предмету «Химия» на тему: «Свойства альдегидов, их применение.. Цели урока: Изучить химические свойства альдегидов. Познакомить учащихся с применением формальдегида и ацетальдегида.». Скачать бесплатно и без регистрации. — Транскрипт:
1 Свойства альдегидов, их применение.
2 Цели урока: Изучить химические свойства альдегидов. Познакомить учащихся с применением формальдегида и ацетальдегида на основе их свойств. Развивать умения характеризовать строение и химические свойства изученных органических соединений, объяснять зависимость свойств веществ от их состава и строения, выполнять химический эксперимент, соблюдая правила безопасного обращения с веществами и лабораторным оборудованием, проводить наблюдения, делать выводы. Воспитывать бережное отношение к своему здоровью, здоровью окружающих.
3 Выполните тест 1. (2 балла) Общая формула альдегидов : А. RCOHВ. R 1 COR 2 Б. RCOOHГ. ROH 2. (2 балла) Функциональная группа альдегидов : А. — ОН В. – СОН Б. — СОГ. – СООН 3. (2 балла) Формула формальдегида : А.НСООНВ.СН 3 СОН Б.НСОНГ.СН 3 СООН 4. (2 балла) Вещество состава СН3СОН называется : А. МетанальВ. Уксусная кислота Б. ЭтанальГ. Ацетальдегид
Альдегиды и кетоны: свойства, про которые не пишут в учебниках… | Химия ЕГЭ | Умскул
4 Правильные ответы 1. А R – C=O Общая формула альдегидов Ι H 2. В — С=О Функциональная группа альдегидов Ι Н 3. Б Н – С=О Формальдегид Ι Н 4. Б,Г СН 3 С=О Этаналь. Ацетальдегид Ι Н
5 Получение альдегидов 1.Окислением (дегидрированием) первичных спиртов: в промышленности Cu,t СН 3 СН 2 ОН CH 3 COH + H 2 этанол этаналь в лаборатории (закончить уравнение самостоятельно) t СН 3 СН 2 ОН + CuO
6 Получение альдегидов 1.Окисление (дегидрирование) первичных спиртов: в промышленности Cu,t СН 3 СН 2 ОН CH 3 COH + H 2 этанол этаналь в лаборатории t СН 3 СН 2 ОН + CuO CH 3 COH + H 2 O+ Cu этанол черный этаналь красный запах зеленого яблока 2 балла
7 Получение альдегидов 2. Реакция Кучерова (написать самостоятельно уравнение реакции)
8 Получение альдегидов 2. Реакция Кучерова: Hg 2+ СНСН + Н 2 О СН 3 СОН ацетилен уксусный альдегид 4 балла
9 Особенности строения альдегидов δ+ δ- а) R — С = О б) R- С = О Ι Ι Н Н
10 Физические свойства альдегидов С 1 – газ с резким запахом; С 2 – С 3 – жидкости с резким запахом; С 4 – С 6 – жидкости с неприятным запахом; >С 6 – твердые, нерастворимые в воде с цветочным запахом (применяются в парфюмерии). НСОН, СН 3 СОН – растворимы в воде неограниченно, температуры кипения ниже, чем у соответствующих спиртов.
12 Реакция восстановления Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе (реакция гидрирования): Ni R – COH + H 2 R – CH 2 – OH альдегид первичный спирт
13 Самостоятельно закончить уравнение, назвать вещества: Ni СН 3 – СОH + Н 2
14 Самостоятельно закончить уравнение, назвать вещества: Ni СН 3 – СОH + Н 2 CH 3 – CH 2 – OH этаналь этанол (ацетальдегид) (этиловый спирт) (2 балла)
16 Самостоятельно закончить уравнение, назвать вещества: СН 3 – С = О + [О] Ι Н
10.2. Альдегиды и кетоны: Способы получения. ЕГЭ по химии
17 Самостоятельно закончить уравнение, назвать вещества: СН 3 – С = О + [О] СН 3 – С = О Ι Н ОН этанальэтановая кислота (уксусный альдегид, (уксусная кислота) ацетальдегид) 2 балла
18 Качественные реакции на альдегиды (л.о. 10) 1. Реакция «серебряного зеркала»: t Н — С = О + Ag 2 О Н – С = О + 2Ag Ι Ι « серебряное Н ОН зеркало» метаналь метановая (муравьиный альдегид, (муравьиная) кислота формальдегид) Используется для изготовления зеркал, серебрения украшений, елочных игрушек.
19 Качественные реакции на альдегиды (л.о. 10) 2. Окисление альдегидов свежеосажденным гидроксидом меди (II): t Н – С=О + 2Cu(ОН) 2 Н – С=О + Cu 2 O+2H 2 O Ι синий Ι красный H OH метаналь муравьиная (формальдегид) кислота
20 Реакция поликонденсации (n+1)С 6 Н 5 ОН+nНСОН[-CH 2 –C 6 H 3 OH — ] n-1 +nH 2 O фенол формаль- фенолформальдегидная дегид смола
21 Отдельные представители альдегидов и их значение Формальдегид (метаналь, муравьиный альдегид) НСОН – ядовит! Раствор формальдегида в воде (40%) называют формалином. Его используют: — в сельском хозяйстве для протравливания семян; — в кожевенной промышленности для обработки кож; — для хранения влажных биологических препаратов.
Формальдегид используют для получения кальцекса, уротропина – лекарственных веществ. Спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида используют для получения фенолформальдегидных смол, фенопластов, аминопластов.
22 Отдельные представители альдегидов и их значение Уксусный альдегид (этаналь, ацетальдегид) СН 3 СОН – ядовит! В промышленных масштабах его используют для получения уксусной кислоты, для производства различных пластмасс, ацетатного волокна и ряда других веществ.
23 Выполните тест 1. (2 балла) Продуктами восстановления альдегидов водородом (катализатор Ni) являются : А. Сложные эфиры В. Одноатомные спирты Б. Карбоновые кислоты Г. Кетоны 2. (2 балла) В реакцию «серебряного зеркала» могут вступать : А. Фенол В. Этанол Б. Метаналь Г. Этаналь 3. (2 балла) Продуктом окисления этанола является : А. Ацетон В. Уксусный альдегид Б. Уксусная кислота Г. Диэтиловый эфир 4. (2 балла) Правой частью уравнения СН 3 СОН + 2Cu(ОН) 2 : А. НСООН + Cu 2 O + 2H 2 O Б. CH 3 COOH + Cu 2 O + 2H 2 O
24 Правильные ответы (самоконтроль) 1. В 2. Б,Г 3. В 4. Б «5» — 26 – 23 балла «4» — 22 – 18 баллов «3» — 17 – 13 баллов
25 Домашнее задание § 19 (выборочно, в соответствии с конспектом) выучить; упр. 4, 6* Н-С=О Ι ОН
Источник: www.myshared.ru
Окисление альдегидов и кетонов
Благодаря тому, что в альдегидах имеется атом водорода, связанный с карбонильной группой, они чрезвычайно легко окисляются не только разными окислителями, но даже и кислородом воздуха. Особенно легко окисляются ароматические альдегиды.
Запомни! В молекулах образующихся кислот столько же атомов углерода, сколько их было в исходном альдегиде.
В общем виде уравнение окисления альдегидов можно записать следующим образом:
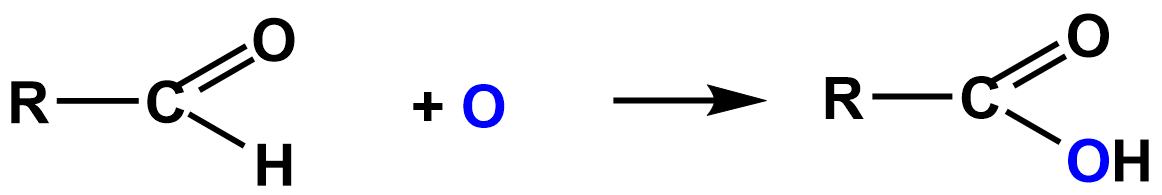
Для качественного определения альдегидов чаще всего пользуются реакцией «серебряного зеркала», то есть реакцией восстановления аммиачного раствора окиси серебра (реактив Толленса), при этом серебро выделяется на стенках пробирки в виде зеркального слоя.
Для этой же цели пользуются реакцией восстановления «фелинговой жидкости» (реактив Фелинга: раствор CuSO4 и 10% раствор NaOH в присутствии тартратов или свежеприготовленный гидроксид меди). При этом, в присутствии восстановителей — альдегидов голубой аморфный осадок гидроксида меди превращается при нагревании в красный осадок закиси меди:
Запомни! Кетоны не вступают в реакцию «серебряного зеркала» и окисляются значительно труднее альдегидов — только при действии сильных окислителей (например, KMnO4 или азотная кислота) и повышенной температуре.
При этом обыкновенно разрывается связь между карбонильной группой и одним из алкилов и получаются кислоты с меньшим числом атомов углерода в молекуле. Так как связь между углеродными атомами может разорваться с каждой стороны карбонильной групп, а число атомов углерода в радикалах может быть различным (правило окисления кетонов А. Н. Попова), то в наиболее общем случае получается смесь четырех кислот:
Механизм окисления выглядит следующим образом:

Задача 3
Написать уравнение реакции окисления диэтилкетона перманганатом калия и вычислить коэффициенты методом электронного баланса
Решение
Напишем полное уравнение реакции окисления, помня, что в соответствии с правилом Попова, должно получиться четыре кислоты, в данном случае — по две молекулы уксусной и пропионовой кислот:
Определим степени окисления углерода в молекулах диэтилкетона и в молекулах кислот:


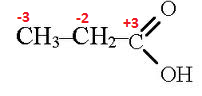
Запишем электронный баланс. В молекуле диэтилкетона атомы углерода окисляются до –COOH. Марганец в кислой среде восстанавливается до Mn+2:
Проставляем полученные коэффициенты в уравнение реакции, уравниваем кислород и водород:
Чаще всего для восстановления используют процессы гидрирования, то есть взаимодействие с водородом в присутствии металлических катализаторов.
Для гидрирования кратной связи С=С или С≡С в качестве катализаторов могут быть использованы платиновая чернь, скелетный никелевый катализатор (никель Ренея), никель на носителях, медь, смешанные оксидные катализаторы и др. В промышленной практике обычно применяют металлический никель и никель, осажденный на оксиде алюминия, оксиде хрома или других носителях. Обычно реакция идет уже при комнатной температуре и атмосферном давлении. Гидрирование ароматических углеводородов идет в присутствии тех же катализаторов, но при нагревании.
Задача 1
Написать уравнение реакции гидрирования пропена, рассчитать коэффициенты методом электронного баланса.
Решение
Уравнения окислительно-восстановительных реакций в этом случае составляются достаточно просто:
Определим степени окисления углерода в молекулах пропена и пропана:


Составим электронный баланc. При гидрировании атомы углерода, образующие двойную связь, меняют свои степени окисления:
Таким образом, на один моль пропена расходуется 1 моль водорода.
Альдегиды и кетоны сравнительно легко гидрируются в присутствии катализаторов гидрирования. Эту реакцию часто используют в промышленном синтезе первичных и вторичных спиртов. В реакциях восстановления водород взаимодействует с кислородсодержащими группами — карбонильной, карбоксильной, нитрогруппой и др. Различают реакции восстановления без выделения воды и реакции восстановления с выделением воды. Процессы восстановления часто проводят на тех же катализаторах, которые применяются для гидрирования кратных связей.

Механизм нитрования
Сложность статьи узнать больше, чем в школепобедить в олимпиаде
Определение
Нитросоединения — органические соединения, содержащие одну или несколько нитрогрупп —NO2. Под нитросоединениями обычно подразумевают углеводороды, в которых нитрогруппа непосредственно связана с атомом углерода (нитроалканы, нитроалкены и нитроарены и т.д.).
Наиболее важный метод получения нитросоединений — нитрование.
Определение
Нитрование – непосредственное замещение атома водорода в органическом соединении NO2 -группой.
Различают С-, О- и N-нитрование, направленные на синтез С-нитропроизводных, органических нитратов (нитроэфиров) R−ONO2 и N-нитраминов RNHNO2. Обычно субстратом служат карбоциклические и гетероциклические ароматические соединения. Алифатические соединения нитруются значительно реже.
Нитрующими агентами являются азотная кислота и её смеси с разными реагентами, чаще всего, с сильными неорганическими кислотами. Основным побочным процессом при нитровании является окисление. Нитрование менее селективно, чем сульфирование, вследствие меньшего размера и большей активности атакующей частицы. Тем не менее, правильный выбор нитрующего агента позволяет существенно повысить выход целевого продукта
Другие способы получения нитросоединений (например, нуклеофильной заменой галогена) имеют значительно меньшее значение.
Источник: infopedia.su
Сравнительные химические свойства альдегидов и кетонов

Одна a-связь, вторая л-связь, за счет бокового перекрывания не- гибридизованных р-электронов углерода и кислорода. Двойная связь поляризована вследствие различной величины электроотрицательности углерода и кислорода (2,69 и 3,5) и смещена к более э.о. кислороду, поэтому в карбонильной группе углерод всегда несет частичный положительный заряд (8 + ), а кислород — отрицательный (8″).
Наличие положительного заряда на углероде карбонильной группы приводит к тому, что характерными реакциями для карбонильных соединений являются реакции нуклеофильного присоединения — AdN. Однако способность вступать в такие реакции зависит от электронных эффектов заместителей при карбонильном атоме углерода.

Описанные выше электронные эффекты определяют различия в химических свойствах альдегидов и кетонов.

В обобщенном виде реакции альдегидов и кетонов представлены на приведенной ниже схеме:

зависят от строения альдегида, наличия или отсутствия водорода у а-углерода
В случае альдегидов реакция протекает легко, из одной молекулы альдегида образуется одна молекула кислоты:

Кетоны окисляются с разрывом цепи: из одной молекулы кетона образуются две молекулы кислоты (или разных кислот). Разрыв цепи происходит по правилу Попова: карбонильная группа остается с меньшим радикалом. Реакция протекает трудно, лишь в жестких условиях:



1-я стадия — нуклеофильная атака альдегида ОН-группой с образованием аниона:

2-стадия — выброс гидрид-иона из аниона альдегида на другую молекулу альдегида с образованием кислоты и нестойкого промежуточного соединения:

3-стадия — образовавшийся нестойкий промежуточный продукт взаимодействует с Н20, образуя спирт и регенерируя катализатор — группу ОН 0 :

Реакция дисмутации представляет собой окислительно-восстановительный процесс, в ходе которого из формальдегида образуются муравьиная кислота (в процессе окисления) и метиловый спирт (в процессе восстановления).
Альдольная конденсация под влиянием щелочей протекает в водных растворах по механизму AdN в три стадии.
1-я стадия — образование карбоаниона:

2-я стадия —нуклеофильная атака карбоанионом положительно заряженного углерода карбонильной группы с образованием промежуточного соединения — ал кокс ид-иона:

3-я стадия — присоединение алкоксид-ионом в водной среде Н + из КОН с образованием соединения со смешанными функциями — аль- доля — и регенерацией катализатора:

Значение этих реакций заключается в том, что в живых организмах таким путем под влиянием ферментов идет образование следующих веществ:
- • лимонной кислоты в цикле трикарбоновых кислот;
- • гексоз из двух фосфотриоз;
- • нейраминовой кислоты в нервных клетках.
Альдольная конденсация под влиянием кислот также протекает по механизму AdN в четыре стадии.
1-я стадия — образование под влиянием катализатора (Н + ) карбо- катиона I:

2-я стадия — образование енольной формы альдегида (енолизация) под влиянием катализатора — Н + :

З-я стадия — атака карбокатионом I по двойной связи енольной формы альдегида с образованием нестойкого карбокатиона II:

4-я стадия — стабилизация карбокатиона II выбросом протона (Н + ) с образованием альдоля:

1-я стадия — образование карбокатиона протонированием альдегида:

2-я стадия — атака нуклеофильным реагентом образовавшегося кар- бокатиона с получением нестойкого промежуточного соединения:

3-я стадия — стабилизация нестойкого промежуточного соединения выбросом протона с образованием полуацеталя:

Образовавшийся в ходе реакции гидроксил называют полуацеталъ- ным гидроксилом.
Значение образования полуацеталей заключается в том, что моносахариды в клетке на 99,5% существуют в виде полуацеталей (внутренних).
Галоформные реакции. Эти реакции приводят к образованию йодоформа, хлороформа, бромоформа. Галоформные реакции обусловлены появлением С—Н-кислотности у а-углерода под влиянием отрицательного индуктивного эффекта (-/-эффекта) рядом расположенной карбонильной группы. Протекают в две стадии.
1-я стадия — образование трихлорзамещенного альдегида:

2-я стадия — расщепление непрочного соединения — трихлоруксусно- го альдегида под действием NaOH протекает легко, так как оба углерода трихлоруксусного альдегида несут частичные положительные заряды (5 + )

фа) (AdN— Е). Эти реакции протекают в три стадии.
1-я стадия — нуклеофильная атака первичными аминами углерода (8 + ) карбонильной группы с образованием биополярного иона:

2-я стадия — стабилизация биполярного иона:

3-я стадия — отщепление (элиминирование) термодинамически устойчивой молекулы Н20 с образованием основания Шиффа:

Значение реакции присоединения-отщепления в организме заключается в образовании оснований Шиффа, идет при биосинтезе аминокислот из кетокислот (переаминирование) и распаде аминокислот через стадию переаминирования.
Вопросы для контроля
- 1.Что называют оксосоединениями? Опишите электронное строение оксогруппы.
- 2. Что называют альдегидами? Какова их общая формула?
- 3. Что называют кетонами? Какова их общая формула?
- 4. Приведите классификацию альдегидов.
- 5. Укажите виды изомерии для альдегидов. Приведите примеры.
- 6. Изложте основы номенклатуры альдегидов.
- 7. Укажите способы получения альдегидов и кетонов.
- 8. Напишите уравнение реакции Кучерова.
- 9. Перечислите химические свойства альдегидов.
- 10. Перечислите химические свойства альдегидов, обусловленные водородом альдегидной группы (реакции окисления), и напишите уравнения соответствующих химических реакций.
- 11. Перечислите химические свойства альдегидов, обусловленные карбонильной группой, и напишите соответствующие уравнения реакций.
- 12. Напишите уравнения реакций замещения в радикале альдегидов, укажите продукты реакций.
- 13. Опишите механизмы реакций у тригонального атома углерода, характерные для альдегидов и кетонов.
- 14. Опишите зависимость нуклеофильного присоединения к триго- нальному атому углерода от электронных эффектов заместителей.
- 15. Охарактеризуйте различия в реакционной способности альдегидов и кетонов в реакциях нуклеофильного присоединения.
- 16. Укажите реакции альдольной конденсации и их значение в организме человека.
- 17. Перечислите стадии реакции, ведущей к образованию оснований Шиффа, назовите реакцию и укажите значение этой реакции в организме человека.
Источник: bstudy.net