КАЛИЯ СОЕДИНЕНИЯ. Во всех своих соединениях калий одновалентен и образует бесцветный катион К • . В окрашенных солях калия окраска обусловлена анионом (например, перманганата калия КМnO4 или хлороплатината калия K2PtCl6).
Радиус (сфера действия) иона калия в кристаллах типа хлористого натрия составляет, по Гольдшмидту, 1,33 Å. Ион калия относится, т. о., к самым крупным катионам (см. Ионы). В связи с этим находится и относительно слабая способность солей калия к образованию кристаллогидратов.
При слабом прокаливании соли калия не летучи, однако в пламени бунзеновской горелки они улетучиваются, окрашивая пламя в фиолетовый цвет. Соли калия б. ч. легко растворимы и относятся к сильным электролитам; сравнительно малорастворимы лишь хлорат, перхлорат, кислый тартрат и некоторые комплексные соли. Аналитическое определение калия производится: качественное — чаще всего осаждением иона К • в виде кислой виннокислой соли, С4Н5О6К, или хлороплатината, KPtCl6; количественное — весовым путем в виде хлороплатината или перхлората.
Дефицит калия и магния: как их восполнить?
Окислы калия . С достоверностью известны окислы состава К2О, К2О2 и К2О4. При горении калия в избытке кислорода образуется главным образом тетраокись, К2О4 — желтое вещество, при растворении в воде выделяющее перекись водорода и кислород:
При недостатке кислорода образуется перекись калия, К2О2; при весьма медленном окислении калия теоретическим количеством кислорода м. б. получена окись калия, К2О, в виде бесцветных кристалликов.
Гидрат окиси калия , КОН, см. Едкое кали.
Гидрид калия , водородистый калий, КН, получается действием водорода на металлический калий при 400°, в виде прозрачных игл.
Нитрат калия , азотнокислый калий, калийная селитра, KNО3, получается из азотнонатриевой соли, NaNО3 (см. Калийная промышленность, Селитра), бесцветные кристаллы ромбической системы, легко растворимые вводе (при 0° — 11,5%; при 50° — 46,1%; при 100° — 71,1%); температура плавления 338°; удельный вес 2,11; твердость (по Моосу) 2. KNО3 легко отдает кислород; на этом основано применение его для приготовления черного пороха (смесь из селитры, угля и серы), зажигательных фитилей, селитренной бумаги (зажигательная бумага при магниевой вспышке) и при приготовлении фейерверков; KNО3 служит также консервирующим средством для пищевых продуктов (мяса).
Нитрит калия , азотистокислый калий, KNО2, образует желтоватые кристаллы, расплывающиеся на воздухе, растворяющиеся в 1/3 ч. воды, нерастворимые в спирте; температура плавления 297,5; удельный вес 1,92. Получается восстановлением расплавленной селитры металлическим свинцом или путем пропускания сернистого газа через нагретую смесь селитры и извести:
с последующим извлечением нитрита водой и упариванием раствора досуха. KNО2 применяется для реакций диазотирования в красочной промышленности и в фотографии как сенсибилизатор.
Сульфат калия , сернокислый калий, K2SО4, в природе находится в минералах (глазерите, шените, леоните, полигалите); кристаллизуется в гексагональной системе; белые ромбические кристаллы; удельный вес 2,67; температура плавления около 1066°, удельная теплоемкость 0,196;теплота образования +345 Cal (по Томсону); растворимость в воде: при 0° — 6,85%, при 10° — 9,7%, при 50° — 14,87%; при 100° — 19,41%; теплота растворения с 400 молекулами воды при 18° — 6,37 Cal. О получении и применении K2SО4 см. Калийная промышленность.
Калий: в каких продуктах содержится?
Бисульфат калия , кислый сернокислый калий, KHSО4, получается из сульфата калия и серной кислоты в виде бесцветных кристаллов удельным весом 2,36, с температурой плавления 210°. При прокаливании бисульфат разлагается, выделяя серную кислоту, сернистый газ и кислород; на этом свойстве основано применение его в лабораторной практике для очистки платиновой посуды. В технохимических процессах он применяется иногда как водоотщепляющий агент.
Сульфит калия , сернистокислый калий, K2SО3·2Н2О, бесцветные кристаллы горького вкуса, легко расплывающиеся в сыром воздухе, в спирте почти нерастворимые; получается пропусканием сернистого газа, SО2, в раствор углекислого калия, К2СО3, или едкого кали, КОН, по уравнению:
В технике его получают в виде 45%-ного раствора из раствора КОН плотностью 50° Bѐ; в последний пропускают SО2 до тех пор, пока ареометр не покажет 45° Вѐ, или пока фенолфталеин не перестанет окрашивать пробу раствора. Концентрированный раствор K2SО3 употребляется при печатании тканей в качестве протравы.
Бисульфит калия , кислый сернистокислый калий, KHSО3, большие прозрачные кристаллы, легко растворимые в воде, почти нерастворимые в спирте; при нагревании и долгом хранении переходит частично в метабисульфит калия, K2S2О6. Для получения бисульфита в кипящий раствор едкого кали или поташа вводят сернистый газ, SО2, до тех пор, пока удельный вес раствора не достигнет 11,46; после охлаждения выкристаллизовывается KHSО3. Применяется KHSО3 при белении различных материалов (соломы, дубильных экстрактов), в крашении и печатном деле, т. к. он является сильным восстановителем.
Метабисульфит калия , пиросульфит калия, К2S2О5, получается насыщением горячего раствора сульфита калия, K2SО3, сернистым газом, SО2; по охлаждении выкристаллизовывается K2S2O5 в виде белого твердого кристаллического порошка; K2S2О5 растворяется медленно в воде, плохо в спирте и совсем не растворяется в эфире; применяется в фотографии (фиксаж и составление растворов проявителей) и в виноделии как консервирующее средство.
Персульфат калия , надсернокислый калий, K2S2О8, получается путем электролиза насыщенного раствора бисульфата калия на аноде; катодной жидкостью служит разбавленная серная кислота. В присутствии фтористых соединений электролиз можно вести и без диафрагмы. Другой, чисто химический способ основан на реакции двойного обмена между персульфатом аммония и сернокислым калием. K2S2О8 образует большие бесцветные кристаллы, водный раствор которых медленно разлагается с выделением кислорода и образованием бисульфата калия:
Персульфат калия находит применение в качестве окислителя; в фотографии он входит в состав магниевой вспышки и проявителей.
Сульфиды калия , сернистые соединения, получаются при насыщении КОН сероводородом (получается гидросульфид калия, KSH), при восстановлении сульфата калия K2SО4 углем (сернистый калий, K2S) и сплавлением поташа с серой.
Гидросульфид калия , сульфгидрат калия, KSH, при 415° плавится в подвижную желтую жидкость. При кипячении раствора KSH он выделяет сероводород и превращается в K2S.
Сернистый калий , K2S, бесцветное тело, удельным весом 1,8, температурой плавления 471°, растворим в воде и в спирте, применяется в фотографии при вирировании (для получения желтоватых тонов на бромосеребряных отпечатках). Кроме K2S, существуют еще и полисульфиды калия : K2S3, K2S4 и K2S5, которые получаются при сплавлении КОН или К2СО3 с серой при различных температурах; при кипячении К2СО3 или КОН с избытком серы (серным цветом) получается так называемая серная печень (смесь K2S5 с K2S2О3), масса красно-коричневого цвета, растворяющаяся в воде; применяется в медицине для серных ванн.
Хлористый калий , КСl, в природе находится в минералах: карналлите, сильвините, каините, откуда и добывается (см. Калийная промышленность). КСl кристаллизуется из воды в прозрачных кубах; удельный вес 1,98, температура плавления 768°, температура кипения 415°; теплота плавления 86 Cal/кг; растворимость в воде: при 0° — 28,5%; при 10° — 32%; при 80° — 51% и при 100° — 56,6% КСl.
Теплота растворения (1 КСl + 200 Н2O) = 4,4 Cal, электропроводность при 776° — 2,24 мо-см. Применяется для получения других соединений калия и как удобрение (см. Калийные соли, удобрение).
Хлорноватистокалиевая соль , гипохлорит калия, КСlO, получается пропусканием хлора в холодный раствор КОН; применяется в растворах как средство для беления (жавелевая вода).
Хлорноватокислый калий , хлорат калия, КСlO3, см. Бертолетова соль.
Бромистый калий , КВr, см. Брома соединения.
Йодистый калий , KJ, см. Йода соединения.
Фтористый калий , KF, получается действием плавиковой кислоты, HF, на едкое кали или на поташ в платиновом сосуде, а также прокаливанием кислой соли KF-HF. Белые кристаллы, весьма гигроскопичные, расплывающиеся на воздухе. Раствор имеет щелочную реакцию (см. Гидролиз) и выделяет при упаривании (температура ниже 40°) гидрат состава KF·2Н2О. Помимо нейтральной, известны также кислые соли, представляющие соединения KF с одной, двумя или тремя молекулами HF.
Силикат калия , калиевое растворимое стекло , кремнекислый калий, получается сплавлением кварцевого песка с поташом и углем и поступает в продажу либо в виде твердых стекловидных кусков либо в виде раствора крепостью 30—33° Вѐ. Средний состав его — между формулами К2SiO3·3 SiO2 и K2SiO3·SiO2. С небольшим количеством воды силикат набухает в желатиноподобную массу, затвердевающую через несколько дней; из водного его раствора углекислота выделяет кремнезем. Силикат калия служит наполнителем при изготовлении искусственных камней и в мыловарении, для утяжеления шелка, как протрава при крашении, для пропитки дерева и тканей с целью предохранения их от огня и гниения, в живописи (стереохромия), для изготовления лепных архитектурных украшений и т. п.
Тартрат калия , виннокислый калий, см. Винные кислоты.
Бикарбонат калия , двууглекислый калий, кислый углекислый калий, КНСO3, получается действием углекислоты на раствор поташа при 60°; процесс протекает особенно быстро в присутствии древесного угля: КНСO3 образует прозрачные кристаллы, легко растворимые в воде; в 100 ч. воды растворяется: при 0° — 19,61 ч., при 20° — 26,91 ч. и при 50° — 37,92 ч. КНСО3; на воздухе КНСО3 устойчив, а при нагревании теряет углекислоту и переходит в К2СО3.
Источник: Мартенс. Техническая энциклопедия. Том 9 — 1929 г.
Источник: azbukametalla.ru
Калий: «узник», живущий в наших клетках

Калий (К, Kalium) – то вещество, без которого немыслима полноценная жизнь клеток. Оно следит за тем, чтобы эти составляющие организма хорошо кушали и вовремя очищались от шлаков. Но если что-то помешает ему в этом, быть беде – все тело начнет «штормить».
Только подумайте: организм взрослого человека содержит в среднем от 160 до 250 граммов калия, и почти весь он – до 98% — входит в состав клеток. Поэтому вполне логично, что при недостатке или избытке данного минерала многие органы и системы, состоящие, как известно, из них, выходят из строя.
Вот почему так важен калий для здоровья, поэтому предлагаю вам познакомиться поближе с этим удивительным веществом.
Калий отличается тем, что в своем естественном состоянии никогда не бывает свободным, то есть, он всегда входит в состав каких-либо соединений. Казалось бы, значит, такой химический элемент не слишком значим, но на деле получается наоборот. Отпилите ножку от стула, и вы не сможете на нем сидеть. Таким образом, неприметный и несвободный калий играет очень важную роль в природе и в теле человека.
Кто и как открыл калий?

Человечество активно пользовалось свойством данного металла в соединении с водой превращаться в щелочь.
Так, карбонат калия, известный в народе как природное моющее средство «поташ», применяли в быту еще в древности. Заметьте, это происходило до открытия калия как металла.
А озвученное мною событие случилось в самом начале XIX века, когда англичанину сэру Хэмфри Дэви удалось таки выделить калий, а заодно и натрий, из расплава поташа и каустической соды при помощи электролиза. Первоначально калий получил название «потассий», а затем был переименовал в термин, который известен нам сегодня.
Слово «калий» произошло от арабского аналога поташа «аль-кали».
Когда я узнала, что каждая моя клетка функционирует именно благодаря данному минералу, то, вполне естественно, мне сразу захотелось протестировать свой ежедневный рацион на его наличие.
Для себя я обозначила вегетарианские продукты, в которых содержится калий, и теперь с удовольствием делюсь этой ценной информацией с вами. Ведь именно в естественном состоянии он проявляет все свои полезные свойства.
Какие продукты содержат природный калий?

Не знаю, как вы, а я слышала и не раз, что этого минерала много в кураге. Если кто не в курсе, это высушенные абрикосы. Я всю жизнь живу на юге, и у нас абрикосовые деревья растут по всему городу, а сами фрукты летом буквально валяются под ногами. Соседний со мной спальный район построен на месте абрикосовой рощи. Мама рассказывала мне, что раньше люди просто приходили туда с ведрами и собирали урожай, а затем варили на зиму варенье и, конечно же, сушили половинки абрикосов на жарком южном солнце.

Так вот, я с уверенностью могу сказать вам, что те красивые ярко-оранжевые сухофрукты, которые на рынках и в супермаркетах сегодня выдают за курагу, далеки от нее настоящей.
Это нечто в пластиковых пакетиках и правда сделано из абрикосов, но, скорее всего, сушилось в промышленных печах при очень высоких температурах, а затем нещадно обрабатывалось двуокисью серы, глицерином, жидким дымом и прочими химическими «чудесами» прогресса.
Настоящая курага, в которой калия содержится примерно 1700 мг на 100 г, сухая, сморщенная и коричневая.
Если абрикосы растут в ваших широтах, покупайте их в сушеном виде у бабушек, а если нет – заказывайте в экомагазинах и различных сыроедческих лавках.
Приверженцы живого питания могут поискать абрикосы, высушенные в тени – при таком способе обработки они сохраняют все свои ценные свойства и приравниваются к сыроедческим продуктам.

Из сухофруктов могу также выделить изюм и чернослив как продукты, богатые калием.
Обращаю ваше внимание на то, что к этим сушеным плодам относится все написанное выше о кураге. Чернослив должен быть матовым (не лаковым и не блестящим), а изюм лучше покупать темный, так как светлый искусственно отбеливают химикатами для поддержания привлекательного внешнего вида.
Чтобы калий в еде оставался надолго, важно правильно готовить такие продукты. Имейте в виду, что вымачивать их в воде не стоит, так как минерал переходит в нее. То же касается и процесса варки. Если вы все же сделали это, постарайтесь как-то использовать эту ценную жидкость в приготовлении блюд.
Другие растительные источники калия – бобовые. Его много в фасоли, молодом горошке, чечевице, арахисе.
В 100 г фасоли содержится 1000 мг данного вещества, а в арахисе примерно вдвое меньше.
Продукты, содержащие калий в достаточных нам количествах – это орехи, в особенности миндаль, фундук, кешью, грецкие и кедровые ядра.
Очень хорошо снабжают свой организм этим минералом те люди, которые любят морскую капусту, авокадо, молодой картофель в мундире. А если уж они сдабривают блюда горчицей или используют ее семена в качестве приправы, то увеличивают количество съеденного калия, так как указанное растение тоже его содержит.
Из злаков советую вам особо выделить зеленую гречку и овес. Употребление их в виде проростков улучшает усвоение калия и других питательных веществ во много раз.

Чуть не забыла назвать любимые почти всеми детьми бананы. В них калия не так уж и много – всего лишь 400 мг на 100 г веса фруктов. Однако я знаю, что многие знакомые вегетарианцы и сыроеды делают на их основе полезные зеленые коктейли, а, значит, так или иначе, пополняют свои запасы данного вещества.
Например, в свежем шпинате содержится чуть больше 700 мг интересующего нас минерала. Смешайте его в блендере с бананами, курагой и водой, и вы получите полезный и вкусный «калиевый» коктейль.
Если вы сладкоежка, то можете добывать данный минерал из настоящего шоколада, так как он в больших количествах есть в какао-бобах. Однако не стоит с этой целью приобретать промышленные плитки и батончики – в них очень много консервантов и белого сахара.
Лучше самим готовить шоколад или покупать его у сыроедов, ведь самые полезные плитки и конфетки – те, которые сделаны без агрессивной термической обработки из натуральных бобов какао или из кэроба, его полезного растительного аналога.
К слову, 100 г какао-бобов содержат около 1520 мг, а плоды рожкового дерева (кэроб) – примерно 1100 мг .
Зато у кэроба есть два явных преимущества перед его шоколадным «собратом» – это гипоаллергенный продукт, а еще он сам по себе сладкий, а значит, требует гораздо меньше подсластителя.
Теперь, когда вы пересмотрели свое привычное меню с точки зрения содержания в нем калия, самое время поговорить о том, для чего же он нам нужен.
Функции калия в организме человека
Роль калия в нашем теле действительно велика. Я уже упоминала в самом начале статьи о том, что этот труженик поддерживает каждую его клеточку, обеспечивая нормальное функционирование их стенок.

Кстати, делает он это вместе с натрием, причем их отношения удивительны. Эти два химических элемента очень близки по своим природным свойствам, но, в то же время, в живых организмах они являются антагонистами, то есть, вытесняют друг друга – этакие «заклятые друзья».
Таким образом, калий препятствует накоплению в клетках нашего организма солей натрия и, тем самым, обладает антисклеротическим эффектом.
Важно запомнить: соотношение натрия и калия в питании – 1:2.
Именно такая пропорция поможет вам удержать баланс двух этих минералов и получить все полезные свойства калия и натрия. О последнем я расскажу вам в отдельной статье, а сейчас обращаю ваше внимание на то, что дает калий вашему организму.
Для чего полезен калий?
- Поддерживает необходимый для тела уровень магния, который жизненно важен для нормальной работы сердца и ряда других процессов.
- Вместе с натрием и хлором является активным участником водно-солевого обмена в организме – обеспечивает функционирование жидкостей в нашем теле и поддерживает осмотическое давление на должном уровне.
- Наряду с кальцием, натрием и магнием принимает участие в кислотно-щелочном равновесии тела, то есть, способствует его ощелачиванию.
- Помогает глюкозе превращаться внутри нас в энергию, а она, в свою очередь, поступает в переработанном виде к мышцам, активизирует их сокращение и является профилактикой паралича.
- Поддерживая энергетический уровень тела, повышает нашу выносливость и обеспечивает силу, а также предотвращает появление хронической усталости.
- Отвечает за регулирование артериального давления и сердечного ритма.
- Участвует в транспортировке нервных импульсов по нервной системе.
- Способствует выведению из тела жидкостей, а, значит, избавляет его от отеков, помогает нормальному мочеиспусканию, поддерживает работу почек.
- В связи с предыдущим пунктом помогает нашему организму освобождаться от шлаков.
- Активизирует мозговое кровоснабжение – насыщает этот жизненно важный орган кислородом и, следовательно, улучшает его деятельность.
Как видите, влияние калия на организм человека очень велико, а потому его дефицит может плачевно отразиться на большом количестве наших органов и систем.
Как проявляется нехватка калия в организме?

Внешне недостаток калия выглядит следующим образом – у человека появляется:
- слабость в мышцах, иногда даже судороги;
- тошнота, порой доходящая до рвоты;
- постоянное чувство усталости, выражающееся в сонливости и апатичности;
- отечность;
- проблемы со стулом в виде запоров;
Также дефицит калия чреват уменьшением количества мочеиспусканий и потерей аппетита.
Мужчинам следует всегда помнить об одной очень важной особенности этого минерала:
При недостаточном количестве калия в организме инсульт с большей вероятностью может закончиться летальным исходом.
Чем может быть вызван дефицит калия?

Вы можете столкнуться с недостатком этого вещества в организме, если регулярно употребляете в пищу продукты, в которых присутствует натрий в виде консервантов или поваренной соли. Как я уже писала чуть выше, он вытесняет калий из организма, будучи его антагонистом.
Если рацион содержит недостаточно свежих овощей и фруктов, богатых калием, то организм может испытывать его дефицит.
Препятствуют всасыванию этого минерала и выводят его из организма в больших количествах мочегонные и гормональные лекарства, травы с подобным эффектом, а также спиртные напитки и кофе.
Чем опасен избыток калия в организме?

Калий может накапливаться в теле в том случае, если у человека больны почки или нарушена деятельность коры надпочечников. Естественно, аптечные лекарства, содержащие этот минерал, также могут служить причиной его переизбытка в организме.
Более того, искусственные заменители поваренной соли, которые содержат калий, также могут давать его повышенный уровень. О стойкой передозировке данного вещества нам сигнализируют следующие симптомы:
- бледность кожи;
- повышенная возбудимость;
- наличие анемии;
- сбой сердечного ритма;
- учащенное мочеиспускание;
- нарушение чувствительности рук и ног.
Так проявляются вредные свойства калия. Чтобы не допустить избытка и нехватки данного вещества в организме, важно знать, какое его количество ежедневно должно поступать именно в ваш организм с продуктами питания или в виде биологически активных добавок.
Суточная потребность в калие
Суточная норма калия для детей до полугода составляет 400 мг, от 7 до 12 месяцев – 700 мг, от года до 3 лет – 3000 мг, от 4 до 8 лет – 3800 мг, от 9 до 13 лет – 4500 мг, от 14 до 18 лет – 4700 мг.
Взрослые мужчины и женщины должны получать с пищей примерно 4700 мг данного минерала, при этом следует иметь в виду, что калий при беременности очень важен и его норма в период вынашивания, а также во время кормления малыша грудью, повышается в среднем до 5000 мг.
Также обращаю ваше внимание на то, что потребность в калии увеличивается при регулярных занятиях спортом и физических нагрузках, при стрессовых состояниях, в случае обильного потоотделения и приема мочегонных препаратов.
Из моей статьи вы узнали, в чем содержится калий и для чего нужен. А теперь я хочу поинтересоваться у вас, как вы относитесь к сухофруктам, в которых так много этого минерала: замачиваете ли вы их, теряя его, или грызете в сухом виде? Покупаете ли на рынке, рискуя здоровьем, или все же не жалеете денег на экотовары?
Источник: sunmint.ru
Характеристика и строение калия
Химия довольно интересный предмет, который изучает химические элементы и их свойства. Одним из таких уникальных элементов является калий, который таит в себе множество тайн и загадок. Не каждый из нас знает, что сталкивается с ним каждый день.

Статьи по теме:
- Характеристика и строение калия
- Какими свойствами обладают щелочные элементы
- Карбонат калия: что это такое и где его применяют
Элемент калий и его обозначение
Калий — это химический элемент системы элементов, придуманной Дмитрием Менделеевым, который находится в первой группе. Он имеет атомный номер 19 и атомную массу равную 39,098 г/моль.
По своим физическим свойствам элемент представляет из себя металл серебристо-белого цвета. Он очень пластичный и плавкий. Имеет характерный металлический блеск. Калий легко режется ножом и по твердости не уступает куску твердого сыра.
Калий состоит из трех изотопов: 39К, 41К, 40К. Два первых соединения являются стабильными, а третий считается достаточно слабым, но при всем этом радиоактивным. Период полураспада последнего соединения составляет 1,32*109 лет.
Химический элемент в химии обозначают «К».
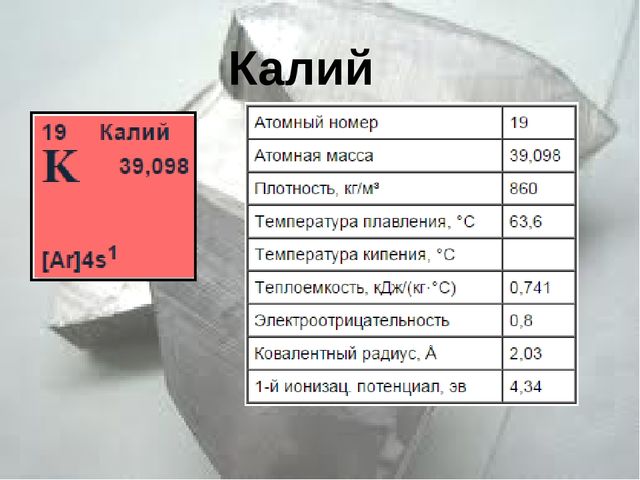
В нормальных условиях калий находится в твердом агрегатном состоянии. Температура плавления элемента равна 63 градуса, чего легко добиться при обычном нагревании. Температура же кипения элемента гораздо выше и составляет 761 градус.
Строение калия и его физико-химические свойства
Химический элемент располагается в четвертом периоде, поэтому все его электроны будут расположены на четырех энергетических уровнях. Энергетическая формула элемента выглядит следующим образом: +19К: 2ё; 8ё; 8ё; 1ё.
Графическая формула элемента выглядит соответствующим образом.
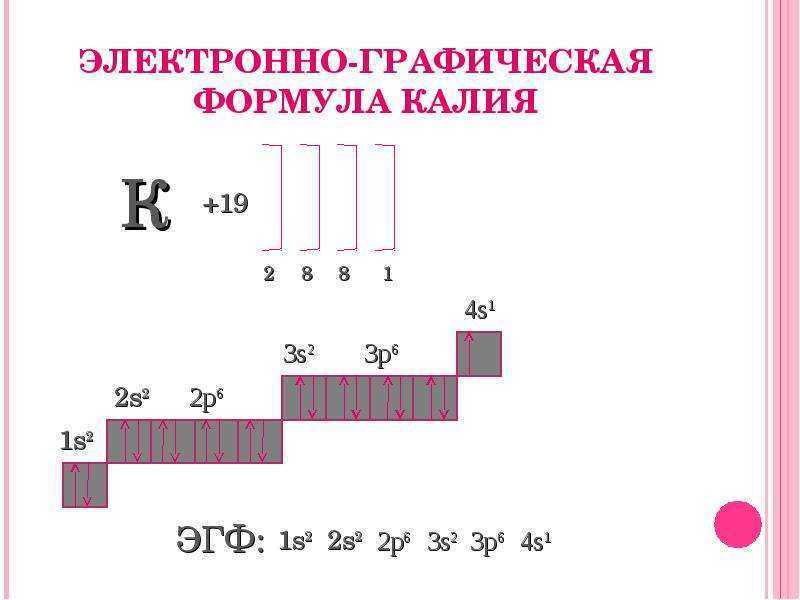
Исходя из электронного строения элемента, можно сделать вывод, что калий имеет валентность равную I. Так как в химических реакциях элемент отдает один электрон с внешнего энергетического уровня, он проявляет восстановительные свойства, приобретая степень окисления +1.
Благодаря своему расположению в таблице Менделеева, можно сказать, что восстанавливающие свойства калия выражены гораздо сильнее, чем у Na, но слабее, чем у Rb. Такая закономерность связана с увеличением атомного диаметра. Кроме этого, калий будет сильнее, чем атом кальция, так как на внешнем энергетическом уровне у кальция уже два электрона и оторвать их гораздо сложнее, чем один.
Калий по своей химической структуре является простым веществом с металлической кристаллической решеткой и металлической химической связью. Исходя их этого, можно сказать, что калий легко вступает в реакцию и очень быстро окисляется на воздухе.
Как уже было сказано, калий очень активный элемент, поэтому очень легко вступает в реакцию с окружающеми его веществами. Если оставить кусок калия на воздухе, он мновенно вступит в реакцию с воздухом.
Элемент прекрасно реагирует с кислородом, азотом, фосфором и галогенами.
Реакция окисления
Взаимодействие любых элементов с кислородом (О2) называется окислением. В результате реакции образуется оксид калия (II). В результате процесса образуется промежуточное соединение оксиген калия.

Горение
Если поджечь калий или его соединения, можно наблюдать фиолетовый цвет пламени у горелки или лучины. Благодаря этому, такая реакция является качественной на определение калия.

Реакция галогенирования
Исходя из того, с каким из элементов вступает в реакцию калий, реакции были названы: йодирование, фторирование, хлорирование и бромирование. Эти реакции являются реакциями присоединения, так как в результате образуется одно соединение. Соответственно, результатом химической реакции будут хлориды, бромиды, йодиды и фториды.
Реакция с азотом и фосфором
Калий реагирует с N2 на открытом воздухе. В результате горения образуется нитрид калия, который представляет собой соединение темно-зеленого цвета.
По такой же схеме калий взаимодействует с фосфором.
Реакция с водородом
В качестве еще одного примера реакции присоединения можно привести реакцию калия с водородом. В результате химического взаимодействия образуется гидрид калия.
Взаимодействие с комплексными соединениями
Калий способен реагировать с кислотами, солями, основаниями и оксидами. С каждым из перечисленных соединений калий вступает в реакцию по разному.
Реакция с водой
Если поместить кусочек калия в воду можно отметить бурную химическую реакцию. Калий, в буквальном смысле слова, будет провоцировать процесс кипения. В результате реакции образуется щелочь и чистый водород.

Реакция с кислотой
Взаимодействие с кислотами в данном случае можно назвать реакцией замещения, так как калий замещает атомы гидрогена из их соединений. В качестве примера можно привести реакцию калия с соляной кислотой. По такому же принципу калий реагирует с другими неорганическими кислотами.
Реакция с оксидами
Эта реакция относится к реакции обмена. Если металл в составе оксида оказывается слабее, чем калий, то элемент вытесняет его из соединения, присоединяя кислород.
Реакция с основаниями
Реакция с основаниями происходит по тому же принципу, что и взаимодействие с оксидами. Калий способен реагировать с соединениями, в которых элемент слабее, чем он сам. В результате данной реакции барий выпадает в осадок.

Реакция с солями
Химическая реакция с солями позволяет получать чистые металлы без примесей. Калий как сильный восстановитель вытесняет более слабый металл, присоединяя остаток соли к себе.
Взаимодействие с органическими соединениями
Характерной реакцией взаимодействия калия с такими соединениями является реакция с жирами. Калий вытесняет один из атомов гидрогена, образуя стеарат, пальмитат или другое соединение и водород.
Где используют калий
Как и любой металл, калий очень востребован в промышленной индустрии. Благодаря своим сильным восстановительным свойствам и высокой реактивности его используют в следующих сферах:

Роль калия для организма человека
Как уже было сказано, калий постоянно находится в непосредственной близости от человека. Будь то мыло, соль или обычный стиральный порошок. Однако, надо сказать, что калий играет незаменимую роль не только в жизни человека, но в нормальном функционировании его организма.
Калий принимает участие в передаче между нейронами импульса, тем самым регулируя нервную проводимость клеток. Совместно с ионами Na, данный элемент периодической системы регулирует водно-солевой обмен всех биологических жидкостей человека.
Гипокалиемия очень быстро дает о себе знать. Характерными симптомами дефицита калия являются:
- избыточная отечность;
- повышенная раздражительность;
- нарушение памяти;
- заторможенность реакций;
- повышает вероятность возникновения инфарктов и инсультов.
Однако, не только недостаток калия может спровоцировать негативные последствия для организма. Его избыток также губительно действует на человека. На фоне высокой концентрации калия в организме может развиваться эрозии на стенках тонкого кишечника.
Для того, чтобы контролировать уровень калия в своем организме, необходимо знать, в каких продуктах он содержится в больших количествах. К ним можно отнести:
- орехи (кедровые орехи, лесные, фундук, кешью);
- морская капуста;
- фрукты (мандарины, сладкие яблоки, дыни, арбузы, бананы)
- гречневая и перловая крупа;
- картофель;
- лук и чеснок.
- куриные яйца;
- молочные продукты (молоко, сыр, сливки, сметана).

Суточная норма потребления калия составляет 3-5 грамм для взрослого человека.
Источник: www.kakprosto.ru