Опыт 1. Влияние природы реагирующих веществ.
Налейте в три пробирки по 2 мл раствора соляной кислоты. Положите в первый стакан кусочек магния, во второй стакан — гранулу цинка, в третий – кусочек железа. Наблюдайте скорость трех реакций. Какая из реакций самая быстрая и почему?
Ответ от эксперта
Наблюдения, позволяющие судить о скорости реакции
Выделение газа наиболее бурно происходит в пробирке с магнием.
Мg + 2HCl → MgCl2 +H2↑
Zn + 2HCl → ZnCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
Скорость химической реакции зависит от природы реагирующих веществ. Магний обладает наиболее сильными восстановительными свойствами.
Источник: xn--b1aai8acvc.xn--p1acf
Реакция МАГНИЯ и СОЛЯНОЙ КИСЛОТЫ. Получение ХЛОРИДА МАГНИЯ MgCI2. Опыты по химии дома. Эксперименты
В три пробирки содержащие порошки магния железа и серебра добавили одинаковый объем соляной кислоты

ПРАКТИЧЕСКАЯ РАБОТА2.В три пробирки налейте соляной кислоты.В первую пробирку положите кусочек магния,во вторую-кусочек цинка,в третью-кусочек меди.Что наблюдаете?какая из реакций самая быстрая?
Ответ проверен экспертом
4 (52 оценки)
КSаNа 10 лет назад
Светило науки — 234 ответа — 6832 помощи
реакция с медью не протекает, т.к. медь в ряду активности металлов находится после водорода и не межет вытеснять его из кислот
реакция с магнием протекает быстрее т.к. магний более активный металл, чем цинк
Mg + 2HCl = MgCl2 + H2
Zn + 2HCl = ZnCl2 + H2
и в той и в другой реакции наблюдается выделение газа — водорода
Источник: vashurok.com
Практическая работа № 8 стр. 145 Решение экспериментальных задач
1) Различить вещества: а) MgCl2; б) NaOH; в) Na2CO3; г) NaNO3;
а) Действия: Ко всем веществам добавляем р-р соляной кислоты. Наблюдения: В одной из пробирок выделяется газ. Уравнения реакции: 
Выводы: В данной пробирке содержится карбонат натрия, т.к. протекает качественная реакция на карбонат-ион. б) Действия: Оставшиеся вещества растворяем в воде и к полученным растворам добавляем фенолфталеин. Наблюдения: В одной из пробирок раствор розовеет. Уравнения реакции:

Выводы: Раствор фенолфталеина розовеет в щелочной среде (под действиям ионов OH — ), поэтому в данной пробирке находится гидроксид натрия. в) Действия: К оставшимся растворам добавляем раствор нитрата серебра (I). Наблюдения: В одной из пробирок образовался белый осадок. Уравнения реакции:
Взаимодействие железа с соляной кислотой

Выводы: Эта реакция качественная на хлорид-ион, значит, в данной пробирке находится хлорид магния. г) Действия: К оставшемуся раствору добавляем концентрированную серную кислоту и кусочек меди. Нагреваем. Наблюдения: Выделяется газ бурого цвета, медь растворяется, а раствор становится голубого цвета. Уравнения реакции: 
Выводы: Реакция является качественной на нитрат-ион, следовательно, в данной пробирке находится нитрат натрия.
2) Различить вещества: а) CaCO3; б) Ba(NO3)2; в) Na2SO4; г) Na2S
а) Действия: Ко всем веществам добавляем р-р соляной кислоты. Наблюдения: В одной из пробирок выделяется газ без запаха, а в другой — с неприятным запахом. Уравнения реакции: 
Выводы: В пробирке, в которой выделялся газ без запаха, содержится 
т. к. это качественная реакция на карбонат-ион. Там, где выделялся газ с неприятным запахом 
содержится сульфид натрия. б) Действия: После растворения оставшихся веществ в воде добавляем раствор сульфата натрия. Наблюдения: В одной из пробирок образовался белый осадок. Уравнения реакции:

Выводы: Качественная реакция на ион бария, значит, в данной пробирке — нитрат бария. в) Действия: К оставшемуся р-ру добавляем р-р хлорида бария. Наблюдения: Образовался белый осадок. Уравнения реакции:

Выводы: Это качественная реакция на сульфат-ион, следовательно, в данной пробирке — сульфат натрия.
3) Доказать, что выданное вещество — сульфат алюминия Al2(SO4)3
а) Действия: К выданному в-ву добавляем раствор хлорида бария. Наблюдения: Выпал белый осадок. Уравнения реакции: 
Выводы: Это качественная реакция на сульфат-ион. б) Действия: К небольшому количеству раствора щелочи добавляем раствор выданного вещества. Наблюдения: Образовался белый студенистый осадок. Уравнения реакции: 
Выводы: В результате происходит образование нерастворимого основания 
за счет связывания ионов

Значит, в исследуемом веществе содержится ион алюминия. в) Действия: Добавляем избыток щелочи. Наблюдения: В избытке щелочи осадок растворяется. Уравнения реакции:

Выводы: Гидроксид обладает амфотерными свойствами: образуется матааллюминат натрия. Это еще раз доказывает, что выданное вещество содержит ион алюминия.
4) Различить растворы: NaCL, BaCl2, AlCl3
а) Действия: Ко всем растворам добавляем р-р сульфата натрия. Наблюдения: В одной из пробирок выпадает белый осадок. Уравнения реакции: 
Выводы: В данной пробирке содержится хлорид бария, т.к. эта реакция — качественная на ионы бария. б) Действия: К двум оставшимся растворам добавляем немного раствора щелочи. Наблюдения: В одной из пробирок образовался белый студенистый осадок. Уравнения реакции:

Выводы: В данной пробирке — хлорид алюминия. в) Действия: Несколько капель оставшегося раствора вносим в пламя спиртовки на нихромовой проволоке. Наблюдения: Пламя окрашивается в желтый цвет. Выводы: В данной пробирке — хлорид натрия, т.к. в желтый цвет пламя окрашивают ионы натрия.
5) Доказать, что кристаллы FeSO4 частично окислились и содержат примеси ионов Fe 3+
Действия: Растворяем кристаллы в воде и добавляем р-р 
Наблюдения: Образуется зеленый и бурый осадки. Уравнения реакции: 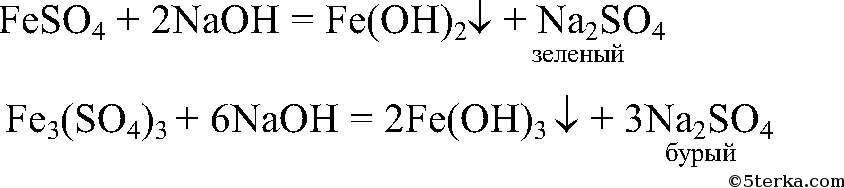
Выводы: Бурый осадок — нерастворимое основание


имеет зеленый цвет. Значит, в исходном

содержались окислившиеся ионы

6) В двух склянках дана вода. В одной из них вода содержит MgSO4, а в другой — Ca(HCO3)2. Проделать опыты, при помощи которых можно устранить постоянную и временную жесткость.
а) Действия: В воду, содержащую 
добавляем р-р 
Наблюдения: Образуется белый осадок. Уравнения реакции: 
Выводы: Ионы 
обуславливают постоянную жесткость воды. Такую воду можно умягчить, добавив раствор карбоната натрия, т. к. при этом происходит связывание ионов 
б)Действия: В воду, содержащую 
добавляем: раствор 
известковое молоко, т.е. насыщенный раствор 
кипятим ее. Наблюдения: Образуется белый осадок. Уравнения реакции: 
Выводы: Присутствие 
обуславливает временную жесткость воды. Эту воду можно умягчить добавлением известкового молока, соды или кипячением, т.к. все эти процессы сопровождаются образованием 
7) Осуществить превращения:
а) Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe(NO3)3
1. Действия: К порошку железа добавляем соляную кислоту. Уравнения реакции: 
2. Действия: После прекращения выделения газа добавляем раствор щелочи. Уравнения реакции: 
3. Действия: К осадку добавляем немного р-ра перекиси водорода. Уравнения реакции: 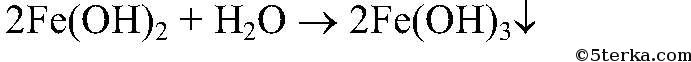
4. Действия: К осадку добавляем раствор азотной кислоты Уравнения реакции: 
б) Al → Al(SO4)3 → Al(OH)3 → NaAlO2
1. Действия: К нескольким гранулам 
добавляем р-р 
Уравнения реакции: 
2. Действия: После выделения газа добавляем щелочь (по каплям). Уравнения реакции: 
3. Действия: К осадку добавляем избыток щелочи. Уравнения реакции: 
Источник:

Решебник по химии за 9 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 1999 год),
задача №0
к главе «Лабораторные и практические работы».
Источник: 5terka.com