Впервые ванадий был фактически открыт в 1781 г. профессором минералогии из Мехико Андресом Мануэлем Дель Рио в свинцовых рудах. Он обнаружил новый металл и предложил для него название «панхромий» из-за широкого диапазона цвета его соединений, сменив затем на «эритроний». Дель Рио не имел авторитета в научном мире Европы, и европейские химики усомнились в его результатах. Затем и сам Дель Рио потерял уверенность в своём открытии и заявил, что открыл всего лишь хромат свинца.
В 1830 году ванадий был открыт заново шведским химиком Нильсом Сефстрёмом в железной руде. Новому элементу название дали Фридриха Вёлера , исследовавшего мексиканскую руду, но он незадолго до открытия Сефстрёма серьёзно отравился фтороводородом и не смог продолжить исследования. Однако Вёлер довёл до конца исследование руды и окончательно доказал, что в ней содержится именно ванадий, а не хром.
Происхождение названия [ ]
Этот элемент образует соединения с красивой окраской, отсюда и название элемента, связанное с именем скандинавской богини красоты Нахождение в природе [ ]
Ванадий — Металл — ХАМЕЛЕОН, Меняющий цвет!
в природе ванадий в свободном виде не встречается, относится к рассеянным элементам. Содержание ванадия в земной коре 1,6·10 -2 % по массе, в воде океанов 3·10 -7 %. Важнейшие минералы: патронит V(S2)2, ванадинит Pb5(VO4)3Cl и некоторые другие. Основной источник получения ванадия — железные руды, содержащие ванадий как примесь.
Получение [ ]
Первичный концентрат восстанавливают в доменных печах и получают концентрат ванадия, который далее используют при выплавке сплава ванадия и железа — так называемого феррованадия (содержит от 35 до 80% ванадия). Металлический ванадий можно приготовить восстановлением хлорида ванадия водородом (H), кальцийтермическим восстановлением оксидов ванадия (V2O5 или V2O3), термической диссоциацией VI2 и другими методами
Физические свойства [ ]
Ванадий по внешнему виду похож на сталь, это достаточно твердый, но вместе с тем пластичный металл.
Химические свойства [ ]
Химически ванадий довольно инертен. Он стоек к действию морской воды, разбавленных растворов соляной, азотной и серной кислот, щелочей.
Соединения ванадия в степенях окисления +2 и +3 — сильные восстановители, в степени окисления +5 проявляют свойства окислителей. Известны тугоплавкий карбид ванадия VC (tпл=2800 °C), нитрид ванадия VN, сульфид ванадия V2S5, силицид ванадия V3Si и другие соединения ванадия.
При взаимодействии V2O5 с основными оксидами образуются ванадаты — соли ванадиевой кислоты вероятного состава H2[O(V2O5)2].
Применение [ ]
80 % всего производимого ванадия находит применение в сплавах, в основном для нержавеющих сталей.
Атомно-водородная энергетика [ ]
Хлорид ванадия применяется при термохимическом разложении воды в атомно-водородной энергетике (ванадий-хлоридный цикл «Дженерал Моторс»,США).
Химические источники тока [ ]
Пятиокись ванадия широко применяется в качестве положительного электрода(анода) в мощных литиевых батареях и аккумуляторах. Ванадат серебра в резервных батареях в качестве катода.
371) Материаловедение метал ВАНАДИЙ
Биологическая роль и воздействие [ ]
Избыточное поступление ванадия в организм обычно связано с экологическими и производственными факторами. При остром воздействии токсических доз ванадия у рабочих отмечаются местные воспалительные реакции кожи и слизистых оболочек глаз, верхних дыхательных путей, скопление слизи в бронхах и альвеолах. Возникают и системные аллергические реакции типа астмы и экземы; а также лейкопения и анемия, которые сопровождаются нарушениями основных биохимических параметров организма.
При введении ванадия животным (в дозах 25-50 мкг/кг), отмечается замедление роста, диарея и увеличение смертности.
Всего в организме среднего человека (масса тела 70 кг) 0,11 мг ванадия. Ванадий и его соединения токсичны. Токсическая доза для человека 0,25 мг, летальная доза — 2-4 мг.
Изотопы [ ]
Природный ванадий состоит из двух Период полураспада ванадия-50 равен 1,5×10 17 лет, т. е. для всех практических целей его можно считать стабильным; этот изотоп в 83 % случаев посредством Ti, а в 17 % случаев испытывает бета-минус-распад , превращаясь в 50 Cr. Известны 24 искусственных радиоактивных изотопа ванадия с T1/2=330 дней) и 48 V (T1/2=15,974 дня).
См. также [ ]
- Категория:Соединения ванадия
- Ссылки [ ]

| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | Xe | |
| Cs | Ba | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | |
| Uue | Ubn | ||||||||||||||||
| La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
| Это незавершённая статья о химическом элементе. Вы можете помочь проекту, исправив и дополнив её. |
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Ванадий. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
Источник: vlab.fandom.com
Тугоплавкий металл ванадий
Ванадий (V) — химический элемент пятой группы периодической системы Д.И. Менделеева, атомный номер 23, атомная масса 50,94. Металл серебристого оттенка, внешне напоминающий сталь, относится к классу тугоплавких. Имеет плотность 6,11 г/см 3 , температуру плавления tпл. = 1887 °С, температуру кипения tкип.
= 3377 °С. Обладает хорошей прочностью и пластичностью.
Описываемый химический элемент относится к редким тугоплавким металлам. Целиком находится в рассеянном состоянии и не образует собственных минералов. Основные источники получения ванадия — железные руды, содержащие V как примесь.
История открытия
Впервые ванадий был открыт мексиканским ученым профессором минералогии Андресом Мануэлем Дель Рио и получил название “эритроний”. Однако, это открытие не было признано европейским научным миром. Повторно об обнаружении нового химического элемента было объявлено шведским химиком Нильсом Сефстремом, который нашел его в железной руде.
Свойства ванадия
Физические свойства
| Атомный номер | 23 |
| Атомная масса, а.е.м | 50,94 |
| Радиус атома, пм | 134 |
| Плотность, г/см³ | 6,11 |
| Молярная теплоемкость, Дж/(K·моль) | 24,95 |
| Теплопроводность, Вт/(м·K) | 30,7 |
| Температура плавления, °С | 1887 |
| Температура кипения, °С | 3377 |
| Теплота плавления, кДж/моль | 17,5 |
| Теплота испарения, кДж/моль | 460 |
| Молярный объем, см³/моль | 8,35 |
| Группа металлов | Тугоплавкий металл |
Химические свойства
| Ковалентный радиус, пм | 122 |
| Радиус иона, пм | (+5e) 59 (+3e) 74 |
| Электроотрицательность (по Полингу) | 1,63 |
| Электродный потенциал | |
| Степени окисления | 5, 4, 3, 2, 0 |
Марки ванадия и сплавов
Достоинства / недостатки
-
Достоинства:
- имеет высокую температуру плавления;
- имеет хорошие технологические и механические свойства — хорошая пластичность и свариваемость, прочность;
- имеет меньшую стоимость по сравнению с другими металлами со схожими характеристиками.
-
Недостатки:
- относительно небольшой процент содержания в земной коре.
Области применения ванадия
Ванадий и его соединения находят применение во множестве промышленных отраслей, однако наибольший их объем востребован для нужд металлургической и химической промышленности.
Основная доля мирового потребления ванадия – примерно 87% – приходится на металлургическую промышленность (80% + 7% – черная и цветная металлургия соответственно). Рассматриваемый металл применяется в основном для легирования высококачественных конструкционных сталей с целью оптимизации их эксплуатационных характеристик. По данным статистики, в настоящее время V является мировым лидером среди легирующих элементов.
Ванадию присуща высокая химическая активность, определяющая возможность его применения в различных промышленных отраслях, включая химическую. Для нужд химической промышленности используется множество соединений этого металла, прежде всего, соли ванадиевых кислот (ванадаты), оксиды и карбиды ванадия. Конкретными примерами использования V являются производство красителей и получение катализаторов. Неоспоримо преимущество ванадия при производстве высококачественного инструмента, выполненного из различных хром-ванадиевых сталей.
Продукция из ванадия
Современное промышленное производство предлагает широкий спектр стандартных изделий, активно используемых в различных областях. Из круглого проката можно выделить ванадиевый пруток и проволоку. Плоский прокат представляет ванадиевый лист и полоса. К исходному сырью можно отнести слитки и порошок ванадия, которые занимают основополагающее место в цепочке производства изделий из данного металла.
телефоны:
8 (800) 200-52-75
(495) 366-00-24
(495) 504-95-54
(495) 642-41-95
Источник: www.metotech.ru
Ванадий — красивый и востребованный металл

Ванадий — металл, простое химическое вещество, элемент таблицы Менделеева. Впервые был открыт мексиканским химиком Андресом Дель Рио в 1801-м году. Но перед европейскими учеными свое открытие он отстоять не смог, и вторично металл был открыт спустя 30 лет шведом Нильсом Сефстрёмом. Название новый элемент получил по имени богини любви и красоты Ванадис из-за того, что на воздухе на поверхности металла образуется красивая пленка из разноцветных оксидов.
Ванадия на планете достаточно много, но он крайне рассеян и не встречается в чистом виде. В очень небольших количествах входит в состав более чем сорока минералов. Больше всего его в роскоэлите, карнотите и ванадините. Его относительно много также в патроните, деклуазите. Часто встречается в качестве сопутствующего элемента в рудах, содержащих другие металлы.
Добывают его большей частью из железных, медно-свинцово-цинковых, титаномагнетитовых, урановых руд, сланцев и т.п. Ванадий выделяют из отходов после добычи основного металла. Руды, содержащие 1% ванадия, считаются очень богатыми. Оправдана добыча из сырья, в котором элемента всего 0,1%.
Это интересно
Ванадий накапливается некоторыми видами морских организмов — голотуриями и асцидиями, причем в значительных количествах. Японцы решили использовать эту особенность. Они выращивают на подводных плантациях асцидий вида Pyura chilensis, больше всего похожих на камни, с очень твердой внешней оболочкой серого цвета. Потом их сжигают и из золы добывают ванадий. Содержание металла в золе может достигать 5% — это много больше, чем в большинстве ванадиесодержащих руд.
 |
 |
| Государственный стандартный образец состава раствора ионов «Ванадий (V)» |
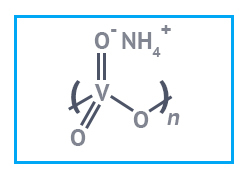
Аммоний ванадиевокислый мета |
Светло-серый, серебристый металл, внешне напоминающий сталь. Пластичный и ковкий, легко обрабатывемый давлением и прокатом. При нагревании выше +300 °С теряет пластичность, становится хрупким, поэтому резать и сверлить его можно только в определенных условиях. Очень тугоплавкий, температура плавления +1887 °C. На воздухе окисляется, образуя пленку из оксидов разных цветов.
В химических реакциях малоактивен, устойчив к воздействию воды, в том числе морской, неконцентрированных кислот и щелочей. Образует несколько оксидов с разной валентностью. При определенных условиях взаимодействует с кислородом, водородом, азотом, углеродом, галогенами. С помощью различных химических преобразований получают соли ванадиевой кислоты, называемые ванадатами.
Ванадий в качестве микроэлемента участвует в метаболизме живых существ, включая человека, но его избыток вреден, так как соединения реактива ядовиты. Острое отравление вызывает воспаление слизистых дыхательных путей, глаз, кожи. В дальнейшем могут развиться лейкемия, анемия, аллергии, кожные заболевания, нарушения обменных процессов в организме.

- Легирующая добавка для получения биметаллов; жаростойких, ударопрочных, стойких к коррозии, износостойких, но легких сталей для авиационной, космической, машиностроительной и военной промышленности; для выпуска высококачественных ручных и механизированных инструментов. Легируют ванадием также алюминий, медь, никель, титан, тантал, ниобий, хром и даже золото, получая прочные и химически стойкие материалы для разных отраслей. Например, сплав никеля и ванадия используется для изготовления лабораторной посуды.
- В производстве анодов для мощных литиевых аккумуляторов (пятиокись ванадия); катодов для химических батарей.
- Для изготовления труб ТВЭЛов ядерных атомно-водородных реакторов на быстрых нейтронах.
- В качестве пигментов для производства красок, цветного стекла, керамики.
- Для получения анилиновых красителей и индиго, необходимых для окрашивания тканей из шелка и хлопка.
- Катализатор в синтезе серной кислоты. Ванадий значительно дешевле платины, которую применяли для этих целей раньше.
- Катализатор в процессах крекинга нефти, производства уксусной кислоты, в других промышленных синтезах.
- Хлорид ванадия используется в термическом разложении воды.
- В сельском хозяйстве применяются ядохимикаты и микроудобрения на основе ванадия.
- Для производства компонентов компьютеров, электронных и запоминающих устройств.
- В медицине, военном деле.
Источник: pcgroup.ru