Все соединения щелочных металлов определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
Качественные реакции на катионы
Красное окрашивание Розовое окрашивание
Растворимые сульфаты, серная кислота.
Пламя спиртовки.
Белый мелкодисперсный осадок BaSO4, нерастворимый в H2O и HNO3.
Желто-зеленая окраска пламени.
Растворимые хлориды, соляная кислота
Белый творожистый осадок AgCl, нерастворимый в H2O и HNO3
Раствор щелочи, нагревание, влажная фильтровальная бумажка, пропитанная лакмусом или фенолфталеином; палочка, смоченная HCl(конц)
Специфический запах аммиака. Изменение окраски бумажки. Палочка, смоченная HCl(конц) «дымит»
Растворы щелочи, кислоты
Белый осадок Al(OH)3, растворимый в кислоте в избытке щелочи
Растворы щелочи, кислоты
Белый осадок Zn(OH)2, растворимый в кислоте в избытке щелочи
Белый осадок Mg(OH)2, нерастворимый в избытке щелочи
Растворы щелочи, кислоты
Русский язык 5 класс (Урок№55 — Повторение и обобщение материала по теме «Лексикология».)
Cеро-зеленый осадок Cr(OH)3, растворимый в кислоте в избытке щелочи
Раствор красной кровяной соли K3[Fe(CN)6]
Раствор роданида аммония NH4CNS
Раствор желтой кровяной соли K4[Fe(CN)6]
Кроваво-красное окрашивание раствора Образование берлинской лазури Fe4[Fe(CN)6]3
Раствор щелочи с последующим нагреванием
Ярко-голубой студенистый осадок, нерастворимый в избытке щелочи, разлагающийся при нагревании на черный осадок CuO и воду
Качественные реакции на анионы
Раствор нитрата серебра AgNO3
Белый творожистый осадок, нерастворимый в H2O и HNO3
Раствор нитрата серебра AgNO3
Светло-желтый осадок, нерастворимый в H2O и HNO3
Раствор нитрата серебра AgNO3
Желтый осадок, нерастворимый в H2O и HNO3
Концентрированная серная кислота и медная стружка при нагревании
Бурый газ (NO2), голубая окраска раствора
Раствор соли бария
Белый мелкодисперсный осадок, нерастворимый в H2O и HNO3
Газ с резким специфическим запахом
Раствор соли свинца
Газ без цвета и запаха, не поддерживает горение
Раствор нитрата серебра в слабощелочной среде
Желтый осадок, растворимый в HNO3
Качественные реакции органическиx веществ
Вещество, функциональная группа
Непредельные углеводороды (алкены, алкины, диены), кратные связи
аммиачный р-р Ag2O
образование осадка желтого цвета (взрывоопасен)
образование тяжелой жидкости светло-желтого цвета с запахом горького миндаля
Фенол (карболовая кислота)
р-р FeCl3 (светло-желтый)
окрашивание р-ра в фиолетовый цвет
насыщенный р-р Br2 (бромная вода)
образование белого осадка со специфическим запахом
р-р хлорной извести CaOCl2 (бесцветный)
окрашивание р-ра в фиолетовый цвет
насыщенный р-р I2 + р-р NaOH
C2H5OH + I2 + NaOH → CHI3↓ + HCOONa + NaI + H2O
образование мелкокристаллического осадка СНI3 светло-желтого цвета со специфическим запахом
IV четверть Химия 7 класс Практическая работа №4
CuO (прокаленная медная проволока)
выделение металлической меди, специфический запах ацетальдегида
Гидроксогруппа (спирты, фенол, гидроксикислоты)
выделение пузырьков газа (Н2), образование бесцветной студенистой массы
Эфиры (простые и сложные)
Н2О (гидролиз) в присутствии NaOH при нагревании
Многоатомные спирты, глюкоза
Свежеосажденный гидроксид меди (II) в сильно щелочной среде
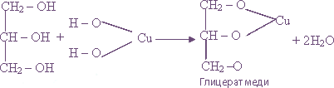
ярко-синее окрашивание р-ра
Карбонильная группа – СНО (альдегиды, глюкоза)
Аммиачный р-р Ag2O
образование блестящего налета Ag («серебряное зеркало») на стенках сосудов
образование красного осадка Сu2O
окрашивание р-ра в розовый цвет
специфический запах образующегося сложного эфира
образование красного осадка Сu2O
Аммиачный р-р Ag2O
«серебряное зеркало» на стенках сосуда
р-р KMnO4 (розовый) или I2 (бурый) или Br2 (желтый)
Ацетаты (соли уксусной кислоты)
окрашивание р-ра в красно-бурый цвет
Стеарат натрия (мыло)
Н2О (гидролиз) + фенолфталеин
окрашивание р-ра в малиновый цвет
насыщенный р-р соли кальция
образование серого осадка
Концентрированная неорганическая кислота
образование белого осадка
запах «паленого», жженых перьев
ксантопротеиновая реакция (происходит нитрование бензольных колец в молекуле белка)
без нагревания – появляется желтое окрашивание р-ра; при нагревании и добавлении раствора аммиака белок окрашивается в желтый цвет
биуретовая реакция (образуется комплексное соединение)
сине-фиолетовое окрашивание р-ра
Источник: examchemistry.com
Вещество вступающее в реакцию серебряного зеркала и окрашивающее раствор лакмуса в красный цвет это
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ГДЗ ХИМИЯ 9 КЛАСС Еремина В.В. Кузьменко Н.Е. Дроздова А.А. Лунина В.В. §12 Кислотность среды. Водородный показатель РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение , а фиолетовым ― объяснение.
Задание 2
Из приведённого списка NaCl, HCl, NaOH, HNO3, H3PO4, H2SO4, Ba(OH)2, H2S, KNO3 выпишите формулы веществ, растворы которых имеют среду:
а) кислотную;
HCl, HNO3, H3PO4, H2SO4, H2S
б) щелочную.
NaOH, Ba(OH)2.
Задание 3
Дождевая вода имеет pH=5,6. Что это значит? Среда раствора слабокислотная.
Какое вещество, содержащееся в воздухе, при растворении в воде создаёт эту среду? Углекислый газ.
В воздухе содержится углекислый газ (объемная доля около 0,03%), который с водой образует слабую угольную кислоту :
СО2 + Н2О = Н2СО3
Задание 4
В состав каменного угля, используемого на теплоэлектростанциях, входят соединения азота и серы. Выброс в атмосферу продуктов его сжигания приводит к выпадению кислотных дождей, содержащих небольшие количества азотной или серной кислот. Какие значения pH имеет кислотная дождевая вода – больше или меньше 7,0? Меньше 7,0.
Задание 5
Зависит ли pH раствора сильной кислоты от её концентрации? Не зависит от концентрации, т.к. степень диссоциации сильной ктслоты близка к единице и любой такой раствор имеет сильнокислотную среду.
Задание 6
Какую окраску имеет лакмус в растворах:
а) NaOH;
Синюю окраску (окраску сильнощелочной среды) .
б) HCl;
Красную окраску (окраску сильнокислотной среды).
в) NaCl?
Фиолетовую окраску (окраску нейтральной среды) .
Задание 7
Напишите уравнение диссоциации гидроксида бария.
Ba(OH)2 ⟶ Ba 2+ + 2OH —
Какой цвет имеют лакмус, фенолфталеин и метилоранж в растворе этого вещества? В растворе гидроксида бария лакмус имеет синий цвет, фенолфталеин ― малиновый, метилоранж ― желтый.
Задание 8
В двух пробирках находятся растворы азотной кислоты и нитрата калия. Какой индикатор нужно использовать, чтобы определить, где находится раствор соли? Нужно использовать индикаторы лакмус или метилоранж, которые в отличие от фенолфталеина, в растворе азотной кислоты изменят свою окраску и дадут возможность определить раствор соли.
Задание 9
В трёх пробирках находятся растворы гидроксида бария, азотной кислоты и нитрата кальция. Как с помощью одного реактива можно распознать эти растворы? Лакмус в растворе гидроксида бария становится синим, а в растворе азотной кислоты ― красным. Раствор соли нитрата кальция не изменяет цвет индикатора, поэтому лакмус останется фиолетовым.
Задание 10
К раствору, содержащему 1 моль гидроксида калия, прилили фенолфталеин. Изменится ли окраска раствора, если к нему затем добавить соляную кислоту, содержащую:
а) 0,5 моль;
Не изменится.
б) 1 моль;
Изменится (обесцветится).
в) 1,5 моль HCl?
Изменится (обесцветится).
Уравнение реакции: KOH + HCl = KCl + H2O
На соотношение количества вещества реагентов указывают коэффициенты химического уравнения, поэтому в реакцию нейтрализации вступают щёлочь и кислота одинакового количества вещества.
а) с 0,5 моль соляной кислоты прореагирует 0,5 моль гидроксида калия, следовательно, 0,5 моль щёлочи останется в растворе, поэтому цвет фенолфталеина не изменится.
б) с 1 моль гидроксида калия прореагирует 1 моль соляной кислоты, следовательно, среда станет нейтральной и фенолфталеин обесцветится.
в) с 1 моль гидроксида калия прореагирует 1 моль соляной кислоты и в растворе останется 0,5 моль кислоты, следовательно, среда станет кислой и фенолфталеин приобретет цвет обесцветится.
Задание 11
Имеются три раствора одинаковой концентрации: KOH, HNO3, H2S. Расположите их в порядке увеличения pH раствора. HNO3, H2S, KOH.
Ответ подтвердите уравнениями электролитической диссоциации.
HNO3 ⟶ H + + NO3 —
H2S ⇄ H + + HS —
KOH ⟶ K + + OH —
- Еремин Химия 9 класc 2019
- 2021-09-21
Источник: gdz.cool
Вещество реакцию серебряного зеркала окрашивающее раствором лакмуса в красный цвет,вытесняющее угольную
Вещество реакцию «серебряного зеркала» окрашивающее раствором лакмуса в красный цвет,вытесняющее угольную кислоту из солей,, это- а)метилформиат, б)этиловый спирт, в)уксусная кислота, г)муравьиная кислота. напишите уравнения описанных реакций.
Химия 20.03.2021 13:39
Ответы
4,5(60 оценок)

Я не знаю на счет «вытесняющее угольную кислоту из солей», но по всей видимости это муравьиная кислота.
4,7(47 оценок)
0 және оның ішінде қазақ тілі терминдер сөздігі және оның ішінде қазақ тілі терминдер сөздігі және оның ішінде
Источник: 0tvet.com