Кетоны — органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами.
Общие формулы: R 2 C=O, R–CO–R’ или
R, R’ = алкил, арил
Модели простейших карбонильных соединений
СH 3 -CH=O
(СH 3 ) 2 C=O
Номенклатура кетонов
Систематические названия кетонов несложного строения производят от названий радикалов (в порядке увеличения) с добавлением слова кетон ( радикально-функциональная номенклатура ИЮПАК). Например:
CH3–CO–CH3 — диметил кетон (ацетон);
В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он ; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе (заместительная номенклатура ИЮПАК). Примеры:
CH3–CO–CH3 — пропан он (ацетон);
Изомерия кетонов:
углеродного скелета (c C5)
положения карбонильной группы (c C5)
межклассовая изомерия (аналогично альдегидам).
Химические свойства кетонов
Альдегиды и кетоны
Полимеризация — частный случай реакций присоединения — характерна в основном для альдегидов. Например, при стоянии 40% водного раствора формальдегида (формалина), в виде белого осадка образуется полимер формальдегида с невысокой молекулярной массой — параформ:
Образование полимеров можно рассматривать как результат нуклеофильной атаки атомом кислорода одной молекулы альдегида карбонильного атома углерода другой молекулы.
Полимеры альдегидов довольно неустойчивы: в кислой среде они гидролизуются с образованием исходных продуктов.
При взаимодействии молекул альдегидов возможно также образование циклических соединений. Например, тримеризация формальдегида приводит к образованию триоксана (триоксиметилена):
Триоксан используется для получения полиформальдегида (полиоксиметилена) с высокой молекулярной массой, обладающего повышенной стабильностью и механической прочностью.
Конденсацией называется реакция, приводящая к усложнению углеродного скелета и возникновению новой углеродной связи, причем из двух или более относительно простых молекул образуется новая, более сложная молекула . Обычно в результате реакции конденсации выделяется молекула воды или другого вещества.
Конденсация, приводящая к образованию высокомолекулярных соединений, называется реакцией поликонденсации.
Источник: sites.google.com
Физические и химические свойства альдегидов и кетонов

В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) — газ, альдегиды С2–C5 и кетоны С3–С4 — жидкости, высшие — твердые вещества.
Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Химические свойства
Для карбонильных соединений характерны реакции различных типов:
· присоединение по карбонильной группе;
· восстановление и окисление.
Большинство реакций альдегидов и кетонов протекает по механизму нуклеофильного присоединения (AN) по связи С=О.
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Это объясняется, главным образом, двумя факторами:
· углеводородные радикалы у группы С=О увеличивают пространственные препятствия присоединению к карбонильному атому углерода новых атомов или атомных групп;
· углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на карбонильном атоме углерода, что затрудняет присоединение нуклеофильного реагента.
1. Присоединение водорода (восстановление):
R-CH=O + H2 t,Ni → R-CH2-OH (первичный спирт)
2. Присоединение циановодородной кислоты (синильной):
Эта реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH(COOH)OH по схеме:
CH 3— CH ( CN )- OH циангидрин –яд! в ядрах косточек вишен, слив
3. Со спиртами – получают полуацетали и ацетали:
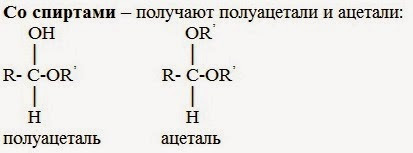
Полуацетали — соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
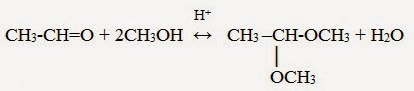
Ацетали — соединения, в которых атом углерода связан с двумя алкоксильными
4. Присоединение воды:

5. Присоединение реактива Гриньяра (используется для получения первичных спиртов, кроме метанола):
R-X ( р — р в диэтиловом эфире ) + Mg стружка → R-Mg-X ( реактив Гриньяра ) + Q
Здесь R – алкильный или арильный радикал; Х – это галоген.
HCH = O + CH 3— Mg — Cl → CH 3— CH 2— O — Mg — Cl (присоединение)
CH 3— CH 2— O — Mg — Cl + H 2 O → CH 3— CH 2— OH + Mg ( OH ) Cl (гидролиз)
6. Взаимодействие с аммиаком
1. Реакция серебряного зеркала – качественная реакция на альдегидную группу:
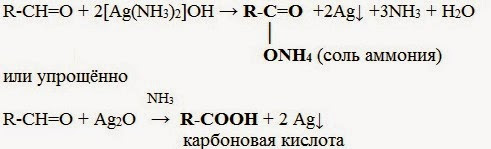
Кетоны не вступают в реакцию «серебряного зеркала». Они окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. При этом происходит разрыв С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот меньшей молекулярной массы.
2. Окисление гидроксидом меди( II ):
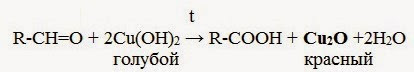
3. Альдегиды могут быть окислены до кислот бромной водой
С галогенами:
здесь , ClCH2-CH=O — хлоруксусный альдегид
n CH2=O t,kat → ( -CH2-O-)n полиформальдегид
n H — CH = O + ( n +1) C 6 H 5— OH t , kat → nH 2 O + [- C 6 H 3( OH )- CH 2— C 6 H 3( OH )-] n фенолформальдегидная смола
Источник: www.yoursystemeducation.com
Реакция серебряного зеркала с ацетоном уравнение реакции
Опыт 1. Реакция «серебряного зеркала».
Условия выполнения работы:
В пробирку налили 1 мл формалина и добавили немного аммиачного раствора оксида серебра. Пробирку нагрели. Наблюдаем осаждение серебра на стенках и дне пробирки. Поверхность стекла становится отражающей, так как серебро обладает высокой отражающей способностью. На этом построен принцип изготовления зеркал, отсюда и название реакции «реакция серебряного зеркала».
Опыт 2. Окисление бензальдегида кислородом воздуха.
Условия выполнения работы:
Каплю бензальдегида поместили на предметное стекло и оставили на воздухе на 30 мин. Наблюдаем образование белых кристаллов по краям капли. Произошла реакция окисления, образовалась бензойная кислота:
Опыт 3. Получение ацетона из ацетата натрия.
Условия выполнения работы:
В пробирку поместили небольшое количество (щепотка) порошка ацетата натрия и закрыли пробкой с газоотводной трубкой. Пробирку укрепили на штативе. Конец газоотводной трубки опустили в пробирку с водой. Пробирку с ацетатом натрия нагрели. Наблюдаем выделение пузырьков газа в пробирке с водой и чувствуется специфический запах ацетона.
Реакция серебряного зеркала с ацетоном уравнение реакции
Ацетон — простейший представитель насыщенных кетонов.
Физические свойства
Ацетон (пропанон-2, диметилкетон) СН3-СО-СН3 — летучая бесцветная жидкость с характерным запахом и температурой кипения 56 0 С.

Ацетон легче воды, смешивается с ней в любых соотношениях, хорошо растворяется спирте и эфире.
Он хорошо растворяет многие органические вещества (жиры, смолы, ацетилцеллюлозу, воск, резину и др.), поэтому является незаменимым растворителем в быту и в лакокрасочной промышленности.
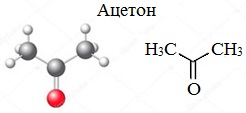
Ацетон встречается в организме человека. Он является промежуточным продуктом обмена веществ. Незначительное количество ацетона, образующееся в организме человека в результате метаболических реакций, выводится вместе с мочой. У больных диабетом следы ацетона можно обнаружить в выдыхаемом воздухе.
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины.
Токсичность ацетона
Ацетон обладает возбуждающим и наркотическим действием, поражает центральную нервную систему. Ацетон способен накапливаться в организме, т.к. медленно выводится из организма. Он может поступать в организм с вдыхаемым воздухом, а также через пищевой канал и кожу.
После поступления ацетона в кровь часть его переходит в головной мозг, селезенку, печень, поджелудочную железу, почки, легкие и сердце. Содержание ацетона в указанных органах несколько меньшее, чем в крови.
При вдыхании паров ацетона происходит кислородное голодание мозга. Поэтому, в помещениях, в которых происходит испарение ацетона, создается опасность отравления при вдыхании его паров.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов.
Ацетон, как и все кетоны, не дает реакции «серебряного зеркала», не полимеризуется. В этом его отличие от альдегидов.
1. Гидрирование (восстановление)
При тех же условиях, что и формальдегид, ацетон присоединят водород:
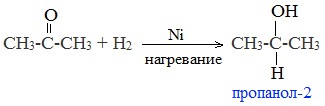
Водород присоединяется вследствие разрыва двойной связи карбонильной группы.
2. Взаимодействие с гидросульфитом натрия
Ацетон один из немногих кетонов образует бисульфитное соединение:
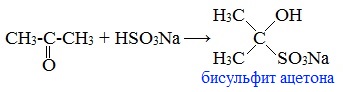
3. Альдольная конденсация
Под действием щелочей ацетон вступает в альдольную самоконденсацию, с образованием «ацетонового» (диацетонового) спирта:
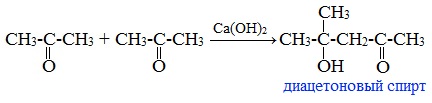
4. Взаимодействие с синильной кислотой
Одной из наиболее важных реакций ацетона является присоединение к нему синильной кислоты с образованием ацетонциангидрина:
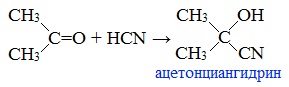
5. Пиролиз ацетона
При нагревании выше 500 0 C ацетон распадается на кетен и метан:
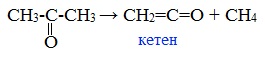
6. Галоформная реакция (иодоформная реакция, или проба Люголя)
Качественная реакция на ацетон!
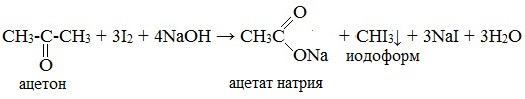
При взаимодействии ацетона с избытком йода в щелочной среде образуется йодоформ – желтое вещество с характерным запахом:
Аналогичные реакции идут с хлором и бромом, но только реакция с йодом приводит к нерастворимому йодоформу.
7. Взаимодействие с нитропруссидом натрия
Качественная реакция на ацетон!
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску . При подкислении уксусной кислотой CH3COOH окраска переходит в красно-фиолетовую :
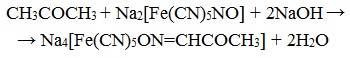
Йодоформная реакция и реакция с нитропруссидом натрия используются для обнаружения ацетона в моче при сахарном диабете.
Получение
Ацетон получают в больших количествах различными методами: при сухой перегонке дерева, разложением ацетата кальция, окислением пропена, «кумольным» способом, окислением изопропилового спирта, гидратацией ацетилена водяным паром.
1.Кумольный способ