Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
- Обратная связь
- Правила сайта
Источник: www.soloby.ru
РТ по химии 2 этап | 2022-2023 | Часть 2
1.4. Расчет растворимости осадков в присутствии одноименных ионов
Пример 6. Вычислить концентрацию ионов серебра в насыщенном растворе хлорида серебра, к 1 л которого прибавлено:
а) 1 ∙ 10 –4 моля КС1; б) 0,1 моля KCl.
a) Хлорид-ионы образуются при диссоциации хлорида серебра и при диссоциации хлорида калия. Тогда будем иметь:
Так как [Ag + ] = [Cl – ]AgCl, то
[Ag + ] 2 + [С1 – ]КСl ∙ [Аg + ] – 1,56 ∙ 10 –10 = 0
Подставляя значение концентрации КСl и решая квадратное уравнение, получим:
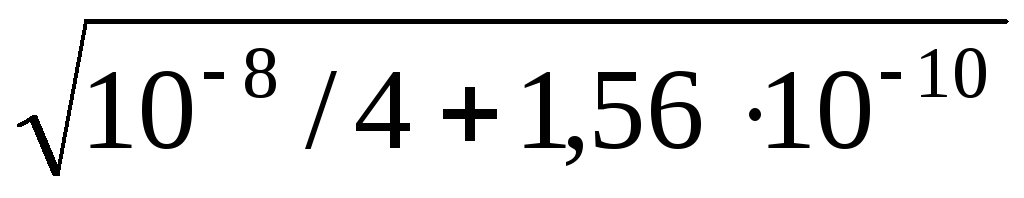
[Ag + ] = –10 –4 /2 + = 1,54 ∙ 10 –6 моль/л.
б) В данном случае значение [С1 – ]КС1 существенно превышает величину [Cl – ]AgCl, поэтому величиной [Cl – ]AgCl можно пренебречь. Тогда будем иметь
1.5. Расчет растворимости осадка в присутствии разноименных ионов (солевой эффект)
Пример 7 поможет Вам при решении задач № 44–50.
Пример 7. Вычислить растворимость хлорида серебра в 0,01 М растворе Ca(NO3)2.
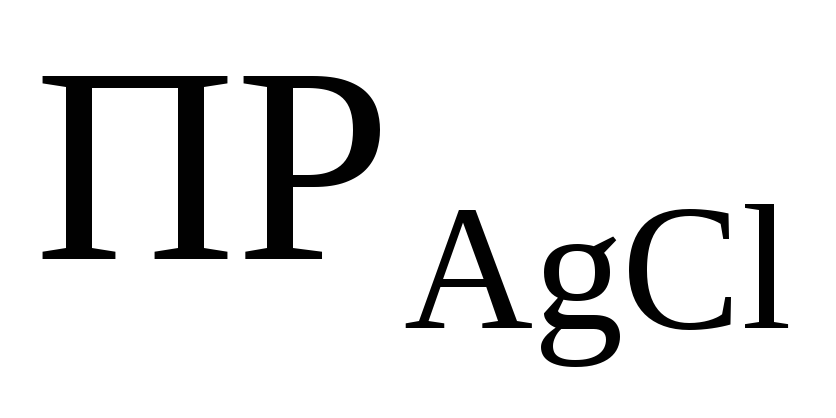
Решение. При решении данной задачи необходимо учитывать солевой эффект. Запишем с учетом коэффициентов активности:
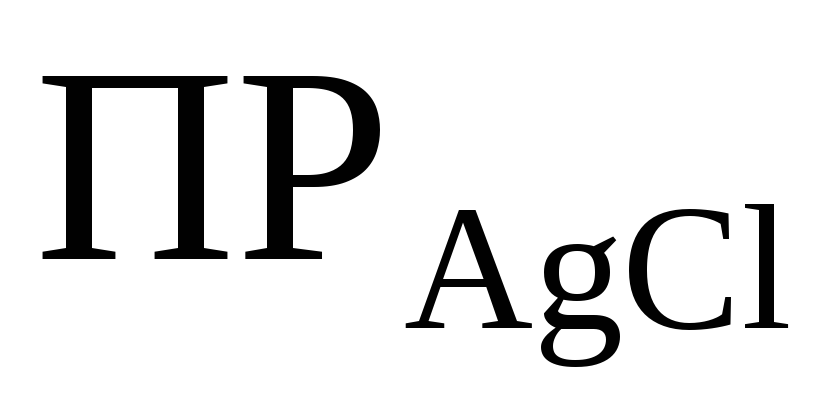 =
= 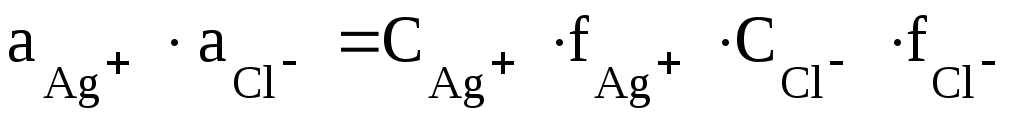 .
.
Если обозначить концентрацию хлорида серебра через x моль/л, то можно записать
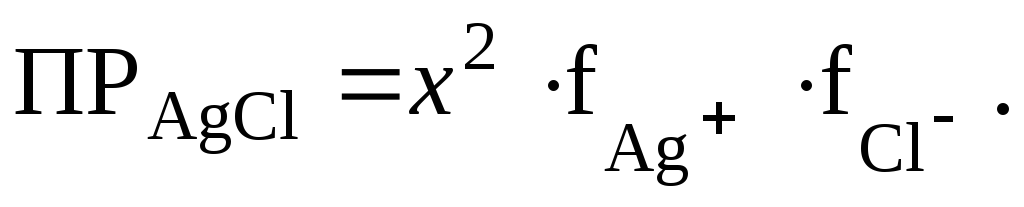
Для нахождения коэффициентов активности рассчитаем ионную силу 0,1 моль/л раствора Ca(NO3)2.
Запишем уравнение диссоциации нитрата кальция:
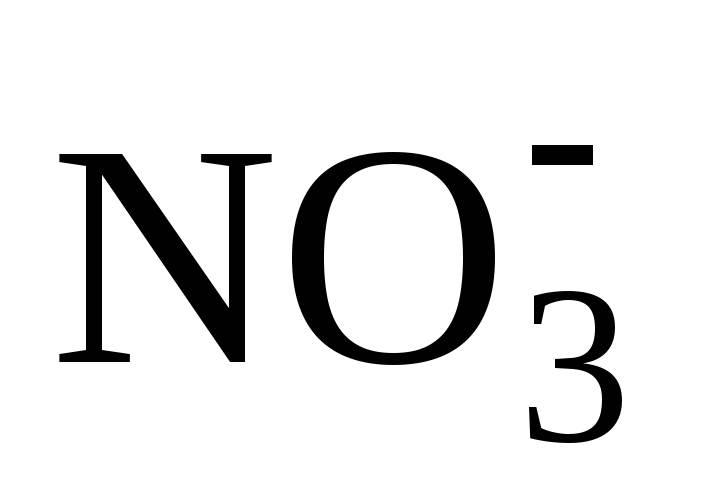
Ca(NO3)2 = Ca 2+ + 2

Растворимость и образование сложных ионов (видео 7)| Произведение Растворимости | Химия
С(Ca 2+ ) = C(Ca(NO3)2)
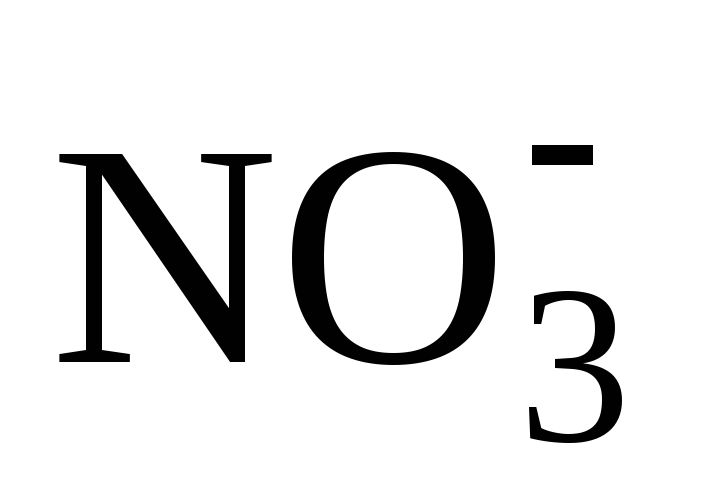
C() = 2 C(Ca(NO3)2)
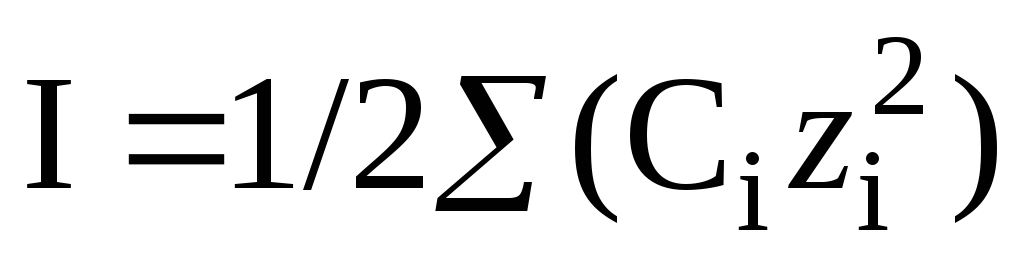
= 1 /2 ( 0,01 ∙ 2 2 + 0,02 ∙ 1 2 ) =0,03 моль/л.
Коэффициент активности рассчитаем по формуле

Рассчитанная величина f = 0,771 для однозарядных ионов Ag + и Cl – совпадает. Следовательно,
x =  /f =
/f =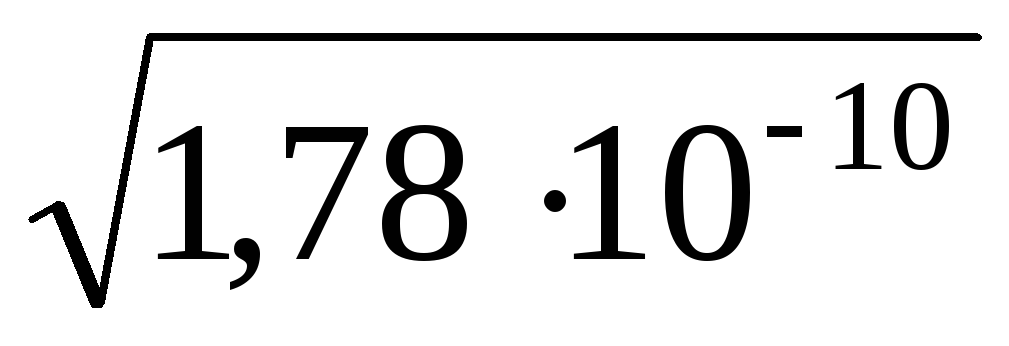 /0,771 =1,73 ∙ 10 –5 моль/л.
/0,771 =1,73 ∙ 10 –5 моль/л.
2. Кислотно-основное равновесие
Наибольшее признание из всех известных теорий кислот и оснований получила протолитическая теория Бренстеда и Лоури. Согласно этой теории, кислотно-основные реакции осуществляются за счет переноса протона от кислоты к основанию. Иначе говоря, кислота является донором, а основание – акцептором протонов. Существуют также вещества, способные как отдавать, так и принимать протоны.
Они называются амфолитами. В водных растворах сильных одноосновных кислот протолитическое равновесие HA + H2O H3O + + A – целиком сдвинуто вправо и концентрация ионов водорода совпадает с концентрацией кислоты. Слабые кислоты и основания в водных растворах диссоциированы лишь частично. На основании анализа равновесий в растворах выводятся основные уравнения для расчета рН.
Расчет рН растворов электролитов проводится по следующим (упрощенным) формулам:
сильных одноосновных кислот
сильных однокислотных оснований
pH = 14 + lgCоснования (3)
солей слабых кислот
солей слабых оснований
буферных растворов, образованных слабой кислотой и ее солью (солью слабой кислоты и сильного или слабого основания)
буферных растворов, образованных слабым основанием и ее солью (солью слабого основания и сильной или слабой кислоты)
pH = 14 – pKоснования + lg(Cоснования /Cсоли) (8)
амфолитов (кислых солей)
Источник: studfile.net
Вычислить концентрацию ионов серебра в растворе один литр которого

Рассчитайте равновесную концентрацию ионов серебра в 0,010 М растворе AgNО3 в присутствии 2,0 М раствора аммика
Ответ проверен экспертом
5 (2 оценки)
helenaal 6 лет назад
Светило науки — 3576 ответов — 54145 раз оказано помощи
Дано: С(AgNO₃) = 0,010M
C(NH₃) = 2M
Найти: [Ag⁺]
Решение.
Азотнокислое серебро является сильным электролитом и диссоциирует по реакции:
AgNO₃ = Ag⁺ + NO₃⁻
Но в присутствии аммиака ионы серебра образуют с ним комплексные соединения, последовательно присоединяя молекулы NH₃.
Аg⁺ + NH₃ ⇄ [Ag(NH₃)]⁺
[Ag(NH₃)]⁺ ⇄ [Ag(NH₃)₂]⁺
Т.е. устанавливается равновесие между тремя формами ионов серебра: [Ag⁺] ;[Ag(NH₃)]⁺ и [Ag(NH₃)₂]⁺. Суммарная их концентрация равна концентрации соли, поскольку диссоциация идет нацело. Равновесная же концентрация каждой формы связана с общей концентрацией коэффициентом α, т.е. мольной долей этой формы в сумме всех форм. И для того, чтобы найти равновесную концентрацию какой-то формы, кроме общей нужно знать и α этой формы.
Общая формула для расчета α форм, где ион металла образует комплексы с разным количеством лигандов (L):
У нас С(AgNO₃) = 0,01М; [NH₃] =C(NH₃) = 2М, т.к. она >> концентрации С(AgNO₃); константы устойчивости комплексов найдем в таблице.
β₁ = 2,09 *10³ (преобразуем для удобства вычисление табличное данное: lgβ₁= 3,32) β₂ = 1.62*10⁷ (lgβ₂=7,23)
Зная молярную долю [Ag⁺], можно найти ее равновесную концентрацию:
[Ag⁺] = C(Ag⁺)*α(Ag⁺) = 0,01 * 1,5*10⁻⁸ = 1,5 * 10⁻¹⁰ М
Ответ: 1,5 * 10⁻10 г- моль/литр
Источник: vashurok.com