1. Значением, какого квантового числа должны отличаться 2 электрона, имеющие одинаковый набор следующих квантовых чисел: lmlms; nmlms; nlms; nlml?
2. PbCl в водных растворах диссоциирует полностью, а AgCl не диссоциирует (т.е. находится в виде осадка ). Почему?
3. ПРAg2Cr2O7 , при 25 о С равно 2*10 -7 . Выпадает ли осадок Ag2Cr2O7 при смешивании равных объемов 0,05н растворов AgNO3 и K2Cr2O7? Степень диссоциации этих электролитов равна 90%.
4. Чему равна молярная масса эквивалента перманганата калия как окислителя, если это вещество в процессе реакции восстанавливается: а) до сульфата марганца (II) б) до диоксида марганца в) до манганата калия K2MnO4?
5. Определите эквиваленты элементов в их оксидах: Rb2O, MgO, Cr2O3, SO3.
6. Выпадает ли осадок галогенида серебра при прибавлении к 1л 0,1м раствора [Ag(NH3)2]NO3, содержащему 1моль/л аммиака, 1*10 -5 моль KBr? (ПРAgBr=6*10 -13 ).
Преподаватель_______________________________________ Хабарова О.В.
Зав. кафедрой НБХ_____________________________________ Тырков А.Г.
Качественные реакции на ОГЭ по химии | Умскул
Билет утверждён на заседании кафедры НБХ
Протокол №4 от 6.11.2014 г.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Астраханский государственный университет»
_________________________________________________________
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 2
Экзамена на 2014/2015 уч. год по дисциплине
«неорганическая химия» для направления 04.03.01. «химия»
1. На основании учения о строении атома объясните, почему энергетический s-подуровень включает одну орбиталь; p-подуровень – 3; d-подуровень – 5 и f-подуровень – 7. Укажите мах число электронов на этих подуровнях.
2. Объяснить такую закономерность: Тпл. LiNO3=252 o C, NaNO3= 306 o C, KNO3=334 o C.
3. К насыщенному раствору PbSO4 объемом 125мл прибавлен 0,5%-ный раствор серной кислоты объемом 5мл. Как изменится при этом концентрация ионов Pb 2+ и растворимость соли?
4. Будет ли работать гальванический элемент, состоящей из водородных электродов, погруженных в 1 и 0,1н растворы KOH при 25 о С, если кажущая степень диссоциации растворов KOH соответственно равны 77 и 91%?
6. Определить гибридные орбитали центрального иона, свойства: [Mn(CN)6] 4- — μоп =1,8; [Fe(CN)6] 3+ — один не спаренный электрон.
Преподаватель_______________________________________ Хабарова О.В.
Зав. кафедрой НБХ_____________________________________ Тырков А.Г.
Билет утверждён на заседании кафедры НБХ
Протокол №4 от 6.11.2014 г.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Астраханский государственный университет»
_________________________________________________________
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 3
Экзамена на 2014/2015 уч. год по дисциплине
«неорганическая химия» для направления 04.03.01. «химия»
Методы осаждения в анализе сложных лекарственных форм.
1. Какой смысл вкладывается в понятие: орбитальный, эффективный, ковалентный, металлический и Ван-дер-ваальсовый радиусы? Как можно объяснить, что численные значения таких радиусов могут различаться?
2. Как классифицируются катионы по зависимости их поляризующего действия от структуры внешнего электронного слоя?
3. рН 0,03н раствора гипохлорита калия равен 9,5. Вычислите степень гидролиза этой соли
5. Определите массу серы, образующейся при взаимодействии сероводорода количеством вещества эквивалента 0,01моль с избытком концентрированной HNO3
6. Какова концентрация Ag + в 0,08м раствора [Ag(NH3)2]NO3, содержащем 1моль/л аммиака? Сколько граммов NaCl можно прибавить к 1л этого раствора до начала выпадения осадка AgCl?
Преподаватель_______________________________________ Хабарова О.В.
Зав. кафедрой НБХ_____________________________________ Тырков А.Г.
Билет утверждён на заседании кафедры НБХ
Протокол №4 от 6.11.2014 г.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Астраханский государственный университет»
_________________________________________________________
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 4
Экзамена на 2014/2015 уч. год по дисциплине
«неорганическая химия» для направления 04.03.01. «химия»
1. Почему электроны, находящиеся между внешними электронами и ядром, называют экранирующими? Существуют ли атомы, в которых отсутствуют такие электроны?
2. В каких случаях геометрическая конфигурация молекул, определяемая типом гибридизации, реализуется: а) полностью б) не полностью? Примеры.
3. Смешиваются равные объемы 0,3н раствора серной кислоты и 0,3н раствора NaOH. Вычислите рН полученного раствора.
4. ЭДС гальванической цепи (-)Ag/AgNO3 0,005н /α=98%││Ag/x н/α=85%/AgNO3(+)=0,085В. Определите концентрацию электролита при положительном электроде, если коэффициенты активности иона серебра в растворах AgNO3 при отрицательном и положительном электроде равны 0,945 и 0,750.
5. К 50мл смеси в 2-х оксидах углерода добавили 100мл кислорода и подожгли. В результате реакции общий объем газов уменьшился на 10%. Все объемы газов измерялись при одинаковых условиях. Определите объемный состав исходный смеси.
6. Выпадает ли осадок AgI при добавлении к 1л 0,1м раствора [Ag(NH3)2]NO3 содержащего 1моль/л аммиака, 1*10 -5 моль/л KI?
Преподаватель_______________________________________ Хабарова О.В.
Зав. кафедрой НБХ_____________________________________ Тырков А.Г.
Билет утверждён на заседании кафедры НБХ
Протокол №4 от 6.11.2014 г.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Астраханский государственный университет»
_________________________________________________________
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 5
экзамена на 2014/2015 уч. год по дисциплине
«неорганическая химия» для направления 04.03.01. «химия»
1. Как изменяются, радиусы атомов в периоде и в группе? Атомы каких элементов имеют max и min значения атомных радиусов?
2. При обычных условиях вода жидкость, сероводород газ. Чем объяснить различия в свойствах?
3. Раствор содержит 0,02моль – эквивалентов Ba(OH)2 и KOH в 250мл раствора. Какова молярная концентрация ионов OH — в растворе?
4. Какую массу CdS можно растворить в 0,05л 0,5н.HNO3. Какой объем NO(н.у.) при этом выделится?
5. Определить эквиваленты элементов в их водородных соединениях: HBr, H2Te, PH3, SiH4.
6. Произойдет ли осаждение сульфида ртути при прибавлении к 1л 0,01м раствора K2[HgI4], содержащего 0,05моль KI такого количества S 2- , которое содержится в 1л насыщенного раствора CdS? (Кнест.([HgI4] 2- ) = 1.5*10 -31 , ПР CdS = 7.9*10 -27 , ПР HgS =1,6*10 -52 ).
Преподаватель_______________________________________ Хабарова О.В.
Зав. кафедрой НБХ_____________________________________ Тырков А.Г.
Билет утверждён на заседании кафедры НБХ
Протокол №4 от 6.11.2014 г.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Астраханский государственный университет»
_________________________________________________________
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 6
Дата добавления: 2020-12-12 ; просмотров: 123 ; Мы поможем в написании вашей работы!
Поделиться с друзьями:
Источник: studopedia.net
Задачи и упражнения. При решении задач используйте цифровые данные из Приложения
При решении задач используйте цифровые данные из Приложения. Примеры решения подобных задач можно найти в задачнике Глинки [3, 4].
1.8.1. Вычислите концентрации ионов Н + , HSe – , Se 2 – в 0,05 М растворе H2Se [4, № 512].
1.8.2. Как изменится рН, если вдвое разбавить водой: а) 0,2 М раствор НС1; б) 0,2 М раствор CН3СООН; в) раствор, содержащий 0,1 моль/л СНзСООН и 0,1 моль/л CH3COONa? [4, № 551]. Указание. Для ответа не обязательно вычислять рН. Его изменение можно найти в уме из анализа формул.
1.8.3. Вычислите растворимость CaF2 (в моль/л): (а) в воде, (б) в 0,05 М растворе KF.
1.8.4. Сравнивая ПР, определите, у какой соли: AgI или Ag3PO4 выше растворимость в воде (в моль/л).
1.8.5. Выпадет ли осадок галогенида серебра при прибавлении к 1 л 0,1 М раствора [Ag(NH3)2]NO3, содержащему 1 моль/л аммиака: а) 10 – 5 моль КВг; б) 10 – 5 моль KI? [4, № 733].
2. Лабораторная работа по химическому равновесию
2.1. Расчёты химических равновесий – прогноз направления реакций
В тетради должны быть заранее выписаны необходимые константы (см. Приложение), проведены расчёты, написаны предполагаемые уравнения реакций (или указано, что реакция не ожидается – стрелка зачёркнута) и оставлено место для описания опыта, наблюдений и пояснений. Основная работа по этой части должна быть проведена дома, т.к. каждый эксперимент занимает не больше минуты. Если результаты опыта не согласуются с расчётом, нужно немедленно разбираться: либо в расчёте, либо в проведении опыта есть ошибка.
2.1.1. Выпадет ли осадок галогенида свинца, если смешать равные объёмы 0,005 М раствора Pb(NO3)2 и 0,05 М раствора KГ (Г = Cl или I)?
Рекомендуемая схема расчёта. Находим концентрации до начала реакции. При смешивании равных объёмов объём удваивается, значит, исходные концентрации становятся вдвое меньше, чем были в банках.
А поскольку исходные вещества – типичные соли, они в растворе должны полностью распадаться на соответствующие ионы, значит, концентрации солей – это и есть концентрации их ионов (с учётом индексов в формуле). Далее вычисляем произведение концентраций ионов (ПКИ) в той же форме (с теми же показателями), что и в произведении растворимости. Поскольку концентрации KCl и KI одинаковые, этот расчёт – один для обоих опытов.
Смешиваем раствор нитрата свинца в одной пробирке с раствором KCl, а в другой – с раствором KI и отмечаем результаты.
2.1.2. Выпадет ли осадок сульфида, если смешать равные объёмы насыщенного (0,1 М) раствора сероводорода и 1 М раствора сульфата (или нитрата) марганца и меди?
Эта задача подобна предыдущей, но с тем усложнением, что H2S – очень слабая кислота, т.е. даёт очень мало ионов водорода, поэтому никак нельзя считать, что концентрация сульфид–ионов равна концентрации кислоты. И MnS, и CuS растворимы в воде гораздо хуже, чем, например, PbCl2, поэтому раствором сульфида натрия они осаждаются однозначно. Но хватит ли для этого ионов сульфида в растворе сероводорода? Можно, как и выше, вычислять ПКИ, но предлагается более общий подход.
Вычислите по табличным данным константу равновесия ожидаемой реакции:
M 2+ + H2S ← → MS ↓ + 2 H + ; K =? (1)
Для этого надо получить данное уравнение путём комбинирования уравнений (2)–(4), т.е. тех равновесий, для которых есть справочные данные в Приложении:
MS ← → M 2+ + S 2– ; ПР (MS) =. (4)
Химические уравнения складывают точно так же, как алгебраические, при необходимости домножая их на коэффициенты. Нетрудно заметить, что в искомое уравнение не входят ионы HS – и S 2– , следовательно, надо складывать так, чтобы эти промежуточные продукты взаимно уничтожились.
Когда химические уравнения складываются, то их константы равновесия перемножаются, а если уравнение умножается на некий коэффициент, то его константа равновесия возводится в соответствующую степень. Если же уравнение вычитается, то его константа равновесия, естественно, идёт в знаменатель.
Получив общее выражение К через К1 (H2S), К2 (H2S) и ПР (MS), подставляем конкретные числовые значения для разных M, и качественный вывод готов: если константа равновесия очень велика – реакция идёт практически до конца, если константа очень мала – реакция практически не идёт, а если она не очень сильно отличается от единицы – значит, в зависимости от концентраций, равновесие может смещаться вправо или влево, и нужно в расчёте использовать конкретные концентрации. В частности, подставив в выражение константы равновесия процесса (1) исходные концентрации M 2+ и H2S, можно вычислить концентрацию ионов водорода, при которой начинается осаждение MS. Если она получается нереально высокой – значит, осаждение неизбежно.
Смешиваем растворы, отмечаем результаты.
2.1.3. Будут ли кислыми, нейтральными или щелочными растворы Na2HPO4 и NaH2PO4?
Ответ заранее не очевиден. С одной стороны, это кислые соли, следовательно, могут диссоциировать по кислотному типу, т.е. давать ионы водорода и создавать кислую среду. С другой стороны, это соли слабой фосфорной кислоты, они могут подвергаться гидролизу, т.е. не отдавать ион водорода, а, наоборот, захватывать его у воды и этим создавать щелочную среду.
Но раствор не может быть одновременно и кислым, и щелочным. Нужно решить, что преобладает, а для этого сравнить константы двух равновесий. Рассмотрим на примере гидрофосфата (Na2HPO4).
а) Гидролиз. HPO4 2– + H2O ← → H2PO4 – + OH – ; константа гидролиза получается делением константы ионизации воды на константу ионизации того слабого электролита, который получается в результате гидролиза: Кг = Кв / Кк. Внимание! Не перепутайте, какая из трёх констант фосфорной кислоты тут нужна!
б) Кислотная диссоциация. HPO4 2– ← → PO4 3– + H + ; а тут какая из трёх констант используется?
Сравниваем константы, и качественный вывод (кислый или щелочной раствор) очевиден. Процессом, у которого константа равновесия на много порядков ниже, можно пренебречь.
Проделайте расчёты для обеих кислых солей и проверьте результат с помощью универсальной индикаторной бумаги, запишите значения рН.
Источник: mydocx.ru
Химия. Строение вещества

Единственный в мире Музей Смайликов
Самая яркая достопримечательность Крыма

Скачать 2.63 Mb.
Пример 3. По названию комплексного соединения напишите его эмпирическую формулу: трироданотрицианоферрат (III) аммония; фосфатотриаквахром; тетрабромородат (II) диаквадиамминхрома (III)
В соединении трироданотрицианоферрат (III) аммония, очевидно, комплексным является анион. Комплексная частица записывается в квадратных скобках, ее формулу записываем справа налево в порядке перечисления лигандов с указанием их числа, левее всех лигандов записываем комплексообразователь, а слева от квадратной скобки записываем катион. После этого проставляем заряды всех частиц и, используя принцип электронейтральности молекулы, находим индексы при катионе и анионе:
Название комплексного соединения фосфатотриаквахром сразу указывает на нейтральный комплекс, следовательно, формула соединения заключена в квадратные скобки. Далее, как и в предыдущем примере, лиганды записываем справа налево в порядке перечисления с указанием их числа, левее всех лигандов записываем комплексообразователь: [Cr(H2O)3PO4].
Название тетрабромородат (II) диамминдиаквахрома (III) указывает на то, что в этом соединении комплексными являются и катион и анион. Следовательно, и правую (анион) и левую (катион) части формулы мы заключаем в квадратные скобки. Нельзя забывать, что название аниона записывается первым (слева), а в формуле анион указывают вторым (справа). Далее действуем по обычному алгоритму:
[Cr +3 (H2O)2(NH3)2]2 3+ [Rh +2 Br4]3 2-
Пример 4. Определить тип гибридизации атомных орбиталей иона-комплексообразователя и магнитные свойства комплексных ионов [CoF6] 3- и [Co(NH3)6] 3+ .
В теории кристаллического поля химическая связь комплексообразователь – лиганд считается электростатической. В соответствии с этой теорией лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных зарядов. Реальный объем лиганда теорией во внимание не принимается.
Лиганды, как точечные заряды, создают вокруг комплексообразователя электростатическое поле (“кристаллическое поле”, если рассматривать кристалл комплексного соединения, или поле лигандов), в котором энергетические уровни комплексообразователя и, прежде всего, d-подуровни расщепляются, и их энергия изменяется. Характер расщепления, энергия новых энергетических уровней зависит от симметрии расположения лигандов (октаэдрическое, тетраэдрическое или иное кристаллическое поле). Когда в качестве лигандов координируются молекулы H2O, NH3, CO и другие, их рассматривают как диполи, ориентированные отрицательным зарядом к комплексообразователю.
Рассмотрим случай октаэдрического расположения лигандов (например, [CoF6] 3- или [Co(NH3)6] 3+ ). В центре октаэдра находится атом-комплексообразователь М (+n) с электронами на d-атомных орбиталях, а в его вершинах – лиганды в виде точечных отрицательных зарядов (например, ионы F — или полярные молекулы типа NH3). В условном ионе М (+n) , не связанном с лигандами, энергии всех пяти d-АО одинаковы (т.е. атомные орбитали вырожденные).
Однако в октаэдрическом поле лигандов d-АО комплексообразователя попадают в неравноценное положение. Атомные орбитали d(z 2 ) и d(x 2 — y 2 ), вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между этими орбиталями и лигандами, находящимися в вершинах октаэдра, возникают значительные силы отталкивания, приводящие к увеличению энергии орбиталей. Иначе говоря, данные атомные орбитали подвергаются максимальному воздействию поля лигандов.
Другие три d-АО – d(xy), d(xz) и d(yz), расположенные между осями координат и между лигандами, находятся на более значительном расстоянии от них. Взаимодействие таких d-АО с лигандами минимально, а следовательно – энергия d(xy), d(xz) и d(yz)-АО понижается по сравнению с исходной.
Таким образом, пятикратно вырожденные d-АО комплексообразователя, попадая в октаэдрическое поле лигандов, подвергаются расщеплению на две группы новых орбиталей – трехкратно вырожденные орбитали с более низкой энергией, d(xy), d(xz) и d(yz), и двукратно вырожденные орбитали с более высокой энергией, d(z 2 ) и d(x 2 -y 2 ). Эти новые группы d-орбиталей с более низкой и более высокой энергией обозначают de и dg:

Разность энергий двух новых подуровней de и dg получила название параметра расщепления Δ0:
Выигрыш энергии за счет преимущественного заселения электронами de-атомных орбиталей называют энергией стабилизации комплекса полем лигандов.
Специфика каждого из лигандов сказывается в том, какое поле данный лиганд создает – сильное или слабое. Чем сильнее поле лигандов, чем больше значение параметра расщепления Δ0. Изучение параметра расщепления, как правило, основано на спектроскопических исследованиях.
Наиболее распространенные лиганды можно расположить в следующий спектрохимический ряд, вдоль которого значение Δ0 монотонно растет:
I —
— — ≈NCS — — — — — — — ≈ NO ≈ CO.
Рассмотрим распределение электронов по de- и dg-орбиталям в октаэдрическом поле лигандов. Заселение de- и dg-орбиталей происходит в полном соответствии с правилом Гунда и принципом Паули. При этом независимо от значения параметра расщепления первые три электрона занимают квантовые ячейки de-подуровня:
Если число электронов на d-подуровне комплексообразователя больше трех, для размещения их по расщепленным подуровням появляется две возможности. При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий de- и dg-орбитали; четвертый, а затем и пятый электроны заселяют квантовые ячейки dg-подуровня. При сильном поле лигандов и высоком значении D0 заселение четвертым и пятым электроном dg-подуровня исключено; происходит заполнение de-орбиталей.
При слабом поле лигандов заселяющие квантовые ячейки 4 или 5 электронов имеют параллельные спины, поэтому получаемый комплекс оказывается сильно парамагнитен. В сильном поле лигандов образуются одна, а затем две электронные пары на de-подуровне, так что парамагнетизм комплекса оказывается гораздо слабее.
Вернемся к рассмотрению электронного строения октаэдрических комплексных ионов [Co(NH3)6] 3+ и [CoF6] 3- . В соответствии с расположением в спектрохимическом ряду, аммиак NH3 относится к числу лигандов сильного поля, а фторид-ион F — – слабого поля. Следовательно, заселение электронами атомных орбиталей в данных комплексах будет происходит по схеме:

В анионе [CoF6] 3- лиганды F — создают слабое кристаллическое поле (Δ0 = 13000 см -1 ), и все электроны исходной 3d 6 -АО размещаются на de- и dg-орбиталях без какого-либо спаривания. Комплексный ион является высокоспиновым и содержит четыре неспаренных электрона, поэтому он парамагнитен. При образовании этого комплекса реализуется тип гибридизации sp 3 d 2 .
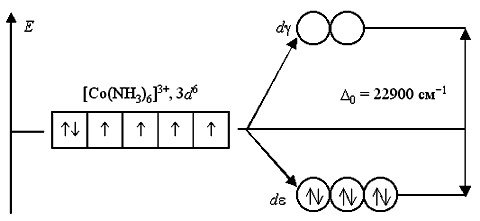
В ионе [Co(NH3)6] 3+ лиганды NH3 создают сильное кристаллическое поле (Δ0 = 22900 см -1 ), все 3d 6 -электроны размещаются на более энергетически выгодной de-орбитали. Переход электронов с de- на dg-орбитали невозможен из-за слишком высокого энергетического барьера. Поэтому данный комплексный катион является низкоспиновым, он не содержит неспаренных электронов и диамагнитен. При образовании этого комплекса реализуется тип гибридизации d 2 sp 3
Пример 5. Константа нестойкости иона [Ag(CN)2] — составляет 1∙10 -21 . Вычислить концентрацию ионов серебра в 0,05 М растворе К[Ag(CN)2], содержащем, кроме того, 0,01 моль/л KCN.
Вторичная диссоциация комплексного иона протекает по уравнению:
В присутствии избытка ионов CN — , создаваемого в результате диссоциации KCN (которую можно считать полной), это равновесие смещено влево настолько, что количеством ионов CN — , образующимся при вторичной диссоциации, можно пренебречь. Тогда [CN — ] = C KCN = 0,01 моль/л. По той же причине равновесная концентрация ионов [Ag(CN)2] — может быть приравнена общей концентрации комплексной соли (0,05 моль/л).
По условию задачи:
Отсюда выражаем концентрацию ионов Ag + .
Подставив значения концентраций ионов CN — и [[Ag(CN)2] — ], получим:
Пример 6. Растворы простых солей кадмия образуют со щелочами осадок гидроксида кадмия Cd(OH)2, а с сероводородом – осадок сульфида кадмия CdS. Чем объяснить, что при добавлении щелочи к 0,05М раствору K2[Cd(CN)4], содержащему 0,1 моль/л KCN, осадок не образуется, тогда как при пропускании через этот раствор сероводорода выпадает осадок CdS? Константу нестойкости иона [Cd(CN)4] 2- принять равной 7.8∙10 -18 .
Условия образования осадков Cd(OH)2 и CdS могут быть записаны следующим образом:
[Cd 2+ ][S 2- ] > ПР CdS = 8 ∙ 10 -27
В растворе комплексной соли при заданных условиях концентрация ионов Cd 2+ вычисляется по уравнению (см. пример 1):
Тогда концентрация ионов ОН — , достаточная для осаждения гидроксида кадмия, найдется из неравенства
Таким образом, в рассматриваемой системе при концентрациях ионов ОН — меньших, чем 1 моль/л, равновесие [Cd(CN)4] 2- + 2ОН — ↔ Cd(OH)2 + 4CN — смещено в сторону образования комплексного иона.
Условие образования осадка сульфида кадмия из заданного раствора тетрацианокадмата калия выразится неравенством:
Следовательно, даже при малых концентрациях сульфид-иона равновесие [Cd(CN)4] 2- + S 2- ↔ CdS + 4CN — практически полностью смещено в сторону образования сульфида кадмия.
Пример 7. Произойдет ли образование осадка Cu(OH)2 при сливании равных объемов 1.0 М растворов КОН и [Cu(NH3)4]Cl2 , содержащего избыток 0.5 моль аммиака. Кн([Cu(NH3)4] 2+ )=9.33∙10 -13 ; ПРCu(OH)2 =5.6∙10 -20; степень диссоциации [Cu(NH3)4]Cl2 и КОН принять равной 1.
При сливании равных объемов растворов концентрация каждого из компонентов уменьшается в 2 раза, т.е. станет равной С([Cu(NH3)4]Cl2)=0.5 моль/л; СКОН=0.5 моль/л; С(NH3) =0.25 моль/л.
В присутствии избытка аммиака равновесие диссоциации иона
сильно смещено влево. Поэтому концентрацией аммиака, получающегося при диссоциации этого иона, можно пренебречь, а концентрацию NH3 в растворе можно считать равной 0.25 моль/л. Отсюда
Так как раствор гидроксида калия – сильный электролит: КОН↔К + + ОН — , то
Тогда [Cu 2+ ]∙[OH — ] 2 =1.17∙10 -10 ∙(0.5) 2 =2.9∙10 -11
Следовательно, осадок Cu(OH)2 образуется.
2. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
2.1. Для приведенных комплексных соединений определить тип комплекса, степени окисления всех составляющих, указать комплексообразователь, лиганды, ионы внешней и внутренней сферы, а также координационное число. Записать уравнения диссоциации комплексного соединения и константу нестойкости для комплексного иона.
Источник: topuch.com