(Kt)х(Аn)у Û x ×Kt z + + y ×Аn z – .
осадок насыщенный раствор
Константа равновесия процесса диссоциации мало растворимого вещества в его насыщенном растворе называется произведением растворимости ПР.
Выражение для произведения растворимости имеет вид
ПР = (g+·[Kt z + ]) x × (g– ·[Аn z – ]) y , (46)
где а+, а– – активности катиона и аниона; g+ , g– – коэффициенты активностей катиона и аниона; [Kt z + ], [Аn z – ] – равновесные молярные концентрации ионов, моль/дм 3 .
Поскольку насыщенный раствор труднорастворимого вещества содержит небольшие количества ионов, то есть является достаточно разбавленным, то при расчете ПР активности ионов можно заменить равновесными концентрациями. Тогда уравнение (46) примет вид
ПР = [ Kt z + ] x × [Аn z – ] y . (47)
ПР электролита при данной температуре есть величина постоянная. Численные значения произведения растворимости большинства труднорастворимых электролитов приведены в справочной литературе.
По величине ПР судят о растворимости электролита: из двух однотипных соединений большей растворимостью обладает то, произведение растворимости которого больше.
Галогены. Часть 2. Качественные реакции на галогениды. Химические свойства.
Если произведение концентраций ионов (ПРрасч) в каком-либо растворе соли больше, чем табличное значение ПРтабл, то в растворе будет присутствовать осадок данного вещества. И наоборот, если ПРрасч < ПРтабл, то осадок данного вещества растворится.
Равновесные молярные концентрации ионов [Kt z + ]и [Аn z – ] пропорциональны растворимости вещества L (моль/дм 3 )
[Kt z + ] = x × L ; [Аn z – ] = y × L . (48)
Отсюда ПР[(Kt)х(Аn)у] = (x × L) x × ( y × L) y ; (49)
Примеры решения задач
Пример 1. Вычислите произведение растворимости фторида кальция, если его растворимость в воде равна 0,024 моль/дм 3 .
Уравнение диссоциации имеет вид СаF2↓Û Са 2+ + 2F – . Тогда по уравнению (48) равновесные концентрации ионов равны
[Са 2+ ]= L; [ F – ]= 2× L .
ПР(СаF2) = [Са 2+ ]∙[ F – ] 2 = L ×(2 L) 2 = 4× L 3 = 4 × (0,024) 3 = 5,53 × 10 -5 .
Пример 2. Выпадет ли осадок йодида серебра при 25 °С после сливания 0,1 дм 3 0,005 М раствора нитрата серебра и 0,3 дм 3 0,002 М раствора иодида калия, если ПР(AgI)табл = 1,1×10 -16 ?
При сливании указанных реактивов идет реакция
AgNO3 + KI = AgI↓ + KNO3 ,
Ag + + I – = AgI↓ .
Молярные концентрации ионов в растворах до смешивания равны
[Ag + ] = 0,005 моль/дм 3 ; [I – ] =0,002 моль/дм 3 .
Концентрации ионов в растворах после смешивания
[Ag + ] = = = 1,25∙10 -3 моль/дм 3 ;
[I – ] = = = 1,5∙10 -3 моль/дм 3 .
По формуле (47) находим произведение концентраций ионов (ПРрасч)
ПР(AgI)расч = [Ag + ]×[I – ]= 1,25∙10 -3 ∙1,5∙10 -3 = 1,88×10 -6 .
AgIосаждается, так как соблюдается условие выпадения осадка
Пример 3. Вычислите (не учитывая гидролиза) растворимость фосфата бария в моль/л и г/л, а также молярные концентрации ионов в насыщенном растворе данной соли, если ПР [Ва3(РО4)2] = 6,3 · 10 -39 .
Олимпиадная задача определение состава вещества и комплексные соли (качественные реакции).
Фосфат бария диссоциирует по схеме Ва3(РО4)2↓↔ 3Ва 2+ + 2РО , тогда по формуле (47)
По уравнению (48) равновесные концентрации ионов равны
[Ва 2+ ] = 3×L; [РО ] = 2×L .
Тогда по по формуле (50) L = моль/л.
Молярная масса фосфата бария М2(Ва3(РО4)2) = 602 г/моль, тогда растворимость, выраженная в г/л
L = 602 · 9 · 10 -9 = 5,42 · 10 -6 г/л.
Концентрации ионов [Ва 2+ ] = 3×L = 3 · 9 · 10 -9 = 2,7 · 10 -8 моль/л;
[РО ] = 2×L = 9 · 10 -9 · 2 = 1,8 · 10 -8 моль/л.
Пример 4. Выпадет ли осадок галогенида серебра, если к 1 л 0,1 М раствора [Ag(NH3)2]NO3, содержащему 1 моль аммиака добавить:
а) 1×10 –5 моль КВr; б) 1×10 –5 моль КI.
Для решения вопроса о возможности разрушения комплексного иона за счет связывания комплексообразователя в малорастворимую соль необходимо оценить значения равновесных концентраций ионов в рассматриваемой системе. Для этого из справочника [8] выбираем значение константы нестойкости комплекса и произведения растворимости соответствующих солей
КН([Ag(NH3)2] + ) = 5,9 · 10 –8 ; ПР(AgBr) = 5,3 · 10 –13 ; ПР(AgI) = 8,3 · 10 –17 .
Данная комплексная соль диссоциирует по схеме
По определению для комплексного иона [Ag(NH3)2] +
[NH3] ≈ С2(NH3) = 1 моль/л, так как концентрация молекул аммиака, образовавшихся вследствие вторичной диссоциации комплексного иона мала.
Из схемы первичной диссоциации следует, что
Тогда концентрация ионов Ag + равна
Концентрацию ионов Br – , достаточную для осаждения AgBr найдем из выражения для ПР (AgBr)
Так как необходимая для осаждения бромида серебра концентрация ионов брома ([Br – ] = 8,98×10 –5 моль/дм 3 ) больше добавляемой в составе бромида калия ([Br – ] = 1×10 –5 моль/дм 3 ), то осадок бромида серебра не выпадает.
Концентрацию ионов I – , достаточную для осаждения AgI найдем по аналогии
Так как необходимая для осаждения йодида серебра концентрация ионов йода ([I – ] = 1,41×10 –8 моль/дм 3 ) меньше добавляемой в составе йодида калия ([I – ] = 1×10 –5 моль/дм 3 ), то реакция разрушения комплексного иона в данном случае будет протекать
ГИДРОЛИЗ СОЛЕЙ
Дата добавления: 2018-11-24 ; просмотров: 155 ; Мы поможем в написании вашей работы!
Источник: studopedia.net
Произведение растворимости Краткие теоретические сведения
(Kt)х(Аn)у xKt z + + yАn z – .
осадок насыщенный раствор
Константа равновесия процесса диссоциации мало растворимого вещества в его насыщенном растворе называется произведением растворимости ПР.
Выражение для произведения растворимости имеет вид

ПР = (+·[Kt z + ]) x (– ·[Аn z – ]) y , (46)
где а+, а– – активности катиона и аниона; + , – – коэффициенты активностей катиона и аниона; [Kt z + ], [Аn z – ] – равновесные молярные концентрации ионов, моль/дм 3 .
Поскольку насыщенный раствор труднорастворимого вещества содержит небольшие количества ионов, то есть является достаточно разбавленным, то при расчете ПР активности ионов можно заменить равновесными концентрациями. Тогда уравнение (46) примет вид
ПР = [ Kt z + ] x [Аn z – ] y . (47)
ПР электролита при данной температуре есть величина постоянная. Численные значения произведения растворимости большинства труднорастворимых электролитов приведены в справочной литературе.
По величине ПР судят о растворимости электролита: из двух однотипных соединений большей растворимостью обладает то, произведение растворимости которого больше.
Если произведение концентраций ионов (ПРрасч) в каком-либо растворе соли больше, чем табличное значение ПРтабл, то в растворе будет присутствовать осадок данного вещества. И наоборот, если ПРрасч < ПРтабл, то осадок данного вещества растворится.
Равновесные молярные концентрации ионов [Kt z + ] и [Аn z – ] пропорциональны растворимости вещества L (моль/дм 3 )
[Kt z + ] = x L ; [Аn z – ] = y L . (48)
Отсюда ПР[(Kt)х(Аn)у] = (xL) x × ( y L) y ; (49)

L = . (50)
Примеры решения задач
Пример 1. Вычислите произведение растворимости фторида кальция, если его растворимость в воде равна 0,024 моль/дм 3 .
Уравнение диссоциации имеет вид СаF2↓Û Са 2+ + 2F – . Тогда по уравнению (48) равновесные концентрации ионов равны
[Са 2+ ]= L; [ F – ]= 2 L .
ПР(СаF2) = [Са 2+ ]∙[ F – ] 2 = L × (2 L) 2 = 4 L 3 = 4 × (0,024) 3 = 5,53 × 10 -5 .
Пример 2. Выпадет ли осадок йодида серебра при 25 °С после сливания 0,1 дм 3 0,005 М раствора нитрата серебра и 0,3 дм 3 0,002 М раствора иодида калия, если ПР(AgI)табл = 1,1×10 -16 ?
При сливании указанных реактивов идет реакция
AgNO3 + KI = AgI↓ + KNO3 ,
Ag + + I – = AgI↓ .
Молярные концентрации ионов в растворах до смешивания равны
[Ag + ] = 0,005 моль/дм 3 ; [I – ] =0,002 моль/дм 3 .
Концентрации ионов в растворах после смешивания
[Ag + ] =  =
= = 1,25∙10 -3 моль/дм 3 ;
= 1,25∙10 -3 моль/дм 3 ;
[I – ] = 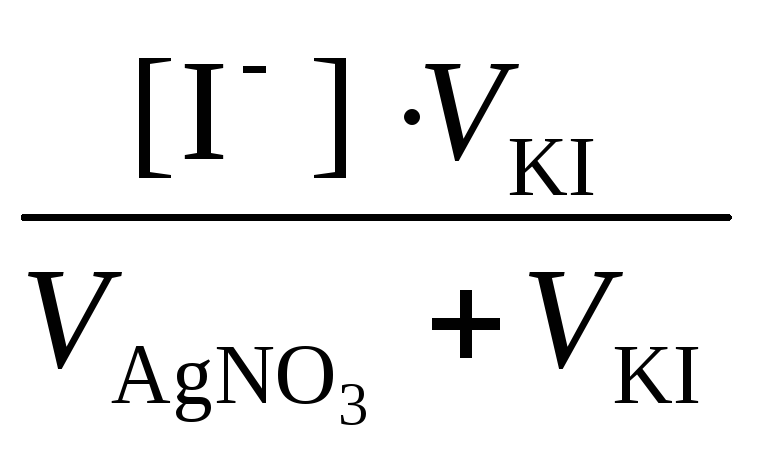 =
= = 1,5∙10 -3 моль/дм 3 .
= 1,5∙10 -3 моль/дм 3 .
По формуле (47) находим произведение концентраций ионов (ПРрасч)
ПР(AgI)расч = [Ag + ]×[I – ]= 1,25∙10 -3 ∙1,5∙10 -3 = 1,88×10 -6 .
AgI осаждается, так как соблюдается условие выпадения осадка
Пример 3. Вычислите (не учитывая гидролиза) растворимость фосфата бария в моль/л и г/л, а также молярные концентрации ионов в насыщенном растворе данной соли, если ПР [Ва3(РО4)2] = 6,3 · 10 -39 .

Фосфат бария диссоциирует по схеме Ва3(РО4)2↓↔ 3Ва 2+ + 2РО, тогда по формуле (47)

ПР [Ва3(РО4)2] = [Ва 2+ ] 3 · [РО] 2 .
По уравнению (48) равновесные концентрации ионов равны

[Ва 2+ ] = 3L; [РО] = 2L .

Тогда по по формуле (50) L = моль/л.
Молярная масса фосфата бария М2(Ва3(РО4)2) = 602 г/моль, тогда растворимость, выраженная в г/л
L = 602 · 9 · 10 -9 = 5,42 · 10 -6 г/л.
Концентрации ионов [Ва 2+ ] = 3L = 3 · 9 · 10 -9 = 2,7 · 10 -8 моль/л;

[РО] = 2L = 9 · 10 -9 · 2 = 1,8 · 10 -8 моль/л.
Пример 4. Выпадет ли осадок галогенида серебра, если к 1 л 0,1 М раствора [Ag(NH3)2]NO3, содержащему 1 моль аммиака добавить:
а) 110 –5 моль КВr; б) 110 –5 моль КI.
Для решения вопроса о возможности разрушения комплексного иона за счет связывания комплексообразователя в малорастворимую соль необходимо оценить значения равновесных концентраций ионов в рассматриваемой системе. Для этого из справочника [8] выбираем значение константы нестойкости комплекса и произведения растворимости соответствующих солей
КН([Ag(NH3)2] + ) = 5,9 · 10 –8 ; ПР(AgBr) = 5,3 · 10 –13 ; ПР(AgI) = 8,3 · 10 –17 .
Данная комплексная соль диссоциирует по схеме

[Ag(NH3)2]NO3 [Ag(NH3)2] + + NO.
По определению для комплексного иона [Ag(NH3)2] +

КН([Ag(NH3)2] + ) = .
[NH3] ≈ С2(NH3) = 1 моль/л, так как концентрация молекул аммиака, образовавшихся вследствие вторичной диссоциации комплексного иона мала.
Из схемы первичной диссоциации следует, что
Тогда концентрация ионов Ag + равна

[Ag + ] =моль/л.
Концентрацию ионов Br – , достаточную для осаждения AgBr найдем из выражения для ПР (AgBr)

[Br – ] = моль/л.
Так как необходимая для осаждения бромида серебра концентрация ионов брома ([Br – ] = 8,9810 –5 моль/дм 3 ) больше добавляемой в составе бромида калия ([Br – ] = 110 –5 моль/дм 3 ), то осадок бромида серебра не выпадает.
Концентрацию ионов I – , достаточную для осаждения AgI найдем по аналогии

[I – ] = моль/л.
Так как необходимая для осаждения йодида серебра концентрация ионов йода ([I – ] = 1,4110 –8 моль/дм 3 ) меньше добавляемой в составе йодида калия ([I – ] = 110 –5 моль/дм 3 ), то реакция разрушения комплексного иона в данном случае будет протекать
Источник: studfile.net
Задачи и упражнения. При решении задач используйте цифровые данные из Приложения
При решении задач используйте цифровые данные из Приложения. Примеры решения подобных задач можно найти в задачнике Глинки [3, 4].
1.8.1. Вычислите концентрации ионов Н + , HSe – , Se 2 – в 0,05 М растворе H2Se [4, № 512].
1.8.2. Как изменится рН, если вдвое разбавить водой: а) 0,2 М раствор НС1; б) 0,2 М раствор CН3СООН; в) раствор, содержащий 0,1 моль/л СНзСООН и 0,1 моль/л CH3COONa? [4, № 551]. Указание. Для ответа не обязательно вычислять рН. Его изменение можно найти в уме из анализа формул.
1.8.3. Вычислите растворимость CaF2 (в моль/л): (а) в воде, (б) в 0,05 М растворе KF.
1.8.4. Сравнивая ПР, определите, у какой соли: AgI или Ag3PO4 выше растворимость в воде (в моль/л).
1.8.5. Выпадет ли осадок галогенида серебра при прибавлении к 1 л 0,1 М раствора [Ag(NH3)2]NO3, содержащему 1 моль/л аммиака: а) 10 – 5 моль КВг; б) 10 – 5 моль KI? [4, № 733].
2. Лабораторная работа по химическому равновесию
2.1. Расчёты химических равновесий – прогноз направления реакций
В тетради должны быть заранее выписаны необходимые константы (см. Приложение), проведены расчёты, написаны предполагаемые уравнения реакций (или указано, что реакция не ожидается – стрелка зачёркнута) и оставлено место для описания опыта, наблюдений и пояснений. Основная работа по этой части должна быть проведена дома, т.к. каждый эксперимент занимает не больше минуты. Если результаты опыта не согласуются с расчётом, нужно немедленно разбираться: либо в расчёте, либо в проведении опыта есть ошибка.
2.1.1. Выпадет ли осадок галогенида свинца, если смешать равные объёмы 0,005 М раствора Pb(NO3)2 и 0,05 М раствора KГ (Г = Cl или I)?
Рекомендуемая схема расчёта. Находим концентрации до начала реакции. При смешивании равных объёмов объём удваивается, значит, исходные концентрации становятся вдвое меньше, чем были в банках.
А поскольку исходные вещества – типичные соли, они в растворе должны полностью распадаться на соответствующие ионы, значит, концентрации солей – это и есть концентрации их ионов (с учётом индексов в формуле). Далее вычисляем произведение концентраций ионов (ПКИ) в той же форме (с теми же показателями), что и в произведении растворимости. Поскольку концентрации KCl и KI одинаковые, этот расчёт – один для обоих опытов.
Смешиваем раствор нитрата свинца в одной пробирке с раствором KCl, а в другой – с раствором KI и отмечаем результаты.
2.1.2. Выпадет ли осадок сульфида, если смешать равные объёмы насыщенного (0,1 М) раствора сероводорода и 1 М раствора сульфата (или нитрата) марганца и меди?
Эта задача подобна предыдущей, но с тем усложнением, что H2S – очень слабая кислота, т.е. даёт очень мало ионов водорода, поэтому никак нельзя считать, что концентрация сульфид–ионов равна концентрации кислоты. И MnS, и CuS растворимы в воде гораздо хуже, чем, например, PbCl2, поэтому раствором сульфида натрия они осаждаются однозначно. Но хватит ли для этого ионов сульфида в растворе сероводорода? Можно, как и выше, вычислять ПКИ, но предлагается более общий подход.
Вычислите по табличным данным константу равновесия ожидаемой реакции:
M 2+ + H2S ← → MS ↓ + 2 H + ; K =? (1)
Для этого надо получить данное уравнение путём комбинирования уравнений (2)–(4), т.е. тех равновесий, для которых есть справочные данные в Приложении:
MS ← → M 2+ + S 2– ; ПР (MS) =. (4)
Химические уравнения складывают точно так же, как алгебраические, при необходимости домножая их на коэффициенты. Нетрудно заметить, что в искомое уравнение не входят ионы HS – и S 2– , следовательно, надо складывать так, чтобы эти промежуточные продукты взаимно уничтожились.
Когда химические уравнения складываются, то их константы равновесия перемножаются, а если уравнение умножается на некий коэффициент, то его константа равновесия возводится в соответствующую степень. Если же уравнение вычитается, то его константа равновесия, естественно, идёт в знаменатель.
Получив общее выражение К через К1 (H2S), К2 (H2S) и ПР (MS), подставляем конкретные числовые значения для разных M, и качественный вывод готов: если константа равновесия очень велика – реакция идёт практически до конца, если константа очень мала – реакция практически не идёт, а если она не очень сильно отличается от единицы – значит, в зависимости от концентраций, равновесие может смещаться вправо или влево, и нужно в расчёте использовать конкретные концентрации. В частности, подставив в выражение константы равновесия процесса (1) исходные концентрации M 2+ и H2S, можно вычислить концентрацию ионов водорода, при которой начинается осаждение MS. Если она получается нереально высокой – значит, осаждение неизбежно.
Смешиваем растворы, отмечаем результаты.
2.1.3. Будут ли кислыми, нейтральными или щелочными растворы Na2HPO4 и NaH2PO4?
Ответ заранее не очевиден. С одной стороны, это кислые соли, следовательно, могут диссоциировать по кислотному типу, т.е. давать ионы водорода и создавать кислую среду. С другой стороны, это соли слабой фосфорной кислоты, они могут подвергаться гидролизу, т.е. не отдавать ион водорода, а, наоборот, захватывать его у воды и этим создавать щелочную среду.
Но раствор не может быть одновременно и кислым, и щелочным. Нужно решить, что преобладает, а для этого сравнить константы двух равновесий. Рассмотрим на примере гидрофосфата (Na2HPO4).
а) Гидролиз. HPO4 2– + H2O ← → H2PO4 – + OH – ; константа гидролиза получается делением константы ионизации воды на константу ионизации того слабого электролита, который получается в результате гидролиза: Кг = Кв / Кк. Внимание! Не перепутайте, какая из трёх констант фосфорной кислоты тут нужна!
б) Кислотная диссоциация. HPO4 2– ← → PO4 3– + H + ; а тут какая из трёх констант используется?
Сравниваем константы, и качественный вывод (кислый или щелочной раствор) очевиден. Процессом, у которого константа равновесия на много порядков ниже, можно пренебречь.
Проделайте расчёты для обеих кислых солей и проверьте результат с помощью универсальной индикаторной бумаги, запишите значения рН.
Источник: mydocx.ru