Справочные данные. Поскольку E0 , то кадмий является катодным покрытием для железа. При нарушении целостности покрытия возникнет гальванический элемент, в котором железо будет анодом, кадмий – катодом, т.е. коррозии будет подвергаться железа. Например, во влажном воздухе будут протекать следующие электродные процессы: Анод: Fe — 2e → Fe2+ Катод: 2H2O + O2 + 4e → 4OHСуммарный процесс. Дальнейшее окисление.

Похожие готовые решения по химии:
- Какой элемент периодической системы и почему чаще всего загрязняет нефтепродукты
- Укажите, изменяется ли энтропия изолированной системы, в которой протекают обратимые
- Как записать выражение закона действующих масс для следующих простых реакций
- Напишите выражение Кр для гетерогенной системы CO2 + C 2CO Какими изменениями
- При 500 К константа равновесия равна 3,4·10-5 . Вычислите для этой реакции 0 G500
- Какую жесткость называют карбонатной, некарбонатной, общей? Как можно устранить карбонатную
- Какие химические процессы протекают у электродов гальванического элемента
- Сколько граммов воды разложилось, если через раствор пропустить ток силой
- Как проводятся титриметрические определения по способу титрования, по способу отдельных навесок?
- Сколько граммов воды разложилось, если через раствор пропустить ток силой
- Рассчитайте энергию фотона (в эргах) следующих длин волн: 803 нм, 3,68 мкм, 9,95 А, 11,5 см
- Напишите структурные формулы заданных липидов. Если названия жирных кислот не указаны, напишите необходимое количество остатков различных кислот, входящих
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Химия 11 класс (Урок№9 — Коррозия металлов и её предупреждение.)
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Telegram и логотип telegram являются товарными знаками корпорации Telegram FZ-LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Источник: www.evkova.org
Анодные и катодные покрытия
Как было указано выше, при защите железа от коррозии покрытием из других металлов следует руководствоваться положением этих металлов в ряду напряжений, относительно железа, т. е. нужно учитывать, будет ли металл покрытия более электроотрицателен или более электроположителен, чем железо.
В зависимости от характера защиты покрытия разделяются на анодные и катодные. Анодными покрытиями будут такие, у которых электродный потенциал в данных условиях более отрицателен, чем потенциал защищаемого металла. К катодным покрытиям относятся те металлы, у которых потенциал выше потенциала защищаемого металла.
Коррозия металлов и меры по ее предупреждению. 8 класс.
При покрытии какого-либо металла более электроотрицательным металлом в случае возникновения коррозии покрывающий металл будет играть роль анода, переходить в раствор и разрушаться, а основной металл станет катодом и тем самым будет предохраняться от коррозии.
Схема коррозии анодного покрытия показана на фиг .6.
Фиг. 6. Схема коррозии анодного покрытия: а — начало коррозии; б — результат коррозии.
К другого рода покрытиям относятся покрытия, где основной металл покрыт более электроположительным металлом. Например, в случае нанесения хромового покрытия на сталь в образовавшейся гальванической паре хром будет катодом, а сталь, которая является по отношению к хрому анодом, будет разрушаться, что приведет к отслаиванию хрома
При покрытии электроположительным металлом можно получить только механическую защиту, т. е. покрытие будет хорошо предохранять железо только до тех пор, пока оно будет сплошным и не нарушится его слой.
По отношению к стали катодными покрытиями будут, например, являться покрытия из никеля, хрома, олова, свинца, меди, серебра и др.
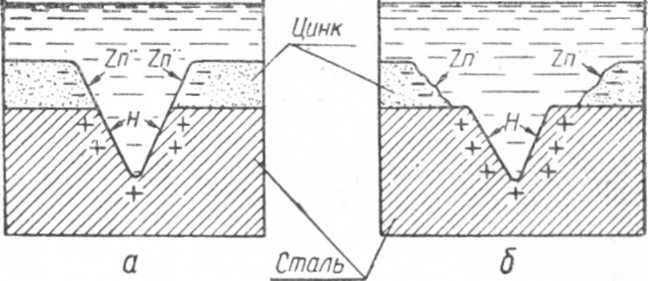
Схема коррозии катодного покрытия показана на фиг. 7.

Фиг. 7. Схема коррозии катодного покрытия: а — начало коррозии; б — результат коррозии.
На практике более широко применяют катодные защитные покрытия, используя для этой цели высокую химическую стойкость и хорошие механические свойства некоторых металлов. Основным требованием при этом будет создание сплошных беспористых покрытий, хорошо изолирующих сталь (или другой защищаемый металл) от коррозионной среды.
Коррозионные процессы возникают также (особенно часто в промышленных условиях) при погружении металлов в раствор электролита, содержащего ионы других металлов. При этом возникает электродный потенциал (но не равновесный), величина которого зависит от разнообразных причин: состояния поверхности металла, температуры и т. д. Поверхность технических металлов, будучи неоднородной физически и химически, приводит к образованию на отдельных участках разных электродных потенциалов. Места, где происходит растворение металла, будут анодными участками, места, где будут разряжаться положительно заряженные ионы, — катодными участками. Таким образом, будут возникать гальванические микроэлементы, дающие электрический ток и вызывающие разрушение металла, в случае, если он станет анодом.
Коррозия металлов и сплавов рассматривается, согласно электрохимической теории, как процесс разрушения, вызванный действием огромного количества микроэлементов — гальванических пар. [7]
Качество металлических покрытий. Качество металлического покрытия, получаемого гальваническим путем, характеризуется структурой осадка, толщиной и равномерностью его распределения на поверхности изделия и другими факторами.
Гальваническое покрытие металлами рассматривается как явление кристаллизации, в результате которого под действием тока на поверхности металла зарождаются отдельные кристаллы. Продолжая расти, эти кристаллы образуют на поверхности детали или изделия сплошное покрытие. Под структурой этого покрытия понимается размер и форма кристаллов, а также расположение их по отношению к поверхности покрываемого металла. Размер и форма кристаллов зависят в основном от скорости образования отдельных кристаллов и их роста.
На структуру металлических покрытий, полученных гальваническим методом, большое влияние оказывает такой фактор, как режим электролиза. Повышение плотности тока приводит к уменьше нию величины кристаллов в осадке. Однако в некоторых случаях такая закономерность замечается только с достижением определенной плотности тока.
Повышать плотность тока можно только до определенного предела, после которого в обычных условиях наступает нарушение процесса. Вследствие большого обеднения прикатодного слоя ионами металла наблюдается отложение металла на некоторых выступающих участках катода, где образуются так называемые дендриты. При еще более высокой плотности тока катод покрывается губчатой порошкообразной массой, состоящей из мелких отдельных кристаллов или их сростков, непрочно связанных между собой и основой.
Для защитно-декоративной отделки изделий наиболее пригодными являются мелкокристаллические покрытия, как обладающие наименьшей пористостью и тем самым лучше защищающие изделия от коррозии. В последнее десятилетие в гальванотехнике нашел применение метод отложения металлических осадков токами переменной полярности. Периодическое изменение направления тока при повышенных его плотностях позволяет получать мелкокристаллические гладкие осадки. Объясняется это следующим: во-первых, при этом ликвидируется обеднение прикатодного слоя за счет растворения покрытия, во время переключения катода на анод и соответственно снижается концентрационная поляризация. Во-вторых, те микровыступы (вершины кристаллов), которые образуются на катоде вследствие большой скорости роста на них кристаллов при переключении на анод растворяются в первую очередь, что обеспечивает образование более равномерных, гладких, в некоторых случаях блестящих осадков. [8]
Назначение и толщина металлических покрытий. В соответствии с их назначением гальванические покрытия можно разделить на следующие основные группы:
1) коррозиеустойчивые, или защитные;
Защитные свойства коррозиеустойчивого металлического покрытия определяются:
а) величиной электродного потенциала металла покрытия, сравнительно с электродным потенциалом защищаемого металла, т. е. будет ли металл покрытия при образовании гальванической пары катодом или анодом. Исключение представляют металлы, склонные покрываться пассивной пленкой (алюминий, хром). Разность между потенциалом металла покрытия и потенциалом защищаемого металла и контактирующимися с ним незащищаемыми металлами должна быть возможно наименьшей;
б) химической стойкостью металла покрытия против воздействия той среды, в которой находится изделие. В связи с этим защитные свойства покрытия зависят от того, как по своей химической природе металл покрытия будет относиться к таким химическим реагентам, как влажный воздух, морская вода, кислоты, щелочи и др.;
в) достаточной толщиной, сплошностью и сцепляемостью покрытия, а также его твердостью и сопротивляемостью механическим воздействиям. Исключительно большое значение для противокоррозионной защиты имеет качество сцепления покрытия с основным металлом, выражающееся в сращивании покрытия с основой по всей поверхности изделия. Сцепление покрытия с покрываемым металлом зависит от ряда условий, куда относятся химические свойства основного металла и металла покрытия, режим и условия процесса осаждения и главное — качество подготовки поверхности изделия в механических и гальванических цехах.
Основным требованием к коррозиеустойчивым и защитно-декоративным покрытиям является наличие достаточной для данных условий эксплуатации изделия толщины слоя покрытия.
Выбор покрытий и их толщина зависят от назначения изделий и условий их эксплуатации. Минимальные значения толщин покрытий после их отделки предусматриваются Государственными стандартами.
В зависимости от условий работы изделия устанавливаются три группы покрытий:
группа Л — для легких условий работы. Эта группа предназначена для эксплуатации изделий в закрытых, сухих, отапливаемых и вентилируемых помещениях (аналогичных жилым);
группа С — для средних условий работы. Эта группа предназначена для эксплуатации изделий в условиях закрытых помещений и наружной атмосферы, загрязненных промышленными газами, пылью, а также содержащих аэрозоли или испарения морской воды. При этом изделия не должны подвергаться непосредственному воздействию дождя или снега;
группа Ж — для жестких условий работы. Эта группа предназначена для эксплуатации изделий в условиях закрытых помещений и наружной атмосферы, загрязненных значительным количеством промышленных газов и пыли, а также при непосредственном периодическом воздействии дождя, снега или брызг морской воды.
Толщина покрытия в ряде случаев (например, с целью защиты от коррозии в жидких средах или агрессивных газах, при повышении износостойкости поверхности металла и др.) не может быть стандартизована. В каждом отдельном случае здесь необходимо учитывать интенсивность воздействия коррозионной среды, конструктивные особенности изделия, срок службы и требования к покрытию, обусловленные технологией изготовления деталей. [4]
ПОДГОТОВКА ПОВЕРХНОСТИ МЕТАЛЛИЧЕСКИХ ИЗДЕЛИЙ ПЕРЕД НАНЕСЕНИЕМ ГАЛЬВАНИЧЕСКИХ ПОКРЫТИЙ
Поверхность металлических изделий и деталей перед нанесением гальванических покрытий должна быть тщательно подготовлена и очищена от различного рода загрязнений. Окислы металла (окалина и ржавчина), минеральные масла, технические жиры, а также ранее нанесенные покрытия, шлаковые включения, другими словами, все загрязнения, препятствующие осаждению и прочному сцеплению покрытия с металлом, должны быть удалены с поверхности изделий.
Устранение неровностей, шероховатостей, пленки окалины, шлаковых включений и придание поверхности гладкого и блестящего вида достигают механической обработкой — шлифованием и полированием. Однако поверхность металлических изделий и деталей, приобретая в результате механической обработки декоративный вид, остается еще недостаточно чистой, чтобы можно было ее подвергнуть гальваническим покрытиям. Даже незначительные загрязнения, как, например, следы от пальцев на поверхности изделий, сильно ухудшают качество гальванических покрытий и ведут к различного рода дефектам. Поэтому, кроме механической обработки, необходимо применять еще очистку поверхности от окислов и жировых загрязнений химическим путем, дающую требуемую степень чистоты для гальванического покрытия. Это достигается травлением поверхности в кислотах и обезжириванием ее в растворителях и щелочных растворах с последующей промывкой водой. [1]
Источник: studfile.net
Медное изделие покрыли серебром. К какому типу относится такое покрытие – к анодному или катодному? Составьте уравнения электродных процессов коррозии этого изделия при нарушении целостности покрытия во влажном воздухе и в растворе соляной кислоты. Приведите схемы образующихся при этом гальванических элементов.


⚡ Условие + 37% решения:
Медное изделие покрыли серебром. К какому типу относится такое покрытие – к анодному или катодному? Составьте уравнения электродных процессов коррозии этого изделия при нарушении целостности покрытия во влажном воздухе и в растворе соляной кислоты. Приведите схемы образующихся при этом гальванических элементов.
Решение: Стандартный электродный потенциал меди равен 0,34 , / 2 B Cu Cu стандартный электродный потенциал серебра равен 0,80 . / B Ag Ag Так как серебро имеет больший электродный потенциал, следовательно, оно является катодом, то есть покрытие катодное. Поэтому при нарушении целостности покрытия в результате коррозии слой серебра сохраняется, а под ним активно корродирует медь.
Готовые задачи по химии которые сегодня купили:
- Укажите продукты реакции и на основании электронных уравнений расставьте коэффициенты в уравнении: …; …; Ag HNO3(конц) Be HNO3(конц)
- В гомогенной системе СО + Cl2 COCl2 равновесные концентрации реагирующих веществ (моль/л): [СО] = 0,2; [Cl2] = 0,3; [СОСl2]
- Используя аналитические реакции с групповыми реагентами, разделите в растворе катионы Pb+2 и Co+2. Напишите уравнения соответствующих реакций.
- Медный лист покрыт слоем свинца. Определите тип покрытия. Какой из металлов будет разрушаться при нарушении целостного покрытия? Какие коррозийные процессы будут идти, если изделие защитить железным протектором?
- Какой объем раствора HCl (в мл) с молярной концентрацией c1(HCl) = 10,97 моль/л необходимо взять для получения 100 мл раствора с молярной концентрацией с2(HCl) = 0,1 моль/л.
- Назовите вещества, формулы которых даны ниже, по заместительной номенклатуре ИЮПАК и укажите, какие из них являются изомерами:
- Молярная концентрация. Молярная концентрация эквивалента (нормальная концентрация). Взаимный переход от одних видов выражения концентрации к другим а) Определите молярность и нормальность растворов, содержащих: в 1 л 10,6 г карбоната натрия
- Дайте оценку качества раствора кислоты хлористоводородной 2 %-100 мл по количественному содержанию согласно приказа МЗ РФ №305 от 16.10.1997 г, если на титрование 1 мл лекарственной формы израсходовалось 0,51 мл 0,1 моль/л раствора едкого натра с К = 1,00.
- Дайте обоснование фармакопейному методу количественного определения кальция глюконата по методике ФС.2.1.0019.15 (Приложение № 3).
- Металл – Co. Получите нерастворимое основание из растворимой соли этого металла, имеющего степень окисления 3+. Из полученного основания получите оснóвную соль этого металла. Назовите это соединение.





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
Источник: lfirmal.com