Железо стоит на втором месте (4,7% в Земной коре) после алюминия по запасам и распространенности на планете. Оно обнаружено еще на заре человеческого общества и до сих пор не теряет своего значения и повсюду используется.
Чаще всего железо находят в богатых металлом рудах, которые можно относительно легко добывать и перерабатывать. В чистом виде железо находили только в метеоритах, а в соединениях оно присутствует в сульфидах, силикатах и оксидах.
Характеристика железа
Физические свойства

Железо – это серебристо-белый металл с сероватым оттенком. В чистом виде пластичен, но непрочен. При добавлении в него различных добавок (например, углерода) твердость и хрупкость сплава повышается. Железо хорошо проводит электричество, тепло и обладает мощными магнитными свойствами, то есть под действием магнитного поля оно намагничивается и потом само становится магнитом.
Железо: химические свойства, качественные реакции и строение атома #железо #химшкола #химия
Железо особенно важно для живых организмов. Оно способствует дыхательным процессам и входит в состав гемоглобина крови (477 мг/л). Это значит, что железо участвует в процессе доставки кислорода от органов дыхания к тканям.
Находясь в воде и на влажном воздухе железо меркнет и ржавеет, а при температуре 1539°С легко плавится и поддается ковке. При высоких температурах железо реагирует с паром воды.
Железо образует 300 разнообразных минералов (карбонаты, сульфиды и т.д.) и энергично мигрирует в земной коре. Его называют металлом земных недр, так как он копится в кристаллизации магмы.
Химические свойства

Железо — металл со средней степенью химической активности. На воздухе, на нем образуется защитная пленка, которая препятствует коррозии и ржавлению. Если воздух влажный, железо окисляется и покрывается ржавчиной.
Растворяется в разведенной соляной или серной кислотах, с выделением водорода. Вытесняет из растворов солей металлы. Во время нагревания взаимодействует с неметаллами.
Соединения и нахождение железа в природе

Так как месторождения железных руд возникают в разных геологических условиях, то и состав руд и условия их расположения разнообразны.
Железо содержится во многих рудах:
• гематит (железный блеск, красный железняк),
• пирит (серный колчедан) и гетит,
• магнетит (магнитный железняк),
• сидерит и гидрогенит.
Круговорот железа в природе
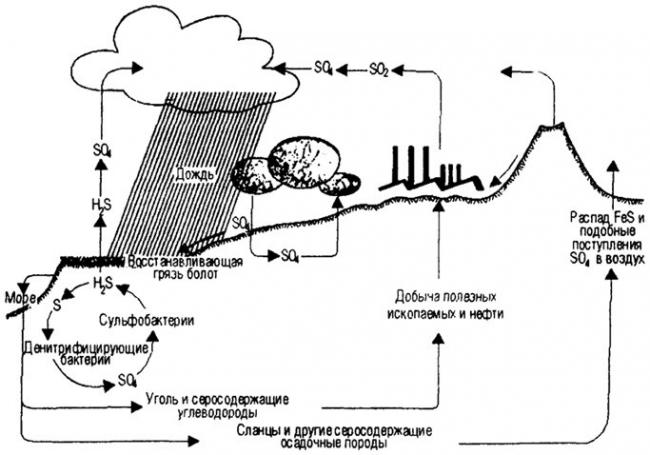
Железо. Нахождение в природе. Свойства железа. Соединения железа.
(На примере круговорота серы и других соединений в природе)
За счет жизнедеятельности железобактерий (нитевидные бактерии и одиночные железобактерии) происходит круговорот железа в природе. Они окисляют железо до гидроксида железа, а углерод получают из углекислоты. Таким образом, железобактерии получают энергию для своей жизнедеятельности, а после смерти осаждаются в почве в виде болотной руды.
Области применения железа
В чистом виде железо непрочно, поэтому практически не применяется. Его используют для выработки электромагнитов, как катализатор химических реакций и др.
Основное применение этот металл находит в виде сплавов. На их долю приходится 95% всей металлопродукции. Железо основной компонент стали и чугуна. В стали меньше углерода, чем в чугуне, и поэтому она более пластична и устойчива к резким ударным нагрузкам железа.
Так же железо входит в состав никелевых и других сплавов, использующихся в электротехнике, железо-воздушных аккумуляторах и железо — никелевых аккумуляторах.
На основе железа производятся материалы, которые могут выдерживать действие низкой и повышенной температуры, агрессивной среды, ядерных излучений, вакуума и высоких давлений и т. п.
Железо относится к группе тех металлов, которые очень широко применяются во всех областях народного и бытового хозяйства. Чугун и сталь стали основой современной техники. С их участием произошло развитие тяжелой промышленности, разнообразного наземного транспорта и др.
Большие запасы железа в России, Австралии, Канаде, Казахстане, Индии, Франции, США, Венесуэле и ЮАР.
Источник: xn—-8sbiecm6bhdx8i.xn--p1ai
Железо

Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
- Структура
- Свойства
- Запасы и добыча
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
Смотрите так же:
![]()
СТРУКТУРА
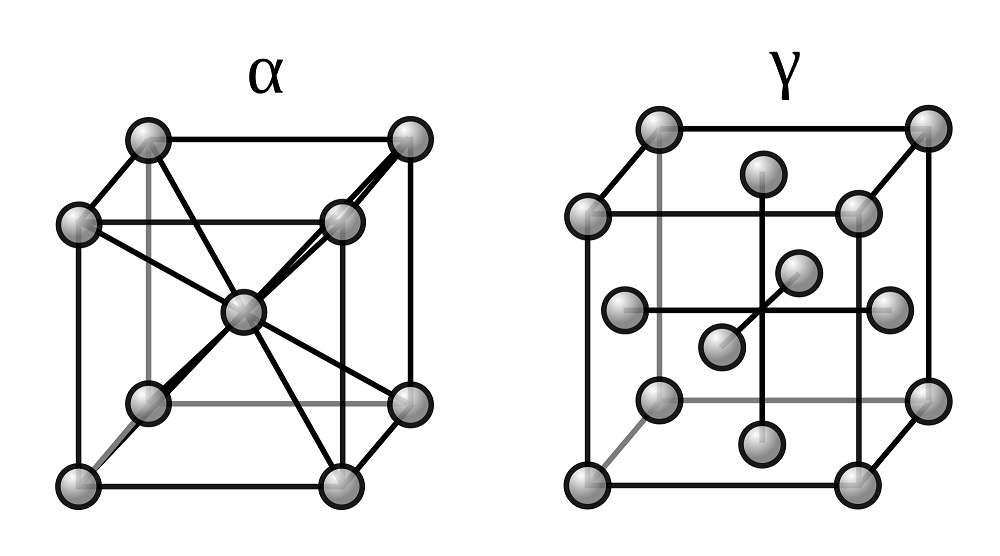
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация – γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная – α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью.
Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все.
Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, – единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля.
А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА

ПРОИСХОЖДЕНИЕ

Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов – железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) – Fe
| Молекулярный вес | 55.85 г/моль |
| Происхождение названия | возможно англо-саксонского происхождения |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
| Strunz (8-ое издание) | 1/A.07-10 |
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.17.1 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | железно-черный |
| Цвет черты | серый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | несовершенная по |
| Твердость (шкала Мооса) | 4,5 |
| Излом | в зазубринах |
| Прочность | ковкий |
| Плотность (измеренная) | 7.3 – 7.87 г/см 3 |
| Радиоактивность (GRapi) | |
| Магнетизм | ферромагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | изотропный |
| Цвет в отраженном свете | белый |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) – изометрический – гексаоктаэдральный |
| Пространственная группа | Im3m (I4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 2.8664Å |
| Двойникование | (111) также в пластинчатых массах |
| Морфология | в маленьких пузырьках |
Источник: mineralpro.ru
Железо


Одним из самых известных металлов является железо. Часто металлические изделия называют железными, но это лишь один химический элемент – металл из многих. Причем химические свойства этого элемента не так просты, как кажется. В этой статье рассмотрим физические и химические особенности железа.


План урока:
Положение в таблице Менделеева и строение атома
Железо расположено в 8 группе побочной подгруппе. У этого элемента 26 электронов, распределенных по 4 уровням. Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 . Для его атома характерно предзаполнение s-подуровня, поэтому в действительности формула следующая: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 . Железо является d-элементом. Благодаря этому, основные степени окисления железа: 0, +2, +3.
Физические свойства
Железо обладает всеми свойствами металлов:
— высокая температура плавления (1539 0 С).
Многие свойства находятся в оптимальных границах, поэтому железо часто используют при изготовлении различных изделий из металла. Для изменения определенных характеристик изготавливаются сплавы.

Основные сплавы железа
Металлы отличаются некоторыми параметрами. Например, одни обладают меньшей температурой плавления, другие большей прочностью, третьи – наиболее электропроводны. Иногда, для изменения свойств металла, его сплавляют с неметаллами (чаще всего, углерод). Самый распространенный сплав – сталь. Основу сплава составляет железо и углерод, кроме них могут добавляться различные металлы (легирующие компоненты), меняющие свойства сплава.
Таблица. Сплавы железа и их свойства


В качестве легирующих металлов стали могут использовать:
- Cr – хром
- Mo – молибден
- Ni – никель
- Si – кремний
- Cu – медь
- W – вольфрам
- Al – алюминий
- Mn – марганец
- Ti – титан
- Nb – ниобий
- Co — кобальт
Легирующими компонентами чугуна являются неметаллы: марганец, кремний, сера, фосфор и некоторые металлы (алюминий, хром).
Нахождение железа в природе
В природе железо содержится в рудах. Они могут отличаться по содержанию железа и других примесей. К основным железным рудам относятся: магнетит, гематит, пирит.
Магнетит (магнитный железняк)

Химическая формула – FeO·Fe2O3. К основному оксиду могут примешиваться различные металлы и их оксиды. Зоны залежей магнетита проводят к формированию магнитных аномалий – участков Земли, на которых магнитные приборы указывают не на полюса, а на эту залежь. По этой причине использовать компасы и электронные приборы в этих зонах бесполезно.
Магнетит добывается в Челябинской области, на Кольском полуострове, Южном Урале, на Украине (гора Кривой рог).

Кратер добычи железной руды в Курской Магнитной Аномалии. Источник
Пирит
Химическая формула — FeS2 (серный или железный колчедан). Может содержать примеси Mn, Ni, Co. Это минерал желтого цвета. Из-за внешнего сходства его часто путали с золотом, поэтому этот минерал часто называют золотом дураков. Хотя, самородное золото часто содержится в пирите в виде примесей и даже встраивается в го кристаллическую решетку.

Считается одним из самых распространенных сульфидов. Залежи пирита расположена во всех геотермальноактивных зонах, а также, в донных отложениях Черного моря.
При контакте с воздухом окисляется до лимонита (FeOOH·(Fe2O3·nH2O).
Пирит используется для получения серной кислоты, сероводорода или в строительном деле в качестве добавки в цемент.
Гематит

Химическая формула — Fe2O3. С давних времен минерал использовался для изготовления красок, ритуальных украшений и лекарственных препаратов. В настоящее время является основным источником получения чугуна.
- Украинское (Кривбасс);
- Михайловское (КМА);
- Колатсельгские штольни;
- Байкальское месторождение;
- Альпийское;
- Кутим.
Кроме минералов существует еще метеоритное железо. Это форма металла, попавшего на Землю из космоса. Во время прохождения через плотные слои атмосферы все примеси метеорита сгорают. Такое железо считается самым чистым. Оно практически не подвергается коррозии.
Способы получения
Основным способом получения железа является выделение из минеральных руд. Основным считается доменный процесс. Выделение железа производится в несколько стадий.
Доменная печь

Таблица. Стадии доменного процесса

Мартеновская печь
Для снижения содержания примесей в чугуне, полученный материал отправляют в Мартеновскую печь. Это плавильная установка. Процесс увеличения доли железа происходит в три этапа:
- Плавление. Здесь образуется большое количество FeO.
- Окисление. С+ FeO = Fe+CO. в результате реакции доля углерода снижается.
- Раскисление. Окисление оставшегося FeO алюминием, ферромарганцем или ферросилицием.
Электрическая печь
Установка предназначена для получения легированной стали. Установка разогревается до высоких температур (цифра зависит от итогового сплава) и добавляется окислительный материал (нихром, фехраль и т.д.).
Химические свойства железа
Железо – элемент средней активности. Без нагревания многие реакции даже с сильными окислителями идут крайне медленно. При повышении температуры скорость взаимодействия увеличивается.
Взаимодействие с неметаллами
С неметаллами железо образует бинарные соединения – соли или оксиды.
Важная особенность: при взаимодействии с простыми веществами (кроме кислорода), железо проявляет степень окисления +3.
С кислородом образуется сразу два оксида со степенями окисления +2 и +3:
Взаимодействие с водой
Железо реагирует с парами воды в раскалённом состоянии:
Отношение железа к кислотам
С концентрированными кислотами железо не реагирует (пассивирует).
С растворами реакция идет также как и у других металлов – с образованием соли и водорода. Важно: при реакции со сложными соединениями железо проявляет степень окисления +2.
Реакция с солями

Железо реагирует с солями, металл которых пассивнее железа. Это значит, он должен располагаться левее в ряду активности металлов.
Смешанный оксид Fe3O4
Интересным соединение железа является смешанный оксид. Его особенность в том, что в одной кристаллической решетке есть сразу два иона железа — +2 и +3. Так как они образуют единый комплекс, часто их записывают как один оксид. На самом деле это кристаллогидрат двух оксидов: FeO⋅Fe2O3. Для него характерны следующие реакции:
Гидроксиды железа 2 и 3
Гидроксиды железа являются амфотерными соединениями, но с разной степенью основности.
Fe(OH)2
Гидроксид железа (II) – соединение коричневого или буро-оранжевого цвета.

Природный минерал с этой формулой называется амакинит.
Проявляет все химические свойства основных гидроксидов (реакции замещения с солями, кислотами).
Как амфотерное соединение способен реагировать со щелочами с образованием комплексных солей:
Гидроксид железа (II) является компонентом железо-никелевых аккумуляторов.
Fe(OH)3

Соединение красно-коричневого цвета.
Проявляет амфотерные свойства.
В природе встречается в составе минерала лимонита.
Проявляет химические свойства как и Fe(OH)2.
Применение железа
Железо является основным элементом черной металлургии, где используются сплавы этого вещества. Железные изделия необходимы в строительном, отделочном, электронном ремесле. В чистом виде оно применяется в химической промышленности, для изготовления аккумуляторов, для очистки сточных вод.
Источник: 100urokov.ru