Железо — элемент восьмой группы четвёртого периода Периодической системы химических элементов Д. И. Менделеева.
А томный номер — 26. Символ – Fe (лат. «ferrum»). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Физические свойства железа
Железо – металл серого цвета. В чистом виде оно довольно мягкое, ковкое и тягучее. Электронная конфигурация внешнего энергетического уровня – [Ar]3d 6 4s 2 . В своих соединениях железо проявляет степени окисления «+2» и «+3». Температура плавления железа – 1539 С. Железо образует две кристаллические модификации: α- и γ-железо.
Первая из них имеет кубическую объемноцентрированную решетку, вторая – кубическую гранецентрированную. α-Железо термодинамически устойчиво в двух интервалах температур: ниже 912 и от 1394 С до температуры плавления. Между 912 и 1394 С устойчиво γ-железо.
Механические свойства железа зависят от его чистоты – содержания в нем даже весьма малых количеств других элементов. Твердое железо обладает способностью растворять в себе многие элементы.
9 класс. Железо. Химические свойства. Ч1
Химические свойства железа
Во влажном воздухе железо быстро ржавеет, т.е. покрывается бурым налетом гидратированного оксида железа, который вследствие своей рыхлости не защищает железо от дальнейшего окисления. В воде железо интенсивно корродирует; при обильном доступе кислорода образуются гидратные формы оксида железа (III):
При недостатке кислорода или при затрудненном доступе образуется смешанный оксид (II, III) Fe3O4:
Железо растворяется в соляной кислоте любой концентрации:
Аналогично происходит растворение в разбавленной серной кислоте:
В концентрированных растворах серной кислоты железо окисляется до железа (III):
Однако, в серной кислоте, концентрация которой близка к 100%, железо становится пассивным и взаимодействия практически не происходит. В разбавленных и умеренно концентрированных растворах азотной кислоты железо растворяется:
При высоких концентрациях азотной кислоты растворение замедляется и железо становится пассивным.
Взаимодействие железа с серой (порошок), азотом и фосфором также происходит при нагревании:
Железо способно реагировать с такими неметаллами, как углерод и кремний:
Среди реакций взаимодействия железа со сложными веществами особую роль играют следующие реакции — железо способно восстанавливать металлы, стоящие в ряду активности правее него, из растворов солей (1), восстанавливать соединения железа (III) (2):
Железо, при повышенном давлении, реагирует с несолеобразующим оксидом – СО с образованием веществ сложного состава – карбонилов — Fe(CO)5, Fe2(CO)9 и Fe3(CO)12.
Железо при отсутствии примесей устойчиво в воде и в разбавленных растворах щелочей.
Получение железа
Основной способ получения железа – из железной руды (гематит, магнетит) или электролиз растворов его солей (в этом случае получают «чистое» железо, т.е. железо без примесей).
Примеры решения задач
| Задание | Железная окалина Fe3O4 массой 10 г была сначала обработана 150 мл раствора соляной кислоты (плотность 1,1 г/мл) с массовой долей хлороводорода 20%, а затем в полученный раствор добавили избыток железа. Определите состав раствора (в % по массе). |
| Решение | Запишем уравнения реакций согласно условию задачи: |
Зная плотность и объем раствора соляной кислоты, можно найти его массу:
Химия 9 класс : Железо
msol(HCl) = 150×1,1 = 165 г.
Рассчитаем массу хлороводорода:
m(HCl) = 165×20%/100% = 33 г.
Молярная масса (масса одного моль) соляной кислоты, рассчитанная с помощью таблицы химических элементов Д.И. Менделеева – 36,5 г/моль. Найдем количество вещества хлороводорода:
v(HCl) = 33/36,5 = 0,904 моль.
Молярная масса (масса одного моль) окалины, рассчитанная с помощью таблицы химических элементов Д.И. Менделеева – 232 г/моль. Найдем количество вещества окалины:
Согласно уравнению 1, v(HCl): v(Fe3O4) = 1:8, следовательно, v(HCl) = 8 v(Fe3O4) = 0,344 моль. Тогда, количество вещества хлородорода, рассчитанное по уравнению (0,344 моль) будет меньше, чем указанное в условии задачи (0,904 моль). Следовательно, соляная кислота находится в избытке и будет протекать еще одна реакция:
Определим количество вещества хлоридов железа, образующихся в результате первой реакции (индексами обозначим конкретную реакцию):
Определим количество хлороводорода, которое не прореагировало в реакции 1 и количество вещества хлорида железа (II), образовавшееся в ходе реакции 3:
vrem(HCl) = v(HCl) – v1(HCl) = 0,904 – 0,344 = 0,56 моль;
Определим количество вещества FeCl2, образовавшегося в ходе реакции 2, общее количество вещества FeCl2 и его массу:
Определим количество вещества и массу железа, вступившего в реакции 2 и 3:
m(Fe) = vsum(Fe) ×M(Fe) = 0,323 ×56 = 18,088 г.
Вычислим количество вещества и массу водорода, выделившегося в реакции 3:
Определяем массу полученного раствора m’sol и массовую долю FeCl2 в нём:
m’sol = 165 + 10 + 18,088 – 0,56 = 192,528 г;
| Задание | Какие процессу будут протекать при погружении цинковой пластинки в раствор хлорида железа (II)? Как изменится масса хлорида железа (II) в растворе? |
| Решение | Хлорид железа (II) в растворе подвергается гидролизу: |
FeCl2 + HOH ↔FeOHCl +HCl;
Fe 2+ + HOH ↔ FeOH + + H + .
Цинк будет взаимодействовать с кислотой:
Zn + 2H + = Zn 2+ + H2↑.
Так как цинк более активный металл, чем железо (расположен в ряду напряжений левее железа), то он вытесняет железо из соли:
Zn + Fe 2+ = Zn 2+ + Fe .
В результате, масса хлорида железа (II) в растворе уменьшится.
Источник: ru.solverbook.com
Железо как химический элемент таблицы Менделеева
Ж Железо является химическим элементом таблицы Менделеева с атомным номером 26 и условным обозначением Fe. Железо представляет собой серебристо-белый переходной металл 8-й подгруппы.
- Как было открыто Железо ;
- Где и как добывают Железо;
- Распространенность Железа;
- Применение Железа;
- Интересные факты
Как было открыто Железо

История такого химического элемента как железо началась очень давно. Оно не имело столь широкого круга применения в древности, как бронза, из-за его подверженности коррозии. Об этом свидетельствуют археологические находки. Железные предметы древности находят в разы реже, чем аналогичные артефакты из бронзы или серебра.
Технологии развивались очень медленно, и даже с открытием технологии плавки потребовалось еще несколько сотен лет, чтобы железо вытеснуло бронзу в инструментах и оружии. Чтобы было понятно, железные бусы найденные в Египте имеют возраст около 5500 лет.
В большей степени этот элемент начал набирать популярность около 700 года до Нашей Эры. Приблизительно в это время начали появляться печи и кузницы для плавки и обработки железа. Вблизи современной Болоньи, археологами были обнаружены изделия из железа(наконечники копья), возраст которых приблизительно датируется VI веком до Нашей Эры.
Далее технологии плавильного дела начали набирать обороты и в период 3 — 5 столетия начали усовершенствоваться плавильные печи. До 18 века плавильные печи являлись единственным способом обработки железа. Эти печи могли к этому времени раскаляться до температуры около 1200°C. Это значит, что полностью плавить железо они все-таки еще не умели, потому что температура плавления железа составляет 1536°C.
Уже в начале XVIII века начали появляться печи способные полностью плавить железную руду. В это время плавильная индустрия начала активно развиваться и в это время свершилась так называемая «промышленная революция». Появилась возможность в промышленных масштабах производить некоторые виды сталей и чугун.
Где и как добывают Железо

Железо в основном добывают из так называемых железных руд. Железные руды представляют собой горные породы и минералы, из которых металлическое железо может быть извлечено экономически выгодно. Такие руды, как правило богаты окислами железа и различаются по цвету от темно-серого до ярко-красного.
Под железной рудой обычно понимаются такие минералы как магнетит, гематит, гетит, лимонит и сидерит. Самыми ценными из них являются гематит и магнетит. Эти минералы содержат более 60% железа и их называют «руда прямой отгрузки». Такое название они получили потому что могут подаваться сразу в доменные печи производящие железо.
Получение чистого железа в лабораторных условиях может осуществляться двумя способами. Первый заключается в восстановлении чистого оксида или гидроксида железа водородом. В ходе реакции образуется пентакарбонил железа, который при нагреве до 250°C разлагается в чистый железный порошок. Вторым способом является электролиз хлорида железа на железный катод.
Распространенность Железа

Оценка распространенности железа во Вселенной довольно относительная. Явным фактом является то, что это очень распространенный элемент. Железо, по оценкам ученых, занимает 6 позицию по распространенности среди химических элементов. В доказательство тому, что железо является конечным продуктом ядерного синтеза кремния в ядрах звезд.
Он является самым распространенным элементом в ядрах планет и метеоритах. Считается, что ядро Земли состоит из железно-никелевого сплава и весит приблизительно 35% от общей массы земли.
Что же касается Земли, то тут есть предположение, что железо может быть самым распространенным химическим элементом. Таким образом на Земле он занимает либо первую позицию, либо вторую после кислорода. Пока официальная наука отдает этому элементу почетную вторую позицию. Как это странно не звучит, в земной коре железо занимает только 4 позицию.
Его концентрация в земной коре составляет 5,63%. В мировом океане среднее значение концентрации железа составляет 0,002 мг/л воды.
Большая часть железа в земной коре находится в связанном состоянии с другими химическими элементами в виде минералов. Некоторые из них были перечислены выше, чтобы не повторяться, не будем на них останавливаться. Добавим только то, что многие магматические породы также содержат атомы железа.
В пример можно поставить сульфитный минерал пирротин или железно-никелевый минерал пентландин. Во время выветривания(разложения) железо может отделяться от сульфидных минералов в виде сульфатов и от силикатных отложений в виде гидрокарбоната. Ежегодное производство железа и его сплавов превышает 2,5 миллиардов тонн.
Применение Железа

Железо является самым используемым металлом на нашей планете. На его долю приходится около 90% мирового производства среди металлов. Его низкая стоимость и высокая прочность довольно часто делают его предпочтительным материалом для механизмов или изделий, которые способны передавать механическую энергию и испытывать серьезные механические нагрузки. В пример можно поставить конструкции автомобилей, станков, корпуса воздушных и морских судов, арматурные стержни и рельсы. Поскольку само железо является довольно мягким материалом, оно в основном используется в виде чугуна или стальных сплавов.
В зависимости от добавляемых к железу так называемых «присадок» для получения заданных свойств железных изделий, они имеют разные направления применения. Например, с помощью добавления углерода регулируется прочность на растяжение и твердость. Для изготовления ножа или пилы потребуется твердый металл, а для изготовления консервной банки такая прочность нецелесообразна.
Также важна чистота от других химических элементов. Если не производить очистку от таких элементов как сера, фосфор и кремний получается чугун. Он так же имеет широкий круг применения. Из него производятся блоки цилиндров автомобилей, домашние ванны и батареи, технические тиски и многое другое.
Разновидностей макировок железа больше тысячи, и у каждого из них свое предназначение. У железных изделий очень широкий круг применения практически во всех сферах. Начиная от медицины(препараты регулирующие уровень железа в организме) и заканчивая строительством(железобетонные конструкции).
Интересные факты

Интересных фактов связанных с железом большое множество. Стоит начать с того, что атомы железа являются жизненно необходимыми в организме человека. Они регулируют фиксацию азота в организме, обеспечивают транспортировку электрических импульсов(нервное регулирование), а также транспортировку и усвоение кислорода.
Еще одним интересным фактом является то, что в древности из железа собранного из метеоритов делали украшения. Самым известным украшением древности из метеорного железа является жемчужины найденные археологами в современном Египте. Им приблизительно 5200 лет.
Еще одним интересным моментом является то, что красный цвет планеты Марс объясняется огромной концентрацией содержания гематита на его поверхности. Гематит представляет собой оксид железа с примесями титана, марганца и алюминия. Так же железо может в больших концентрациях быть вредной для здоровья человека. Есть предположение, что передозировка железа в организме способна вызывать гепатит, рак и болезнь Паркинсона. Еще одним интересным моментом является то, что по состоянию на 2010 среднеэкспортная цена за тонну железа составила 55 евро.
Источник: biobloger.ru
Урок 11. Железо
Железо — химический элемент восьмой группы, четвёртого периода, следовательно, строение его атома можно изобразить схемой:
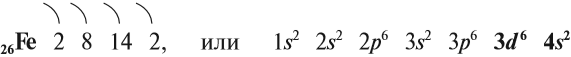
Железо — очень распространённый элемент периодической системы. Среди химических элементов, которые входят в состав Земной коры, оно занимает четвёртое место. В центре Земли имеется массивное железно-никелевое ядро, которое обеспечивает естественный магнетизм Земли.
Хотя атом железа в соединениях может проявлять степени окисления +2, +3, +6, в природе встречаются соединения преимущественно трёхвалентного железа:
Все эти руды имеют буро-красную окраску. Интересно, что от этой окраски произошло слово руда: «рудый» означает «рыжий». Дело в том, что железные руды встретились человеку давным-давно, и с освоения этих руд началась наша цивилизация, поскольку для разработки технологии выплавки железа из руды потребовались значительные интеллектуальные усилия, все знания, которых накопил человек.
Атомы железа (II) входят в состав гемоглобина крови. Именно эти атомы связывают кислород и транспортируют его по всем клеткам нашего организма. При этом атом железа становится трёхвалентным, с характерной для этого состояния «кровавой» окраской. Кстати, название руды «гематит» и означает «кровавый».
Железо — серебристо-белый пластичный металл. Это металл средней активности, тем не менее оно может реагировать с активными неметаллами (галогены, кислород, сера, углерод), кислотами, а при особых условиях — с водой. При этом если реакция происходит с сильным окислителем, то образуется соединение трёхвалентного железа. Впрочем, если в результате реакции образуется соединение двухвалентного железа, то на воздухе это соединение быстро окисляется до трёхвалентного состояния. Например, с сильным окислителем хлором образуется хлорид Fe (III):
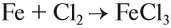
А при взаимодействии с соляной кислотой, атом хлора которой может проявлять только восстановительные свойства, образуется хлорид железа (II).
Задание 11.1. Составить уравнение реакции взаимодействия железа с серой, водой, соляной кислотой, разбавленной азотной кислотой.
Соли железа (II) и (III) имеют разную окраску: растворы соединений железа (II) бесцветные, а растворы железа (III) — окрашены в жёлтый цвет.
При взаимодействии с щелочами из растворов солей железа можно получить его гидроксиды. Они так сильно отличаются друг от друга по цвету, что эту реакцию можно считать качественной на соединения железа с разной степенью окисления. Так, из солей Fe (II) выделяется белый (в инертной атмосфере) осадок, который на воздухе мгновенно зеленеет:
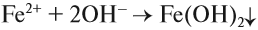
На воздухе этот осадок «ржавеет», становится буро-оранжевым. Состав полученного осадка очень близок к составу ржавчины:
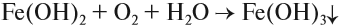
Наиболее чувствительной качественной реакцией на Fe 3+ является реакция с роданидом калия:
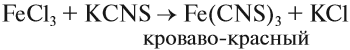
Оксид и гидроксид железа (II) проявляют основные свойства, т. е. реагируют с кислотами, но не реагируют со щелочами. В отличие от них, оксид и гидроксид железа (III) проявляют слабые амфотерные свойства. Это означает, что при обычных условиях эти вещества реагируют с кислотами и не реагируют со щелочами, но при сплавлении они со щелочами реагируют:
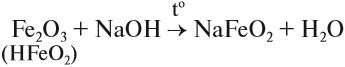
Кроме того, они растворяются в горячих, концентрированных растворах щелочей.
Таким образом, на примере свойств соединений железа ещё раз убеждаемся в справедливости закономерности: при возрастании степени окисления атома металла усиливаются и кислотные, и окислительные свойства соединений.
Действительно, для соединений двухвалентного железа характерны восстановительные свойства: они окисляются просто на воздухе. Для соединений трёхвалентного железа характерны окислительные свойства, они могут находиться в растворе длительное время. Единственное, что «угрожает» солям трёхвалентного железа, — гидролиз, поскольку эти соли соответствуют более слабому основанию.
Задание 11.2. Составьте уравнение реакции гидролиза хлорида железа (III).

Получение железа (чугуна и стали)
Производство чугуна основано на восстановительных свойствах углерода. Чугун образуется в домнах, куда загружают смесь кокса и железной руды. В результате горения кокса образуется необходимое для реакции тепло и сильный восстановитель — угарный газ:
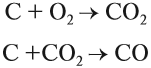
Впрочем, и кокс является прекрасным восстановителем:
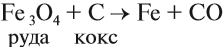
Угарный газ является основным восстановителем доменного процесса, поскольку ввиду газообразного состояния имеет высокую реакционную способность, способен проникать в любую точку домны. Кроме того, он не образует цементита. Эти реакции восстановления происходят при температуре 450…700 °C:
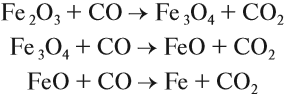
Полученный углекислый газ, реагируя с избытком кокса, вновь превращается в угарный газ:
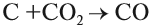
и процесс продолжается. Он происходит в верхней части домны. Выделяющееся в твёрдом виде железо опускается в нижнюю часть домны, контактирует с коксом, начинает плавиться, так как температура в этой части печи превышает 1300 °C. Кокс, образуя сплав с железом (чугун), понижает температуру плавления железа на 400°; одновременно с этим часть железа образует цементит:
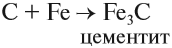
Для предохранения расплавленного железа от окисления в исходную смесь добавляют флюсы. Это известняк, который является поставщиком углекислого газа и, всплывая на поверхность, образует защитную плёнку.
Полученный чугун содержит до 4,5 % углерода, он используется для получения стали. Цель переработки — удаление примесей углерода, фосфора, серы. Готовая сталь должна содержать 0,3…2 % углерода. Кроме того, в сталь вводят различные добавки, которые изменяют её свойства. Так, нержавеющая сталь содержит около 12 % хрома.
Сталь является основным сплавом машиностроения, но легко ржавеет, так как подвергается коррозии (см. урок 8.4).

Выводы
Железо — главный металл нашей цивилизации. Станки, различные машины и механизмы, строительные конструкции, мосты, трубы — всё состоит из железа, точнее, стали или чугуна. Это достаточно активный металл, поэтому легко образует различные соединения, в которых чаще всего проявляет валентность III. Такие соединения имеют обычно красно-коричневую окраску (ржавчина).
Источник: himi4ka.ru