3. Какому элементу соответствует строение электронной оболочки 2е 8е 14е 2е?
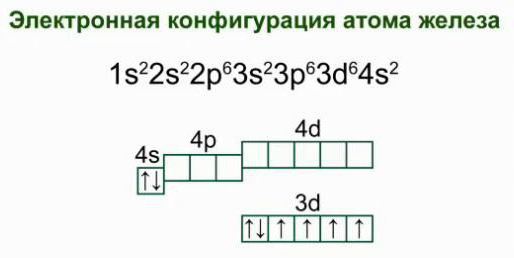
4. Составьте электронную конфигурацию атома железа.
5. Какие с.о. железа вам известны?
II. Содержание железа в земной коре (в %): …
Вывод о нахождении железа в природе:
III. План характеристики физических свойств металла железа:
1. В каком агрегатном состоянии находится железо при данных условиях?
2. Какого цвета? Блеск?
3. Имеет ли железо запах?
4. Проявляет ли данный металл пластичность, хрупкость, эластичность?
5. Растворяется ли в воде при данных условиях?
6. Какова температура плавления?
7. Какова плотность вещества?
8. Обладает ли железо теплопроводностью и электропроводностью?
9. Сравните технически чистое железо и химически чистое железо.
IV. Химические свойства железа:
2. Взаимодействие железа с ________________:
3. Взаимодействие с ____________________:
4. Взаимодействие с ____________________:
93. Электронная оболочка железа
Результаты лабораторного опыта №1
V. Качественные реакции на ионы Fe +2 и Fe +3 :
Результаты лабораторного опыта №2
VI. Роль железа в жизнедеятельности организмов- составить кластер
VII. Домашнее задание:
1. На каких физических и химических свойствах основано применение в технике железа и его сплавов?
2. Осуществите цепочку превращения:
Fe → Fe 2 O 3 → FeBr 3 → Fe(OH) 3 → Fe 2 O 3 → Fe
1. Осуществите цепочку превращения:
Fe 2 (SO 4 ) 3 → Fe(OH) 3 → Fe 2 O 3 → FeCl 3 →Fe(OH )3 → FePO 4
2. Решите задачу:
Железо массой 2,8 грамма прореагировало с хлором. Полученный хлорид железа растворили в 200 граммах воды. Рассчитайте массовую долю соли в полученном растворе.
По теме: методические разработки, презентации и конспекты

Рабочая программа учебной дисциплины «Техническое оснащение и организация рабочего места»
Рабочая программа учебной дисциплины является частью основной профессиональной образовательной программы в соответствии с ФГОС по проф.
Рабочая программа по физкультуре по теме: Рабочая программа дополнительного образования детей «Игра в пионербол» для учащихся 2-4 классов
Особенностью программы является то, что она, основываясь на курсе обучения игре в пионербол, раскрывает обязательный минимум учебного материала для такого рода программ. Курс обучения игре в пионербол.

РазделVIII рабочей программы по литературе, 5 кл . Электронное приложение.Презентации к урокам литературы в 5 классе, 1 четверть. Электронное приложение к рабочей программе
Презентации помогают учителю более ярко, чётко и доступно представить изучаемый материал, познакомить учеников с биографическими данными, осбенностями творчества поэтов, писателей.
Химия 9 класс : Железо

Рабочая программа дополнительного образования кружок «Золушка» Рабочая программа дополнительного образования кружок «Золушка»
Срок реализации программы (октябрь-май) на учебный курс отводится 32 час (из расчета 1 час в неделю).

План составления рабочей программы /на примере рабочей программы по математике для 4 класса (VIII вида)
Презентация в помощь при создании рабочих программ по учебным предметам.

Аннотация к рабочей программе по математике (алгебре и началам анализа), 11 класс , профильный уровень; рабочая программа по алгебре и началам анализа профильного уровня 11 класс и рабочая программа по алгебре и началам анализа базового уровня 11 класс
Аннотация к рабочей программе по МАТЕМАТИКЕ (алгебре и началам анализа) Класс: 11 .Уровень изучения учебного материала: профильный.Программа по алгебре и началам анализа для 11 класса составлена на ос.

Рабочая программа по русскому языку 5 класс Разумовская, рабочая программа по литературе 5 класс Меркин, рабочая программа по русскому языку 6 класс разумовская
рабочая программа по русскому языку по учебнику Разумовской, Львова. пояснительная записка, календарно-тематическое планирование; рабочая программа по литературе 5 класс автор Меркин. рабочая программ.
Источник: nsportal.ru
Железо Fe d- элемент VIII группы; порядковый номер – 26; атомная масса – 56 Металл средней активности, восстановитель. Основные степени окисления: +2, — презентация
Презентация на тему: » Железо Fe d- элемент VIII группы; порядковый номер – 26; атомная масса – 56 Металл средней активности, восстановитель. Основные степени окисления: +2,» — Транскрипт:
2 Fe d- элемент VIII группы; порядковый номер – 26; атомная масса – 56 Металл средней активности, восстановитель. Основные степени окисления: +2, +3 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 Строение атома
3 В природе – седьмой по химической распространенности элемент (четвертый среди металлов, первый тяжелый металл); находится в химически связанном виде. Многие метеориты состоят из самородного железа. Входит в состав многих минералов и горных пород. Входит в состав различных белков (хлорофилл, гемоглобин, ферменты, витамины). В организме взрослого человека имеется 4-5 г железа. Нахождение в природе
4 Получение чистого железа в промышленности – электролиз раствора солей железа, например: FeCl 2 = Fе(катод) + Cl 2 (анод) (электролиз) Восстановление оксидов железа водородом: FeO + H 2 = Fe + H 2 O Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O Восстановление из оксидов углём или оксидом углерода (II) FeO + C = Fe + CO Fe 2 O 3 + 3CO = 2Fe + 3CO 2 Способы получения
9 Физические свойства Железо типичный металл, в свободном состоянии серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности углерод) повышают его твердость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
10 Горение: ЗFе = (Fе +2 Fе +3 2 )0 4 (160 °С) Взаимодействие с парами воды: ЗFе + 4Н 2 О (пар) = (Fе +2 Fe +3 2 )О 4 + 4Н 2 (800 °С) Взаимодействие с неметаллами при нагревании: 2Fe + 3Br 2 = 2FeBr 3 (200 0 C) Fe + S = FeS (600 0 C) Взаимодействие с кислотами: Fe + 2HCl(раза.) = FeCl 2 + H 2 (без доступа воздуха) Fe + H 2 SO 4 (раза.) = FeSO 4 + H 2 (в атмосфере CO2) Химические свойства
11 В концентрированных кислотах–окислителях железо растворяется только при нагревании : 2Fe + 6H 2 SO 4 (конц.) = Fe 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O Fe + 6HNO 3 (конц.) = Fe(NO 3 ) 3 + 3NO 2 + 3H 2 O Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей. Fe + CuSO 4 = FeSO 4 + Cu
12 Применение Железо самый употребляемый металл, на него приходится до 95 % мирового производства металлов.
13 Кузовникова Е.В. 11 А Учитель: Анисимова Ю.В.
Источник: www.myshared.ru
Железо: строение атома, схема и примеры. Электронное строение атома железа
Рассмотрим электронное строение атома железа, а также его расположение в таблице Менделеева. Выявим основные физические и химические свойства данного элемента, области использования.
Положение в ПС
Железо является д-элементом 8 группы (побочной подгруппы). Имеет 26 порядковый номер, относительную атомную массу — 56, в его атоме содержится 26 протонов, 26 электронов, а также 30 нейтронов. Данный металл имеет среднюю химическую активность, проявляет восстановительные свойства. Характерные степени окисления: +2, +3.
Особенности строения атома
Что собой представляет электронная схема строения атома железа? Если рассматривать распределение электронов по энергетическим уровням, получим следующий вариант:
2е; 8е; 14 е; 2е. Такое строение электронной оболочки атома железа свидетельствует о его расположении в побочной подгруппе, подтверждает принадлежность к д-семейству элементов.

Нахождение в природе
В магнитном железняке содержится около семидесяти двух процентов металла. Основные месторождения магнетита располагаются в Курской магнитной аномалии, а также на Южном Урале. В кровавике процентное количество железа достигает 65 процентов. Гематит был обнаружен в Криворожском районе.

Значение для растений и животных
Какую роль в живых организмах выполняет железо? Строение атома поясняет его восстановительные свойства. Данный химический элемент входит в состав гемоглобина, придавая ему характерную красную окраску. Около трех граммов чистого железа, большая часть которого включена в гемоглобин, обнаружена в организме взрослого человека. Основным предназначением является перенос к тканям из легких активного кислорода, а также вывод образующегося углекислого газа.
Необходим этот металл и растениям. Входя в состав цитоплазмы, он принимает активное участие в процессах фотосинтеза. Если в растении недостаточно железа, его листья имеют белую окраску. При минимальных подкормках солями железа листья растений приобретают зеленый цвет.