Водород, его положение в периодической системе химических элементов д. И. Менделеева, строение атома и молекулы, физические и химические свойства, получение, применение.
Характеризуя водород по положению в периодической системе химических элементов Д. И. Менделеева, следует обратить внимание на особенности строения атома водорода — самого простейшего из химических элементов (состоит из ядра, представляющего собой один протон, и одного электрона). Такое строение обусловливает разнообразие свойств водорода, его двойственное положение в системе Д. И. Менделеева — в I и VII группах (об этом можно рассказать по желанию)*.
Наиболее распространенная степень окисления водорода +1. Водороду свойственна валентность, равная единице. Молекула водорода двухатомная, связь ковалент-ная неполярная.
Схема образования молекулы водорода: 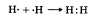 Водород — газ без цвета и запаха, плохо растворим в воде, в 14,5 раз легче воздуха. л Так же как и у щелочных металлов (Li, Na, К и др.), у Н на внешнем электронном слое один электрон, с другой стороны, так же как и элементам VII группы, водороду не хватает одного электрона до его завершения. Водород — самый распространенный элемент во Вселенной.
Водород — газ без цвета и запаха, плохо растворим в воде, в 14,5 раз легче воздуха. л Так же как и у щелочных металлов (Li, Na, К и др.), у Н на внешнем электронном слое один электрон, с другой стороны, так же как и элементам VII группы, водороду не хватает одного электрона до его завершения. Водород — самый распространенный элемент во Вселенной.
68% учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?
На Земле водород содержится в воде, природном газе, нефти. Получение водорода следует выразить уравнениями химических реакций.
Например, в лаборатории водород получают при взаимодействии металлов с растворами кислот, например соляной: 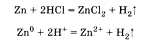 В промышленности водород получают из водяного пара при взаимодействии его с коксом, который в основном состоит из углерода, из природного газа метана СН4 и др. При характеристике химических свойств водорода необходимо записать уравнения соответствующих реакций. Водород может быть как восстановителем, так и окислителем:
В промышленности водород получают из водяного пара при взаимодействии его с коксом, который в основном состоит из углерода, из природного газа метана СН4 и др. При характеристике химических свойств водорода необходимо записать уравнения соответствующих реакций. Водород может быть как восстановителем, так и окислителем: 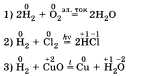
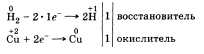 По желанию учащийся может рассказать об окислительных свойствах водорода, которые он проявляет, например, при взаимодействии с металлами:
По желанию учащийся может рассказать об окислительных свойствах водорода, которые он проявляет, например, при взаимодействии с металлами: 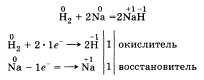 Говоря о применении водорода, стоит рассказать о его использовании в синтезе НСl и NH3, а также резке, сварке и получении металлов, в переработке нефти и жиров.
Говоря о применении водорода, стоит рассказать о его использовании в синтезе НСl и NH3, а также резке, сварке и получении металлов, в переработке нефти и жиров.
Задача. Какой объем кислорода и воздуха (н. у.) потребуется для сжигания 448 л метана СН4?


Вода, ее состав, строение молекулы, физические и химические свойства (разложение, отношение к натрию, оксидам кальция, серы (IV)). Основные загрязнители природной воды, очистка природных и сточных вод.
Вода — самое распространенное в природе соединение. Молекула ее состоит из двух атомов водорода и одного атома кислорода (Н2О).
Молекула воды имеет угловую форму и образована по типу ковалентной полярной химической связи: 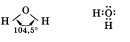 В ходе рассказа о физических свойствах воды можно подчеркнуть, что это единственное соединение, которое в природных условиях существует в трех агрегатных состояниях (твердом, жидком и газообразном). Рассказ о химических свойствах воды целесообразно сопровождать записями уравнений реакций.
В ходе рассказа о физических свойствах воды можно подчеркнуть, что это единственное соединение, которое в природных условиях существует в трех агрегатных состояниях (твердом, жидком и газообразном). Рассказ о химических свойствах воды целесообразно сопровождать записями уравнений реакций.
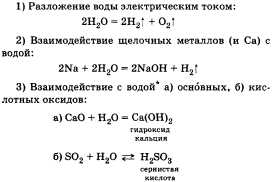 Далее следует рассказать о значении воды в природе и жизнедеятельности человека. Вода составляет 2/3 от массы человеческого организма. Рассказ будет выглядеть более полным, если в нем удастся раскрыть важность использования воды как универсального растворителя в природе, быту, промышленности, сельском хозяйстве.
Далее следует рассказать о значении воды в природе и жизнедеятельности человека. Вода составляет 2/3 от массы человеческого организма. Рассказ будет выглядеть более полным, если в нем удастся раскрыть важность использования воды как универсального растворителя в природе, быту, промышленности, сельском хозяйстве.
Основные источники природной воды — лед, дождь, снег, вода рек и озер. Из 10в18cт т. воды на Земле лишь 3% приходится на пресную воду, из которых 80% недоступно для использования.
По теоретическим расчетам максимальное количество пресной воды, до- Способность реагировать и с основными, и с кислотными оксидами говорит об амфотерных свойствах воды (об этом учащийся говорит по желанию). ступной для использования, составляет 40 000 км3 в год. Отсюда следует важность экономного и разумного использования запасов пресной воды, необходимость очистки загрязненных природных и сточных вод.
К основным загрязнителям воды относятся: промышленные и бытовые стоки, твердые отходы, отходы сельского хозяйства (удобрения), естественные примеси, радиоактивные и тепловые загрязнители. Очистка воды производится в промышленных масштабах на очистных сооружениях. В общем случае очистка воды включает три стадии: 1) первичная очистка проводится с целью удаления механических примесей; 2) вторичная очистка, при которой происходит разложение содержащихся органических веществ под действием микроорганизмов или хлора; 3) третичная очистка включает биологическую, химическую и физическую обработку вод. Эта стадия позволяет довести сточные и природные воды до такого уровня чистоты, что она отвечает стандартам на питьевую воду. Особое внимание в последнее время уделяется чистоте питьевой воды.
Источник: studfile.net
Периодическая таблица Менделеева — как правильно пользоваться и читать

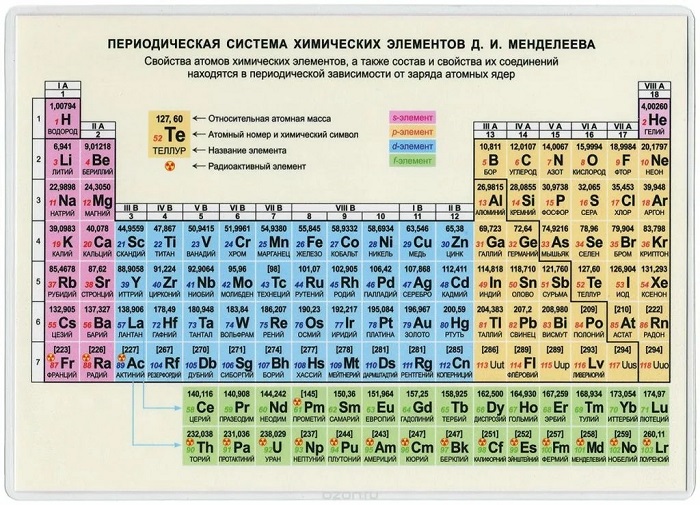
Крупная, многогранная и неоднозначная группировка химических элементов порождает немало вопросов на тему того, как пользоваться таблицей Менделеева. Между тем, это самый полный и завершенный вариант сортировки атомов всех веществ этой планеты.
Область применения данной классификации – не только химия или иные точные и естественные науки. Полезна она будет и простому обывателю для тренировки памяти или приспособлению к большим и сложным формулировкам и документам. С должным усердием и прилежанием в изучении таблицы, она станет легко понимаемым справочным материалом.
Периодическая таблица Менделеева
До Дмитрия Ивановича собрать элементы в один список пытались многие умы Европы. С начала XIX века они предприняли множество попыток сопоставления веществ.

В 1869 г. свой первый план представляет и Менделеев, через 2 года – завершает доработку и издает последний вариант таблицы. Основная идея группировки – периодичность. Расположив элементы в порядке увеличения атомной массы, он заметил, что время от времени их свойства повторяются. Ко 2-й половине XIX века миру было известно намного меньше веществ, чем сегодня, так что химик оставил пустые места в своей таблице, предполагая открытие новых элементов, и даже сумел заранее определить свойства открытых впоследствии галлия Ga 31 и германия Ge 32. С каждым последующим номером элемента возрастает его атомная масса, заряд ядра, уровень электронов (количество элементов и их связей), показатели активности повторяются в зависимости от периода.
Формулировка периодического закона химических элементов
Русский ученый составлял наброски таблицы около 20 лет, пытаясь подобрать верную закономерность в их размещении. Отметив концепцию цикличности, он превратил её в периодический закон, изложив свое понимание правила: «Свойства элементов, как и формируемых ими простых и сложных веществ, предполагают периодическую зависимость от их атомного веса».

Развитие науки в течение 20-го столетия несколько видоизменило закон: на смену термину «атомный вес» пришел «заряд ядра атома», вместо «простых и сложных веществ» — «веществ и соединений», к элементам добавилось определение «химическим».
Как читать таблицу Дмитрия Ивановича Менделеева
Ячейки химической базы данных разбиты в группы последовательностей по горизонтали и вертикали. Элементы имеют краткое обозначение из 1-3 букв (для формул и вычислений).
Группы
Представлены в виде столбцов таблицы. В системе старого образца их 8.
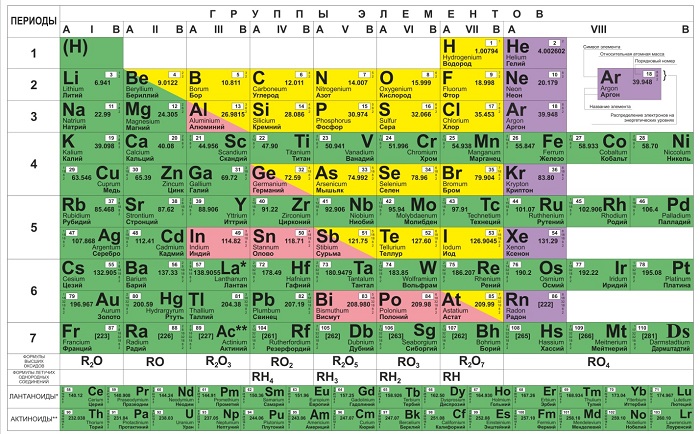
В настоящий же момент выделено 18.
Распределяют элементы в группы по однотипности: по строению атома они подобны друг другу. Также у представителей одного столбца схожая формула высшего оксида. Традиционные типы столбцов делятся на подкатегории: А (с яркими признаками группы) и В (переходные металлы). Принадлежность зависит от положения символа (слева для A или справа для B):
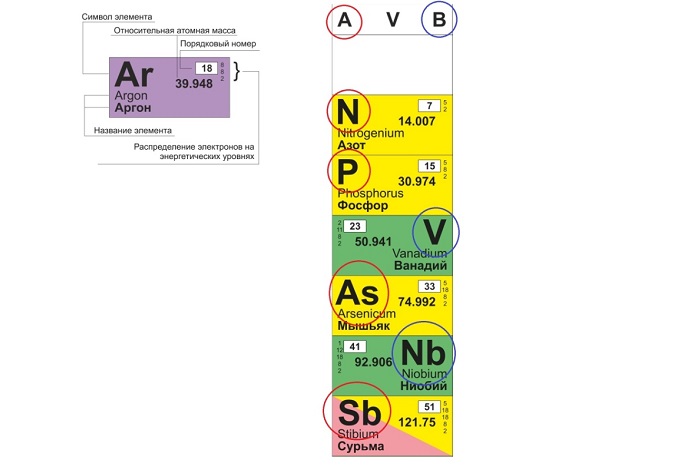
Периоды
- 1-й период содержит лишь гелий He 2 и водород H 1 ;
- 2 и 3 содержат по 8 компонентов;
- 4-й и 5-й содержат 18 единиц каждый;
- 6-й период вмещает 32 элемента;
- 7-й хранит 31 единицу и продолжает дополняться.
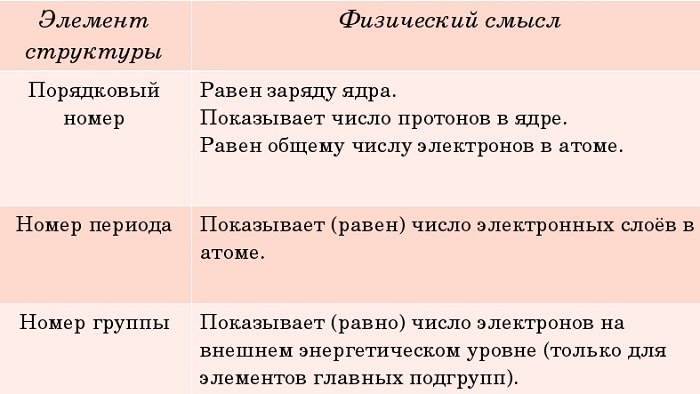
Физический смысл порядкового номера
Порядковый номер химического элемента также показывает, сколько в составе ядра атома протонов и сколько электронов вращается вокруг него.
Свойства таблицы Менделеева
Химические элементы оцениваются по множеству параметров. Один из основных – окислительно-восстановительные свойства.
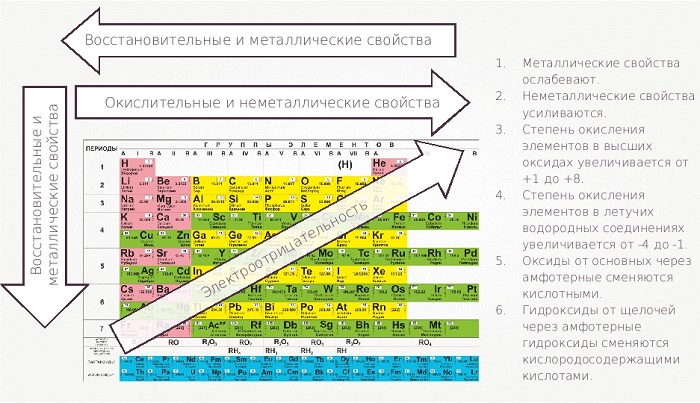
С убыванием в периоде и возрастанием в группе (стремление к левому нижнему углу) проявляются металлические характеристики, обратное направление в правый верхний угол увеличивает окислительные неметаллические качества.
Элементы таблицы Менделеева
Объекты в периодической системе делятся между двумя «полюсами полярности» — металлами и неметаллами. Первая категория также делится на подсистемы: легкие, переходные, щелочные и иные типы.

Также есть класс «металлоподобных» полупроводников с неопределенным статусом. Отдельно располагаются благородные газы, не подверженные реакциям.
Часть элементов с номером более 100 открыта сравнительно недавно, их принадлежность к каким-либо группам только предположительна.
Щелочные и щелочноземельные элементы
Представители 1 (IA) и 2 (IIA) групп таблицы Менделеева — металлы со слабой устойчивостью и высокой степенью растворимости:
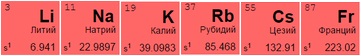
Щелочные металлы имеют серебристый отблеск, хорошо разламываются и режутся. Из всех размещенных в таблице металлов активнее других вступают в реакцию с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой создают гидроксиды – щелочи:
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком. В их список входят:

Большая часть из них способна создавать щелочь, но не так легко расстается с двумя незанятыми электронами. Другие металлы они замещают, но перед щелочными бессильны и вытесняются ими из молекул.
Лантаноиды и актиноиды
Прежде получили название редкоземельных металлов из-за малого количества месторождений и трудностей в выводе чистого металла из соединений. Им соответствует 3 (III B) группа, хотя это иногда оспаривается.

В рамках семейства лантаноиды («скрытые») имеют схожую форму атома и внешние признаки, но различаются свойствами. Поодиночке почти не встречаются.
Актиноиды, помимо общих черт, радиоактивны. В природе, кроме, урана U 92, почти не встречаются, создаются искусственно.

Для удобства обе группы элементов выведены в 2 строки под общей таблицей.
Галогены и благородные газы
17 (VII A) группа состоит из галогенов:

В противоположность щелочам, эти неметаллы – самые сильные окислители, активно принимающие 8-й электрон к имеющимся семи для заполнения внешней оболочки.
Самый реактивный – фтор F 9 (способен разрушать молекулы воды):
С ростом периода свойства элементов слабеют.
Все галогены токсичны, опасны для жизни, поражают дыхательные пути.
В последней, VIII A или 18 группе, находятся инертные газы:

Их внешний уровень электронов равен 8 (полностью заполнен), отчего они не способны вступать в реакцию с другими атомами. Крайне редко создают непрочные молекулы, распадающиеся при нагревании.
Переходные металлы
Представлены всеми подгруппами в традиционной системе или занимают с 3 по 12 столбцы в современных таблицах. Большинство обладает металлическим блеском, по цвету и состоянию различаются (большинство – твердые, но есть исключения, например, жидкая ртуть).
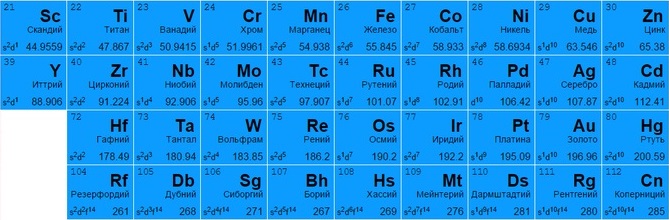
Могут отдавать разное количество электронов с нескольких оболочек для создания вещества (например, титан Ti 22 и железо Fe 26 способны отдавать от 2 до 4, медь Cu 29 – от 1 до 2, цинк Zn 30 – только 2, золото Au 79 и серебро Ag 47 практически не вступают в реакцию).
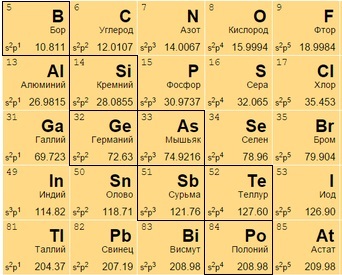
Металлоиды
Располагаются на стыке посреди легких металлов и неметаллов, в диагонали с 13 по 17 группах. В своем большинстве – полупроводники (хуже металлов проводят электрический ток).
Часть из них – металлы внешне, неметаллы по активности, часть – наоборот. Бор B 5, к примеру, является неметаллом с полупроводниковыми качествами.
Постпереходные металлы
Они же «легкие». От переходных аналогов отличаются меньшей твердостью и весом. Имеют иные температуры плавления и кипения. Для соединений отдают электроны только с внешней оболочки. Превосходят полуметаллы по восстановительности.
Легкий металл выглядит как вещество с матовым оттенком вместо блеска.
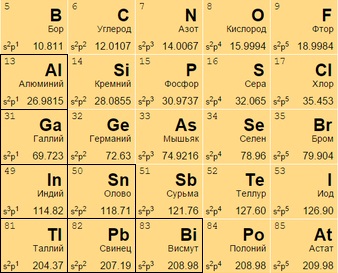
Размещаются после переходных металлов под полупроводниками (в 13-17 столбцах или IIIA – VIIA). Алюминий Al 13 носит неопределенный статус (иногда причисляется к металлоидам).
Неметаллы
Располагаются в правом верхнем углу между полуметаллами и инертными газами (начала 13-17 групп). Имеют больше электронов на внешней оболочке, стремятся присоединить к себе еще больше (в противоположность металлам), чтобы набрать полный уровень электронов.
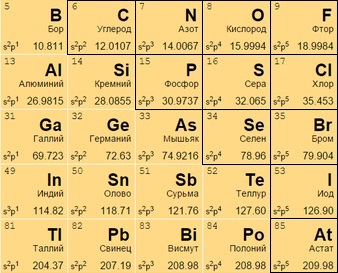
Могут находиться:
- в виде газа (кислород O 8, азот N 7);
- жидкости (бром Br 35);
- в твердом (углерод C 6, кремний Si 14) состоянии.
Интересное положение занимает водород H 1. Его причисляют то к 1, то к 17 группе: он, будучи неметаллом, может проявлять и окислительные, и восстановительные свойства.
Заключение
При детальном рассмотрении таблица Менделеева уже не кажется столь огромной. Главные моменты в пользовании – отследить группу и период элемента, после чего будет несложно определить его свойства и показатели.
Различные картинки в 8 или 18 столбцов не будут поводом для замешательства: семейства и категории выделяются разными цветами (полуметаллы – двухцветные). Ученики найдут решение задач, а любители головоломок получат новый способ тренировки мышления. Ячейка с нужными обозначениями найдется без особых препятствий.
Источник: nauka.club
Таблица Менделеева. Периодическая система химических элементов Д.И.Менделеева
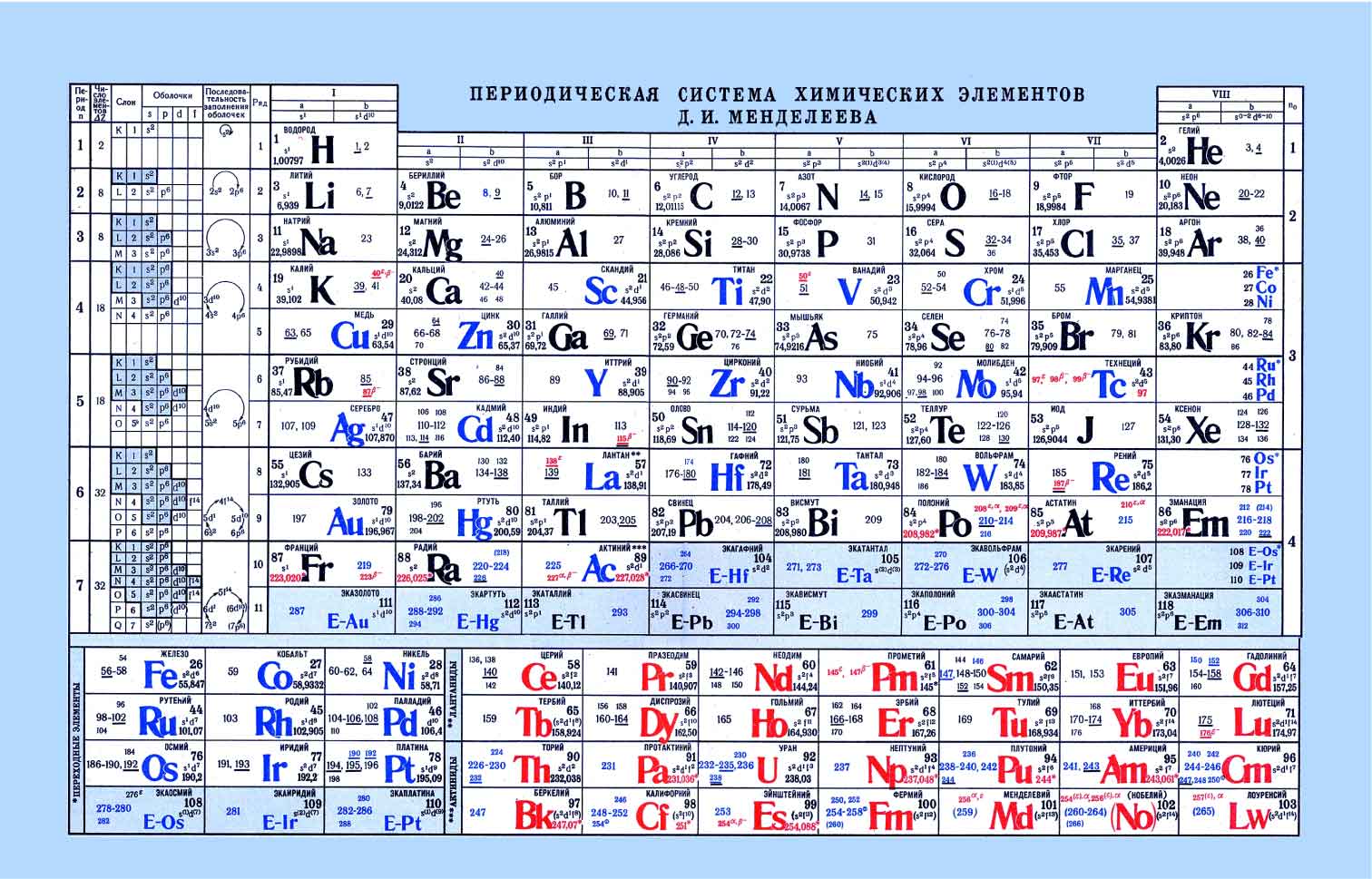
В разделе таблицы, помимо таблицы Менделеева Вы можете найти таблицу синусов, таблицу косинусов, также в университетском курсе Вам пригодятся таблица производных, таблица интегралов и тригонометрические формулы. Надеемся наш труд пропал не зря и теоретический материал с нашего сайта Вам помог.

проверенных автора готовы помочь в написании работы любой сложности