Вы когда-нибудь задумывались о том, что представляют собой загадочные аморфные вещества? По строению они отличаются и от твердых, и от жидких. Дело в том, что такие тела находятся в особом конденсированном состоянии, имеющем только ближний порядок.
Примеры аморфных веществ — смола, стекло, янтарь, каучук, полиэтилен, поливинилхлорид (наши любимые пластиковые окна), различные полимеры и другие. Это твердые тела, у которых нет кристаллической решетки. Еще к ним можно отнести сургуч, различные клеи, эбонит и пластмассы.
Необыкновенные свойства аморфных веществ
Во время расщепления в аморфных телах не образуются грани. Частицы совершенно беспорядочны и находятся на близком расстоянии друг к другу. Они могут быть как сильно густыми, так и вязкими. Как на них влияют внешние воздействия? Под влиянием различных температур тела становятся текучими, словно жидкости, и одновременно довольно упругими.
В случае, когда внешнее воздействие длится недолго, вещества аморфного строения могут при мощном ударе расколоться на кусочки. Длительное влияние извне приводит к тому, что они просто-напросто текут.
Строение и свойства кристаллических и аморфных тел | Физика 10 класс #37 | Инфоурок

Попробуйте провести дома небольшой эксперимент с применением смолы. Положите ее на твердую поверхность, и вы заметите, что она начинает плавно растекаться. Правильно, ведь это аморфное вещество! Скорость зависит от показателей температуры. Если она будет сильно высокой, то растекаться смола начнет заметно быстрее.
Что еще характерно для таких тел? Они могут принимать любую форму. Если аморфные вещества в виде маленьких частиц поместить в сосуд, например, в кувшин, то они также примут форму сосуда. Еще они являются изотропными, то есть проявляют одинаковые физические свойства по всем направлениям.
Плавление и переход в другие состояния. Металл и стекло
Аморфное состояние вещества не подразумевает поддержания какой-либо определенной температуры. При низких показателях тела застывают, при высоких — плавятся. Кстати, от этого зависит и степень вязкости таких веществ. Низкая температура способствует пониженной вязкости, высокая, наоборот, ее повышает.

Для веществ аморфного типа можно выделить еще одну особенность — переход в кристаллическое состояние, причем самопроизвольный. Почему так происходит? Внутренней энергии в кристаллическом теле намного меньше, чем в аморфном. Мы это можем заметить на примере стеклянной продукции — со временем стекла становятся мутными.
Металлическое стекло — что же это такое? Металл можно избавить от кристаллической решетки в ходе плавления, то есть сделать вещество аморфного строения стеклообразным. Во время застывания при искусственном охлаждении кристаллическая решетка снова образуется. Аморфный металл имеет просто поразительную стойкость к коррозии.
Физика 10 Кристаллические и аморфные тела
Например, сделанный из него кузов автомобиля не нуждался бы в различных покрытиях, так как не подвергался бы самопроизвольному разрушению. Аморфным веществом является такое тело, атомная структура которого обладает невиданной прочностью, а значит, аморфный металл мог бы применяться в совершенно любой промышленной отрасли.
Кристаллическое строение веществ
Чтобы хорошо разбираться в характеристиках металлов и уметь с ними работать, нужно обладать знаниями о кристаллическом строении тех или иных веществ. Производство продукции из металлов и область металлургии не смогли бы получить такое развитие, если бы у людей не было определенных знаний об изменениях в структуре сплавов, технологических приемах и эксплуатационных характеристиках.

Четыре состояния вещества
Общеизвестно, что существует четыре агрегатных состояния: твердое, жидкое, газообразное, плазменное. Твердые аморфные вещества могут быть и кристаллическими. При таком строении может наблюдаться пространственная периодичность в расположении частиц. Эти частицы в кристаллах могут выполнять периодическое движение.
Во всех телах, которые мы наблюдаем в газообразном или жидком состоянии, можно заметить движение частиц в виде хаотичного беспорядка. Аморфные твердые вещества (например, металлы в конденсированном состоянии: эбонит, стеклянная продукция, смолы) можно называть жидкостями замороженного типа, потому что у них при изменении формы можно заметить такую характерную черту, как вязкость.
Отличие аморфных тел от газов и жидкостей
Проявления пластичности, упругости, упрочнения при деформации свойственны многим телам. Кристаллические и аморфные вещества в большей степени обладают этими характеристиками, в то время как жидкости и газы не имеют таких свойств. Но зато можно заметить, что они способствуют упругому изменению объема.
Кристаллические и аморфные вещества. Механические и физические свойства
Что собой представляют кристаллические и аморфные вещества? Как уже упоминалось выше, аморфными можно назвать те тела, которые обладают огромным коэффициентом вязкости, и при обыкновенной температуре их текучесть невозможна. А вот высокая температура, наоборот, позволяет, им быть текучими, как жидкость.

Совершенно другими представляются вещества кристаллического типа. Эти твердые тела могут иметь свою температуру плавления, зависящую от внешнего давления. Получение кристаллов возможно, если охладить жидкость. Если не принимать определенных мер, то можно заметить, что в жидком состоянии начинают возникать различные центры кристаллизации.
В области, окружающей эти центры, происходит образование твердого вещества. Очень маленькие кристаллики начинают соединяться друг с другом в беспорядочном порядке, и получается так называемый поликристалл. Такое тело является изотропным.
Характеристики веществ
Что определяет физические и механические характеристики тел? Важное значение имеют атомные связи, а также тип кристаллической структуры. Кристаллам ионного типа характерны ионные связи, что означает плавный переход от одних атомов к другим. При этом происходит образование положительно и отрицательно заряженных частиц.
Ионную связь мы можем наблюдать на простом примере — такие характеристики свойственны разнообразным оксидам и солям. Еще одна особенность ионных кристаллов — низкая проводимость тепла, но ее показатели могут заметно возрастать при нагревании. В узлах кристаллической решетки можно заметить различные молекулы, которые отличаются крепкой атомной связью.
Множество минералов, которые мы встречаем повсеместно в природе, имеют строение кристаллическое. И аморфное состояние вещества — это тоже природа в чистом виде. Только в этом случае тело представляет собой нечто бесформенное, а вот кристаллы могут принимать формы красивейших многогранников с наличием плоских граней, а также образовывать новые удивительной красоты и чистоты твердые тела.
Что представляют собой кристаллы? Аморфно-кристаллическая структура
Форма таких тел постоянна для определенного соединения. Например, берилл всегда выглядит как шестигранная призма. Проведите небольшой эксперимент. Возьмите небольшой кристаллик поваренной соли кубической формы (шар) и положите его в специальный раствор как можно более насыщенный той же поваренной соли. Со временем вы заметите, что этот тело осталось неизменным — оно снова приобрело форму куба или шара, которая присуща именно кристаллам поваренной соли.

Как известно, такие промышленные материалы, как фарфор, керамическая плитка, каменное литье и ситаллы, — это аморфно-кристаллические вещества, потому что содержат стекловидные фазы и одновременно кристаллы в своем составе. При этом стоит отметить, что свойства материалов не зависят от содержания в нем стеклофаз.
Аморфные металлы
Применение аморфных веществ наиболее активно осуществляется в области медицины. Например, быстро охлажденный металл активно используется в хирургии. Благодаря связанным с ним разработкам многие люди получили возможность самостоятельно передвигаться после тяжелых травм. Все дело в том, что вещество аморфной структуры является отличным биоматериалом для имплантации в кости.
Полученные специальные винты, пластины, штыри, булавки внедряют при тяжелых переломах. Раньше в хирургии для таких целей применялись сталь и титан. Лишь позже было замечено, что аморфные вещества очень медленно распадаются в организме, а это удивительное свойство дает возможность восстановиться костным тканям. Впоследствии вещество заменяется костью.
Применение веществ аморфного типа в метрологии и точной механике
Точная механика основана именно на точности, а потому так и называется. Особенно важную роль в данной отрасли, равно как и в метрологии, играют сверхточные показатели приборов измерения, этого позволяет добиться использование в устройствах аморфных тел. Благодаря точным измерениям проводятся лабораторные и научные исследования в институтах в области механики и физики, происходит получение новых препаратов, совершенствование научных знаний.
Полимеры
Еще один пример применения аморфного вещества — это полимеры. Они могут медленно переходить из твердого состояния в жидкость, в то время как кристаллические полимеры характеризуются температурой плавления, а не температурой размягчения. Каково физическое состояние аморфных полимеров? Если предоставить этим веществам низкую температуру, можно заметить, что они будут находиться в стеклообразном состоянии и проявлять свойства твердых тел. Постепенное нагревание способствует тому, что полимеры начинают переходить в состояние повышенной эластичности.
Аморфные вещества, примеры которых мы сейчас приводили, интенсивно используются в промышленности. Сверхэластичное состояние позволяет полимерам как угодно деформироваться, а достигается такое состояние благодаря повышенной гибкости звеньев и молекул. Дальнейшее повышение показателей температуры приводит к тому, что полимер приобретает еще более эластичные свойства. Он начинает переходить в особое текучее и вязкое состояние.
Если оставить ситуацию без контроля и не воспрепятствовать дальнейшему повышению температуры, полимер подвергнется деструкции, то есть разрушению. Вязкое состояние показывает, что все звенья макромолекулы очень подвижны. Когда течет молекула полимера, звенья не только выпрямляются, но и еще и сильно сближаются друг с другом.
Межмолекулярное воздействие превращает полимер в жесткое вещество (резину). Такой процесс называют механическим стеклованием. Полученное вещество используют для производства пленок и волокон.
На основе полимеров можно получить полиамиды, полиакрилонитрилы. Чтобы изготовить полимерную пленку, нужно продавить полимеры через фильеры, которые имеют щелевидное отверстие, и нанести на ленту. Таким образом изготавливаются упаковочные материалы и основы для магнитных лент. К полимерам относятся также различные лаки (образующие пенку в органическом растворителе), клеи и другие скрепляющие материалы, композиты (полимерная основа с наполнителем), пластмассы.

Области применения полимеров
Такого вида аморфные вещества прочно внедрились в нашу жизнь. Применяются они повсюду. К ним относят:
1. Различные основы для изготовления лаков, клея, пластмассовых изделий (фенолформальдегидные смолы).
3. Электроизоляционный материал — поливинилхлорид, или всем известные пластиковые окна из ПВХ. Он устойчив к пожарам, так как считается трудногорючим, обладает повышенной механической прочностью и электроизоляционными свойствами.
4. Полиамид — вещество, обладающее очень высокой прочностью, стойкостью к износу. Ему свойственны высокие диэлектрические характеристики.
5. Плексиглас, или полиметилметакрилат. Его мы можем применять в сфере электротехники или использовать как материал для конструкций.
6. Фторопласт, или политетрафторэтилен, — известный диэлектрик, который не проявляет свойств растворения в растворителях органического происхождения. Обширный диапазон температур и хорошие диэлектрические свойства позволяют применять его как гидрофобный или антифрикционный материал.
7. Полистирол. Этот материал не подвержен воздействию кислот. Он, так же как фторопласт и полиамид, может считаться диэлектриком. Очень прочен в отношении механического воздействия. Полистирол используют повсеместно.
Например, он хорошо зарекомендовал себя как конструкционный и электроизоляционный материал. Применяется в электро- и радиотехнике.
8. Наверное, самый известный для нас полимер — это полиэтилен. Материал проявляет устойчивость при воздействии агрессивной среды, он абсолютно не пропускает влагу. Если упаковка выполнена из полиэтилена, можно не бояться, что содержимое испортится под воздействием сильного дождя. Полиэтилен — это тоже диэлектрик. Его применение обширно.
Из него изготавливают трубные конструкции, различные электротехнические изделия, изоляционную пленку, оболочки для кабелей телефонных и силовых линий, детали для радио и другой аппаратуры.
9. Полихлорвинил — это высокополимерное вещество. Он является синтетическим и термопластичным. Обладает структурой молекул, которые несимметричны. Почти не пропускает воду и изготавливается путем прессования с помощью штамповки и путем формования. Полихлорвинил применяют чаще всего в электрической промышленности.
На его основе создают различные теплоизоляционные шланги и шланги для химической защиты, аккумуляторные банки, изоляционные втулки и прокладки, провода и кабели. Полихлорвинил также является отличной заменой вредному свинцу. Его нельзя применять в качестве высокочастотных цепей в виде диэлектрика. А все из-за того, что в этом случае показатели диэлектрических потерь будут высокими. Обладает высокой проводимостью.
Источник: fb.ru
Аморфное и кристаллическое состояния вещества

Строение твердого вещества определяется не только взаимным расположением атомов внутри химических частиц, но и размещением самих частиц в пространстве относительно друг друга и расстояниями между ними. В зависимости от расположения частиц в пространстве различают ближний и дальний порядок.
Ближний порядок заключается в том, что частицы вещества закономерно размещаются в пространстве на определенных расстояниях и направлениях друг от друга. Если такая упорядоченность сохраняется или периодически повторяется во всем объеме твердого вещества, то формируется дальний порядок. Иначе говоря, дальний и ближний порядки — это наличие корреляции микроструктуры вещества либо в пределах всего макроскопического образца (дальний), либо в области с ограниченным радиусом (ближний). В зависимости от совокупного (или подавляющего) действия ближнего или дальнего порядка размещения частиц твердое тело может иметь кристаллическое или аморфное состояние.
Наиболее упорядоченным является размещение частиц в кристаллах (от греческого « кристалос » — лед), в которых атомы, молекулы или ионы расположены только в определенных точках пространства, названных узлами кристаллической решетки.
Кристаллическое состояние — это упорядоченная периодическая структура, которая характеризуется наличием как ближнего, так и дальнего порядка размещения частиц твердого вещества.
Характерным признаком кристаллических веществ по сравнению с аморфными является анизотропия.
Анизотропия — это разница физико-химических свойств кристаллического вещества (электро- и теплопроводности, прочности, оптических характеристик и т.д.) в зависимости от выбранного направления в кристалле .
Анизотропия обусловлена внутренним строением кристаллов. В разных направлениях расстояние между частицами в кристалле разная, поэтому и количественная характеристика того или иного свойства для этих направлений будет разной.
Особенно ярко анизотропия проявляется в монокристаллах. На этом свойстве основано производство лазеров, обработка монокристаллов полупроводников, изготовление кварцевых резонаторов и ультразвуковых генераторов. Типичным примером анизотропного кристаллического вещества является графит, структура которого представляет собой параллельные слои с различными энергиями связи в середине слоев и между отдельными слоями. Благодаря этому теплопроводность вдоль слоев в пять раз выше, чем в перпендикулярном направлении, а электропроводность в направлении отдельного слоя близка к металлической и сотни раз больше электропроводности в перпендикулярном направлении.
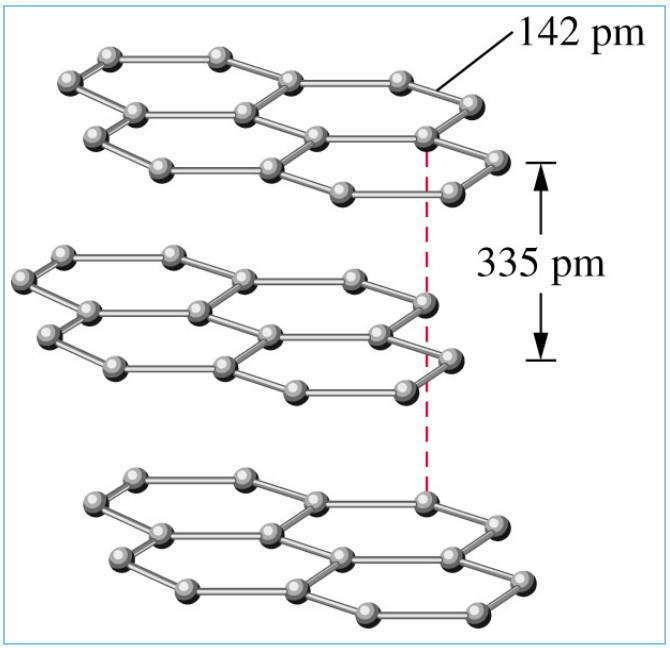
Иногда одно и то же вещество может образовывать кристаллы различной формы. Это явление называют полиморфизмом, а различные кристаллические формы одного вещества — полиморфными модификациями, например, алотропы алмаз и графит; a-, b-, g- и d-железо; a- и b-кварц (обратите внимание на различие понятий «аллотропия», которое относится исключительно к простым веществам в любом агрегатном состоянии, и «полиморфизм», которое характеризует строение только кристаллических соединений).
В то же время различные по составу вещества могут образовывать кристаллы одинаковой формы — это явление называют изоморфизмом. Так, изоморфными веществами, имеющими одинаковые кристаллические решетки, являются металлы Al и Cr и их оксиды; Ag и Au; BaCl2 и SrCl2 ; KMnO4 и BaSO4.
Подавляющее большинство твердых веществ при обычных условиях существует в кристаллическом состоянии.
Твердые вещества, не имеющие периодической структуры, относятся к аморфным (от греческого « аморфос» — бесформенный). Однако некоторая упорядоченность структуры в них присутствует. Она проявляется в закономерном размещении вокруг каждой частицы ее ближних «соседей», то есть аморфные вещества имеют только ближний порядок и этим напоминают жидкости, поэтому их с некоторым приближением можно рассматривать как переохлажденные жидкости с очень высокой вязкостью. Разница между жидким и твердым аморфным состоянием определяется характером теплового движения частиц: в аморфном состоянии они способны лишь к колебательным и вращательным движения, но не могут перемещаться в толще вещества.
Аморфное состояние — это твердое состояние вещества, характеризующееся наличием ближнего порядка в размещении частиц, а также изотропностью — одинаковыми свойствами в любом направлении.
Аморфное состояние веществ менее стабильно по сравнению с кристаллическим, так аморфные вещества могут переходить в кристаллическое состояние под действием механических нагрузок или при изменении температуры. Однако некоторые вещества могут находиться в аморфном состоянии в течение достаточно большого периода. Например, вулканическое стекло (возраст которого доходит до нескольких миллионов лет), обычное стекло, смолы, воск, большинство гидроксидов переходных металлов и тому подобное. При определенных условиях в аморфном состоянии могут находиться почти все вещества, кроме металлов и некоторых ионных соединений. С другой стороны, известны вещества, способные существовать только в аморфном состоянии (органические полимеры с неравномерной последовательностью элементарных звеньев).
Физические и химические свойства вещества в аморфном состоянии могут существенно отличаться от ее свойств в кристаллическом состоянии. Реакционная способность веществ в аморфном состоянии значительно выше, чем в кристаллическом. Например, аморфный GeO2 значительно активнее в химическом отношении, чем кристаллический.
Переход твердых веществ в жидкое состояние в зависимости от строения имеет свои особенности. Для кристаллического вещества плавления происходит при определенной температуре, которая является фиксированной для данного вещества, и сопровождается скачкообразным изменением ее свойств (плотность, вязкость и т.д.). Аморфные вещества, напротив, переходят в жидкое состояние постепенно, в течение некоторого интервала температур (так называемый интервал размягчения ), во время которого происходит плавное, медленное изменение свойств.
Сравнительная характеристика аморфных и кристаллических веществ:
твердого вещества
характеристика
примеры
2. Изотропность физических свойств;
3. Отсутствие фиксированной температуры плавления;
4. Термодинамическая нестабильность (большой запас внутренней энергии)
2. Анизотропнисть физических свойств;
3. Фиксированная температура плавления;
4. Термодинамическая устойчивость (небольшой запас внутренней энергии)
5. Наличие элементов симметрии
Источник: www.polnaja-jenciklopedija.ru
Кристаллические и аморфные тела. Физика. 10 класс.
Сейчас мы впервые приступаем к рассмотрению твёрдых тел с точки зрения молекулярно кинетической теории. Конечно же, твёрдые тела разительным образом отличаются от газов, а тем более идеальных газов, по своей структуре и свойствам, однако мы всё равно можем, пользуясь уже имеющимися знаниями, описать их.
Во-первых, вспомним, какое определение твёрдым телам вводилось в младших классах:
Определение. Твёрдые тела – тела, которые со временем не меняют своей формы и объёма. Теперь же для расширения теории о твёрдых телах мы введём классификацию твёрдых тел. Твёрдые тела делятся на…
- Кристаллы (кристаллические тела)
- Аморфные тела
- Композиты (композитные тела) (рис. 1)


Рис. 1. Примеры кристаллических (соль) и аморфных (воск) твёрдых тел соответственно
Рассмотри кристаллические тела:
Определение.Кристаллы – твёрдые тела, у которых наблюдается упорядоченное расположение атомов или молекул (см. рис. 2).

Рис. 2. Пример кристаллической решётки (каменная соль)
Кристаллы, в свою очередь, также делятся на два класса:
1. Монокристаллы, то есть вся структура тела представлена единым кристаллом (алмаз, рубин, сапфир…)
2. Поликристаллы, то есть структура тела представляет собой объёдинение большого количества малых кристаллов (гранит, большинство металлов…)
Следует также знать, что кристаллическая структура не является свойством, характерным для одних химических элементов или соединений, а для других нехарактерным. Дело в том, что многие твёрдые тела обладают так называемым свойством полиморфизма.
Определение. Полиморфизм – свойство твёрдых тел существовать в состоянии с различной кристаллической решёткой. Например, уже приводимые на одном из прошлых уроков в качестве примера алмаз и графит оба состоят из углерода, однако с различным расположением его атомов.
Кристаллы могут быть распределены на две группы также и по следующим свойствам: изотропия и анизотропия.
Определение. Анизотропия – зависимость физических свойств кристалла от направления. То есть кристаллическая структура не симметрична, и существует несколько осей, вдоль которых у кристалла проявляются различные свойства (механические, электрические, оптические). Анизотропия свойственна монокристаллам.
Изотропия – независимость физических свойств кристалла от направления. Свойственна поликристаллам, потому как несимметрические монокристаллы ориентируются хаотически, сводя на нет несимметричность.
Ещё одним принципом, по которому можно классифицировать кристаллы, является природа связей, которые удерживают узлы кристаллической решётки вместе:
- Молекулярные связи характерны для кристаллов с очень низкой механической твёрдостью (кристаллы на основе водорода и гелия)
- Ковалентные связи характерны, напротив, для кристаллов с высокой прочностью (алмаз)
- Ионные связи (соли)
- Металлические связи (металлы)
Аморфные тела
Перейдём к рассмотрению аморфных тел:
Определение. Аморфные тела – тела, не имеющие строгой кристаллической решётки, бесформенные тела (смола, стекло, графит…). Аморфные тела ещё называют переохлаждёнными вязкими жидкостями в связи с тем, что у них нет строгой температуры плавления, потому как нет явного перехода от твёрдого состояния до жидкого: с увеличением температуры аморфные тела стают только более текучими, а свойство текучести сохраняется у них даже при низких температурах.
Перейдём к рассмотрению композитных тел:
Композитные тела
Определение. Композитные тела – искусственно созданные твёрдые тела, состоящие из жёсткой матрицы и нитевидного кристаллического наполнителя. Благодаря разнообразным комбинированиям этих двух составляющих, можно получать желаемую прочность, гибкость, упругость и т. д. материала.
Рассмотрим теперь такой физический процесс, как деформация, и опишем различные её разновидности.
Деформация
Определение. Деформация – изменение формы или объёма твёрдого тела. Различают пять видов деформаций:
- Растяжение – увеличение расстояния между молекулярными рядами
- Сжатие – уменьшение расстояния между молекулярными рядами
- Сдвиг – смещение молекулярных рядов друг относительно друга без изменения расстояния между ними
- Кручение – поворот молекулярных рядов друг относительно друга
- Изгиб – комбинация деформаций сжатия и растяжения
Закон Гука
Совершенно очевидно, что для того, чтобы произвести деформацию тела, необходимо приложить силу. Но, по третьему закону Ньютона, со стороны тела будет действовать сила противодействия, или, как её назвали, сила упругости. Существует закон, позволяющий определить величину этой силы в зависимости от величины деформации.
Этот закон носит имя Роберта Гука – английского учёного (рис. 3). Но прежде, чем вывести его, сформулируем некоторые параметры материала и деформации.

Определение. Абсолютная деформация (сдвига) — :

Здесь:  — конечная длина тела;
— конечная длина тела;  — начальная длина тела.
— начальная длина тела.


Относительная деформация – :



Механическое напряжение – :

Здесь:  — сила упругости, действующая внутри тела;
— сила упругости, действующая внутри тела;  — площадь сечения тела, перпендикулярного к направлению вектора силы.
— площадь сечения тела, перпендикулярного к направлению вектора силы.

Закон Роберта Гука в общем виде выглядит следующим образом:


Здесь: — модуль Юнга или модуль упругости, табличная величина, характеризующая упругие качества вещества.
Увидим теперь, как можно связать вышеприведённую формулировку закона Гука со знакомой нам ещё из курса динамики:


Очень важным является тот факт, что, во-первых, закон Гука, сформулированный на этом уроке, является более общим, нежели известный нам ранее, а во-вторых, закон Гука выполним только при небольших деформациях.

Рис. 3. Роберт Гук
Диаграмма растяжений
Для иллюстрации деформационных качеств твёрдого тела очень хорошо подходит диаграмма растяжений, то есть график зависимости механического напряжения от относительной деформации (см рис. 4).

Рис. 4. Диаграмма растяжений
Участок ОА называется участком упругости, то есть при растяжениях, попадающих в этот участок, после снятия напряжения с образца тело принимает свою первоначальную форму и объём. Значение механического напряжения в точке А называется механическим напряжением пропорциональности. Участок СD, напротив, называется областью текучести, и при деформации большей, чем значение в точке C, деформация становится эластичной, то есть тело не возвращается в начальное состояние после снятия напряжения. Именно по величине этой зоны определяется устойчивость образца к разрыву. Значение механического напряжения в точке E называется пределом прочности и соответствует той границе, при переходе которой образец разрушается.
В технике часто используется понятие «коэффициент безопасности».
Определение. Коэффициент безопасности – отношение механического напряжения пропорциональности к максимальному механическому напряжению, которое испытывает деталь, строение.
Жидкие кристаллы
Особенный интерес представляют собой тела, называющиеся жидкими кристаллами.
Определение. Жидкие кристаллы – тела, одновременно обладающие свойствами кристаллов (упорядоченное строение молекул и атомов) и жидкостей (текучесть). Важнейшее свойство жидких кристаллов – оптическая анизотропия, то есть неодинаковое прохождение света по разным направлениям.
Все жидкие кристаллы разделены на три типа (рис. 5):
- Нематики – кристаллы имеют нитевидную структуру
- Смектики – представляют собой некие мыльные растворы
- Холестерики – содержат в своём составе холестерин

Рис. 5. Схема ориентации молекул различных типов жидких кристаллов
К занятию прикреплен файл «Это интересно!». Вы можете скачать файл в любое удобное для вас время.
Источник: www.kursoteka.ru