
Классификация твёрдых веществ Кристаллические упорядоченное расположение частиц (атомов, молекул или ионов) в строго определённых точках пространства; наличие постоянной температуры плавления. Аморфные отсутствие строгого порядка в расположении частиц; отсутствие постоянной температуры плавления; текучесть.

Кристаллические вещества Железо Сахароза Графит Алмаз Поваренная соль

Аморфные вещества Янтарь Полиэтилен Жемчуг Стекло Канифоль Пчелиный воск
Физика 10 Кристаллические и аморфные тела

? Почему изделие из кремния при ударе раскалывается на кусочки, а изделие из свинца только расплющивается? Кристаллические вещества. Типы кристаллических решёток.
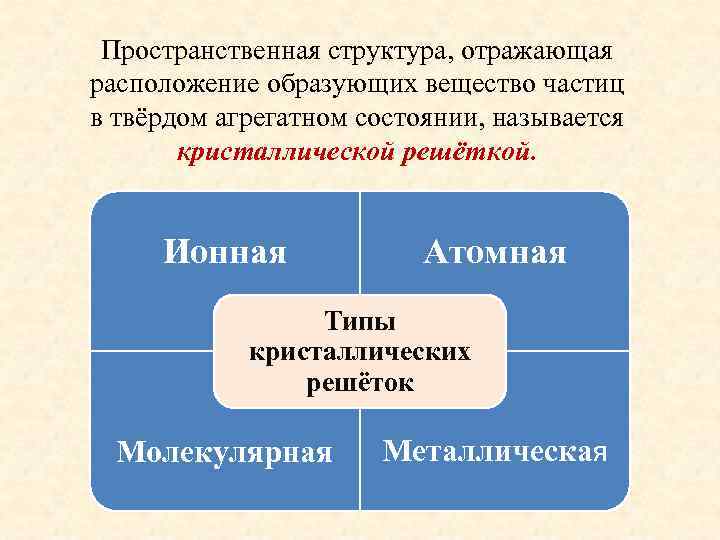
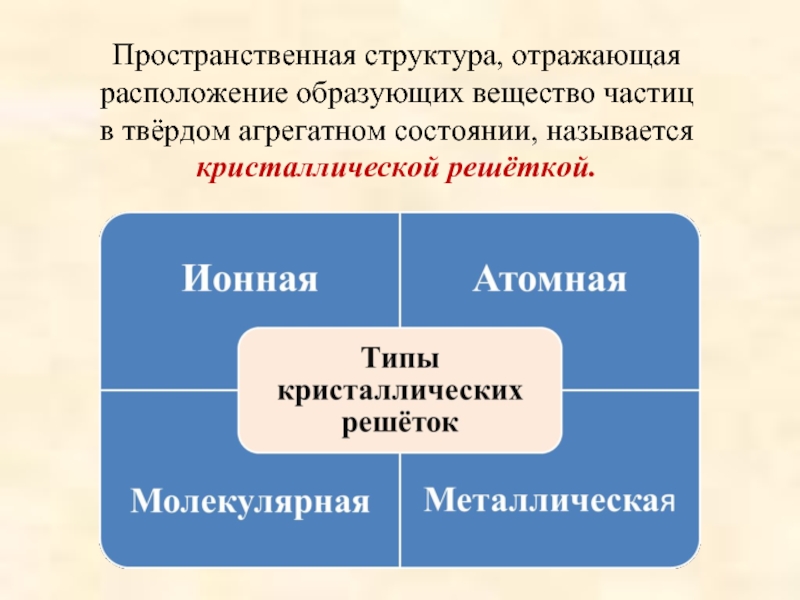
Пространственная структура, отражающая расположение образующих вещество частиц в твёрдом агрегатном состоянии, называется кристаллической решёткой. Ионная Атомная Типы кристаллических решёток Молекулярная Металлическая
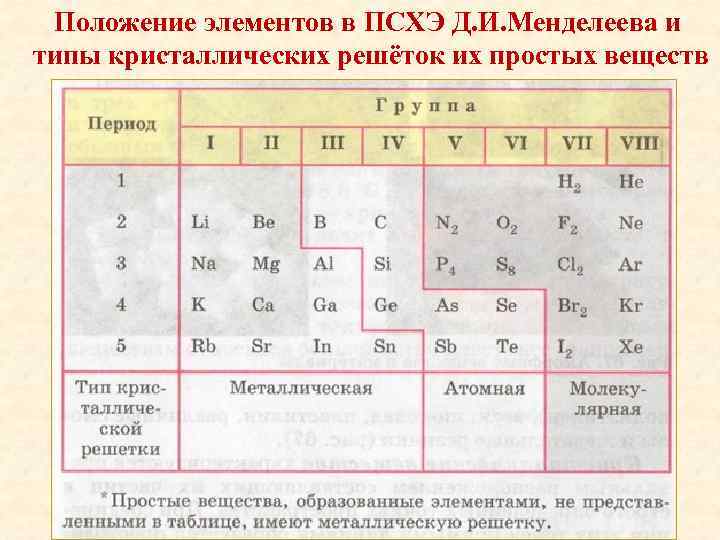
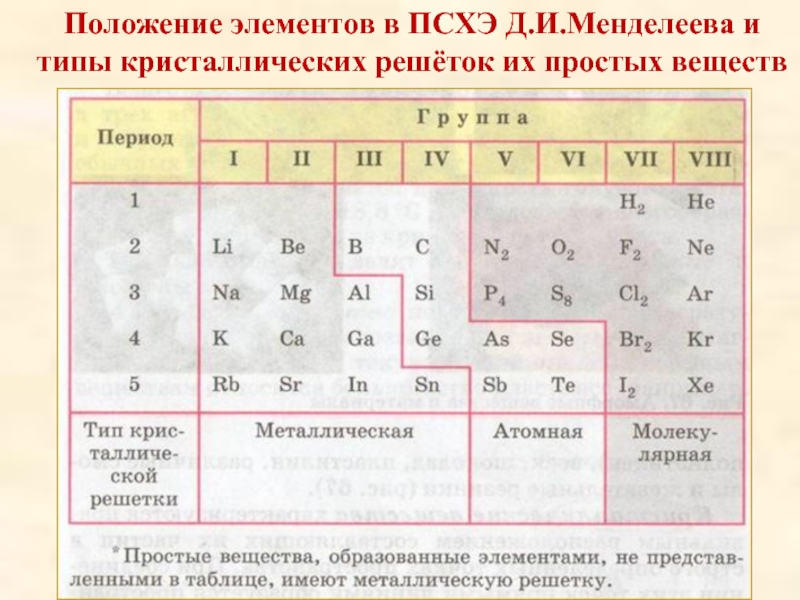
Положение элементов в ПСХЭ Д. И. Менделеева и типы кристаллических решёток их простых веществ
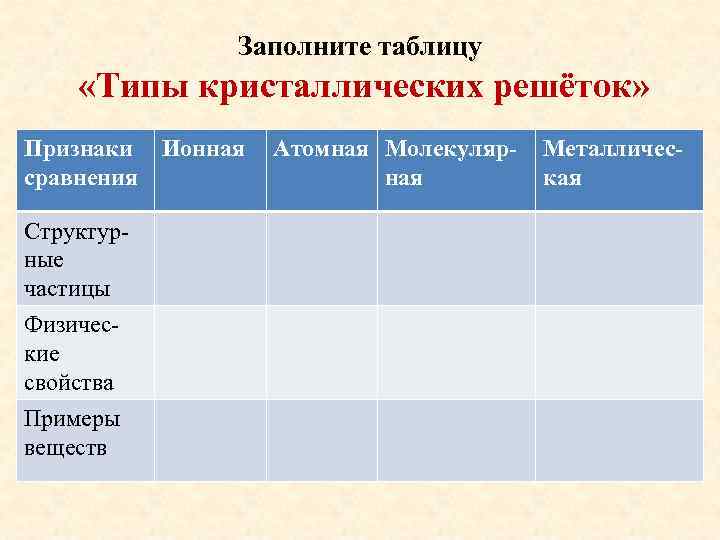
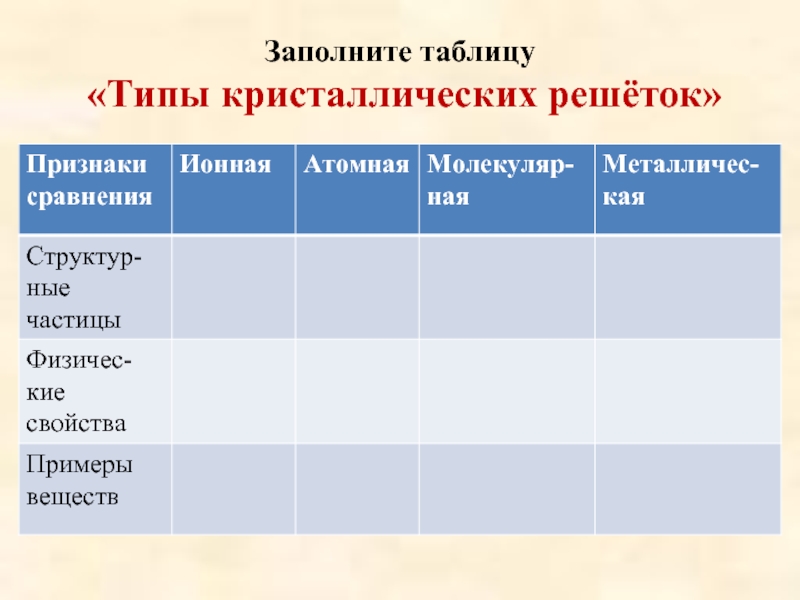
Заполните таблицу «Типы кристаллических решёток» Признаки Ионная сравнения Структурные частицы Физические свойства Примеры веществ Атомная Молекулярная Металлическая

Ионная кристаллическая решётка Поваренная соль • Структурные частицы — ионы • Физические свойства: Øвысокая твёрдость Øпрочность Øтугоплавкость Øнелетучесть Øрастворы и расплавы электропроводны Na. Cl Едкое кали KOH Негашёная известь Са. О
Химия 8 класс: Аморфные и кристаллические вещества

Атомная кристаллическая решётка • Структурные частицы — атомы Алмаз С • Физические свойства: Ø высокая твёрдость Ø тугоплавкость Ø прочность Ø нерастворимость в воде Ø диэлектрики (исключение графит, кремний) Графит С Кварц, кварцевый песок Si. O 2
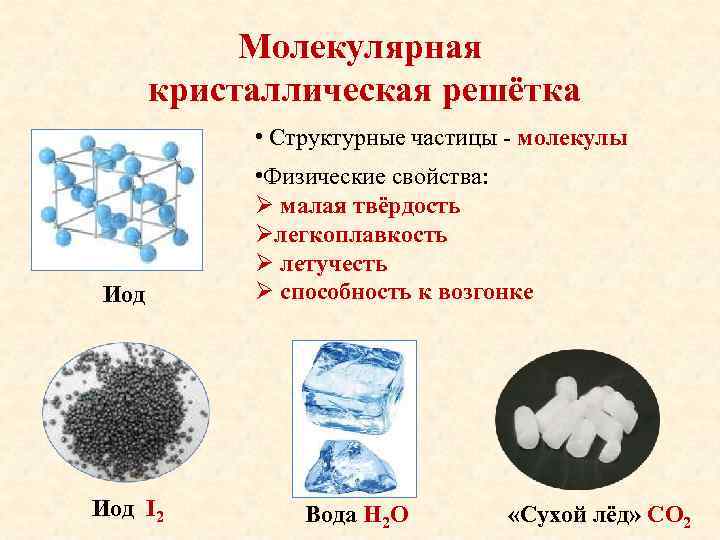
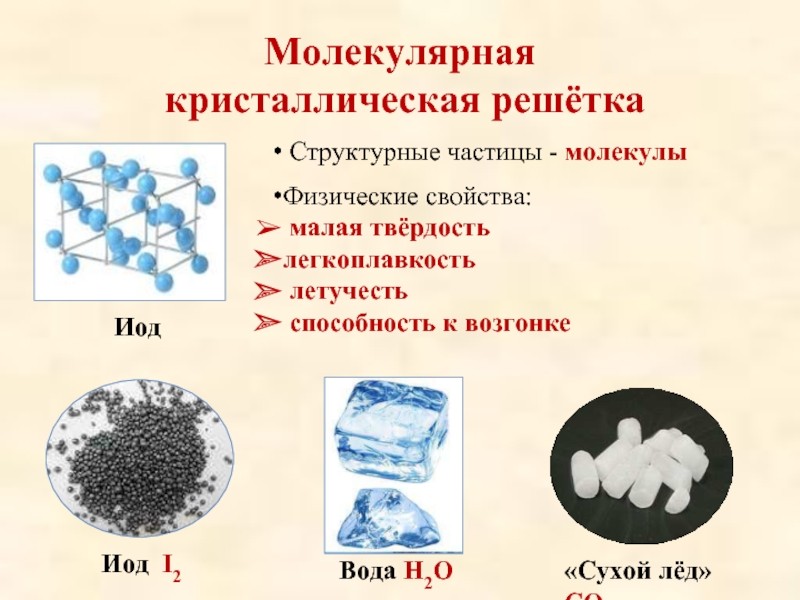
Молекулярная кристаллическая решётка • Структурные частицы — молекулы Иод I 2 • Физические свойства: Ø малая твёрдость Øлегкоплавкость Ø летучесть Ø способность к возгонке Вода Н 2 О «Сухой лёд» СО 2

Закон постоянства состава веществ • Жозеф Луи Пруст (1754 – 1826) – французский химик – аналитик. • Исследование состава различных веществ, выполненное им в 1799 -1803 годах, послужило основой открытия закона постоянства состава для веществ молекулярного строения. Каждое химически чистое вещество независимо от местонахождения и способа получения имеет постоянный состав и свойства.
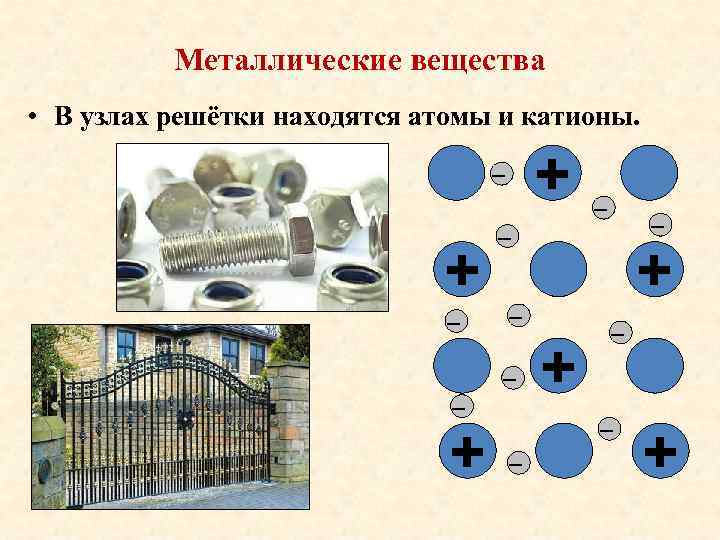
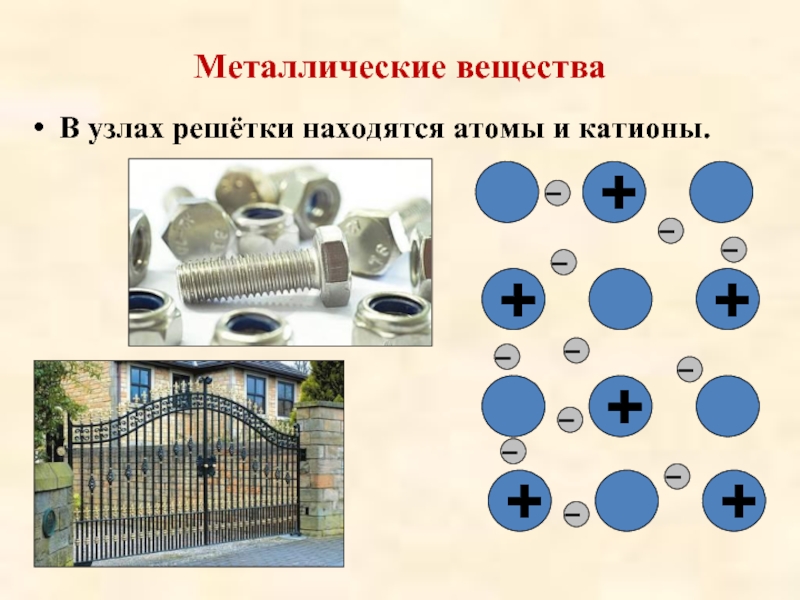
Металлические вещества • В узлах решётки находятся атомы и катионы. + _ _ _ + _ + _ _ _ +

Металлическая кристаллическая решётка • Структурные частицы – атомы и катионы Медь Cu • Физические свойства: Ø твёрдость, кроме ртути Hg Ø ковкость, пластичность, тягучесть Ø электропроводность Ø теплопроводность Ø металлический блеск Латунь Cu-Zn Бронза Cu- Sn

Определите кристаллические и аморфные вещества 1) Пищевая сода Na. HCO 3 3) Древесная смола 6) Медь Cu 2) Полиэтилен (-СН 2 -)n 4) Кремний Si 7) Сера S 5) «Сухой лёд» СО 2 8) Воск

Определите тип кристаллической решётки у веществ Пищевая сода Na. HCO 3 Нафталин С 10 Н 8 Кремний Si Медный купорос Сu. SO 4 • 5 H 2 O Медь Cu «Сухой лёд» СО 2

? Почему изделие из кремния при ударе раскалывается на кусочки, а изделие из свинца только расплющивается?

Определите элемент и тип кристаллической решётки веществ Удивить готов он нас Он и уголь, и алмаз, Он в карандашах сидит, Потому что он — графит. Грамотный народ поймет То, что это … углерод Большая императорская корона Российской империи Графит

Определите вещество и тип кристаллической решётки Вы, ребята, мне поверьте Этот газ вполне инертен. Он спокойный и ленивый, В трубках светится красиво. Для рекламы нужен он, Незаметный газ …
Определите вещество и тип кристаллической решётки Богатырём его не зря назвали, Он — друг железа и помощник стали. Титановые имплантанты

Определите вещество и тип кристаллической решётки Молоко не скисло, На стене повисло. Известковое молоко Са(ОН)2
Источник: present5.com
Презентация на тему Что объединяет вещества. Классификация твёрдых веществ
Классификация твёрдых веществ Кристаллические упорядоченное расположение частиц (атомов, молекул или ионов) в строго определённых точках пространства; наличие постоянной температуры плавления. Аморфные отсутствие строгого порядка в
- Главная
- Химия
- Что объединяет вещества. Классификация твёрдых веществ
Слайды и текст этой презентации
Слайд 1Что объединяет вещества?
Поваренная соль
Полиэтилен
Железо
Янтарь
Алмаз
Жемчуг

Слайд 2Классификация твёрдых веществ
Кристаллические
упорядоченное расположение частиц (атомов, молекул
или ионов) в строго определённых точках пространства;
наличие
постоянной температуры
плавления.
отсутствие строгого порядка в расположении частиц;
отсутствие постоянной температуры плавления;
текучесть.

Слайд 3Кристаллические вещества
Железо
Поваренная соль
Алмаз
Графит
Сахароза

Слайд 4Аморфные вещества
Янтарь
Жемчуг
Канифоль
Полиэтилен
Стекло
Пчелиный воск

Слайд 5
Кристаллические вещества.
Типы кристаллических решёток.
Почему изделие из
кремния при ударе
раскалывается на кусочки,
а
изделие из свинца
только расплющивается?

Слайд 6Пространственная структура, отражающая расположение образующих вещество частиц
в твёрдом агрегатном состоянии, называется кристаллической решёткой.
Слайд 7Положение элементов в ПСХЭ Д.И.Менделеева и
типы
кристаллических решёток их простых веществ
Слайд 8Заполните таблицу «Типы кристаллических решёток»
Слайд 9Ионная кристаллическая решётка
Структурные частицы — ионы
Физические свойства:
высокая твёрдость
прочность
тугоплавкость
нелетучесть
растворы и расплавы электропроводны
Негашёная известь СаО

Слайд 10Атомная кристаллическая решётка
Структурные частицы — атомы
Физические свойства:
высокая твёрдость
тугоплавкость
прочность
нерастворимость
в воде
диэлектрики (исключение графит, кремний)
Кварц, кварцевый песок SiO2

Слайд 11Молекулярная кристаллическая решётка
Иод
Структурные частицы — молекулы
Физические
свойства:
малая твёрдость
легкоплавкость
летучесть
способность к возгонке
Иод
Слайд 12Закон постоянства состава веществ
Жозеф Луи Пруст
(1754 – 1826) – французский химик –
аналитик.
Исследование состава различных веществ, выполненное им в 1799-1803 годах, послужило основой открытия закона постоянства состава для веществ молекулярного строения.
Каждое химически чистое вещество независимо от местонахождения и способа получения имеет постоянный состав и свойства.

Слайд 13Металлические вещества
В узлах решётки находятся атомы и
катионы.
Слайд 14Металлическая кристаллическая решётка
Медь Cu
Структурные частицы – атомы
и катионы
Физические свойства:
твёрдость, кроме ртути
Hg
ковкость, пластичность, тягучесть
электропроводность
теплопроводность
металлический блеск

Слайд 15Определите кристаллические и аморфные вещества
NaHCO3
2) Полиэтилен (-СН2-СН2-)n
3) Древесная смола
7) Сера S
4)
Кремний Si
5) «Сухой лёд» СО2

Слайд 16Определите тип кристаллической решётки у веществ
Пищевая
сода NaHCO3
Кремний Si
Нафталин С10Н8
«Сухой лёд»
Медный купорос СuSO4•5H2O

Слайд 17
Почему изделие из кремния при ударе
раскалывается
на кусочки,
а изделие из свинца
только
расплющивается?

Слайд 18Удивить готов он нас — Он и уголь,
и алмаз, Он в карандашах сидит, Потому что он
— графит. Грамотный народ поймет То, что это …
Большая императорская
корона Российской империи
Определите элемент и
тип кристаллической решётки веществ

Слайд 19Вы, ребята, мне поверьте — Этот газ вполне
инертен. Он спокойный и ленивый, В трубках светится красиво. Для
рекламы нужен он, Незаметный газ …
Определите вещество и тип кристаллической решётки
Источник: thepresentation.ru
Кристаллические и аморфные тела
Рассмотрим твердые тела подробнее. По упорядоченности мельчайших частиц, из которых состоят твердые тела, их можно разделить на аморфные и кристаллические.
Чем отличаются кристаллические и аморфные тела
У кристаллических тел есть строго упорядоченное положение мельчайших частиц. Эти частички образуют правильную кристаллическую решетку (рис. 1).
Примечание: Атомы кристаллических тел располагаются в узлах кристаллической решетки. Связи между атомами обозначены линиями. Эти линии у различных кристаллических тел образуют разные пространственные фигуры.
Рис.1. Кристаллические тела имеют более упорядоченную структуру в твердом состоянии, чем аморфные тела
Аморфные тела не обладают строгой упорядоченностью мельчайших частиц — молекул, из которых они состоят. У аморфных тел порядок есть, но он не так выражен, как у кристаллических тел. Аморфное тело по своему строению больше похоже на очень вязкую жидкость, чем на твердое тело. Поэтому, аморфные тела обладают текучестью.
Основные отличия кристаллических и аморфных тел приведены на рисунке 2.
Рис. 2. Сравниваем свойства кристаллических и аморфных тел
Примечания:
- Благодаря текучести, спустя много лет после изготовления, верхняя часть установленного в раму оконного стекла, становится немного тоньше, чем его нижняя часть.
- Канифоль со временем может принимать форму сосуда, в который ее поместили.
Переход:
- из жидкого в твердое состояние – кристаллизация;
- из твердого в жидкое состояние – плавление;
Плавление аморфных тел
Аморфные тела конкретной температуры плавления не имеют. Строение аморфных тел больше похоже на очень вязкую жидкость, чем на твердое кристаллическое тело. Во время нагревания они будут становиться более текучими, все больше проявляя свойство жидкости. При этом, хрупкость, присущая твердому состоянию, будет исчезать. Одновременно с плавлением, температура аморфных тел будет повышаться.
Важно! Одновременно с плавлением, температура аморфных тел будет непрерывно повышаться. Потому, что такие тела не имеют конкретной температуры плавления.
Примеры аморфных тел
- канифоль (смола хвойных деревьев);
- стекло;
- эбонит;
- сургуч;
- различные пластмассы;
Примечание: Эбонит («Эбенос» др.-греч. — чёрное дерево) – это вулканизированный каучук с добавлением большого количество серы, до 50 % от массы каучука. Цвет эбонита обычно тёмно-бурый или чёрный. Этот материал не проводит электрических ток – то есть, является хорошим изолятором.
Плавление кристаллических тел
Чтобы кристаллическое тело начало плавиться, его нужно нагреть до определенной температуры. Одни кристаллические тела будут плавиться при низкой температуре, а другие – при высокой. То есть, у каждого вещества своя температура плавления. Ее можно найти в справочнике физики. При этом, пока вещество не расплавится, его температура изменяться не будет.
Важно! Кристаллические тела имеют конкретную температуру плавления. Пока кристаллическое вещество полностью не расплавится, его температура не изменится!
Примечания:
- Кристаллические вещества плавятся при той же температуре, при которой они будут превращаться в твердое тело (кристаллизоваться).
- Чтобы жидкое вещество начало кристаллизоваться, оно сначала должно остыть до определенной температуры.
- Температура плавления и температура кристаллизации – это одна и та же температура.
Примеры кристаллических тел
- лед;
- свинец;
- алюминий;
- ртуть;
- железо;
- золото;
- серебро;
Как на графике выглядит процесс плавления кристаллического тела
Рассмотрим переход из твердого состояния в жидкое — плавление и, обратно — кристаллизацию, на примере льда.
Возьмем лед при начальной температуре «-40» градусов по Цельсию (рис. 3) и поместим его в кастрюльку. Поставим эту кастрюльку на газовую плиту и начнем нагревать лед.
Процесс нагревания льда изображается наклонной линией синего цвета. Потому, что время идет, а температура льда повышается.
Во время нагревания льда от отрицательной температуры до нуля градусов, в емкости будет содержаться только твердый лед.
Рис.3. Процесс плавления – это горизонтальная линия на температурном графике
Как только будет достигнута температура плавления льда – «0» градусов по Цельсию, лед начнет превращаться в жидкость. В кастрюльке начнет понемногу появляться вода. То есть, будет присутствовать и лед, и вода одновременно. Постепенно воды становится все больше, а льда – все меньше.